Рассмотрена биологическая роль алифатических аминокислот линейного строения для организма человека и произведен комплексный анализ коллигативных и вязкостных характеристик водных растворов указанных аминокислот. Показана актуальность исследования данных характеристик, поскольку многокомпонентные растворы аминокислот используются в медицине и фармации в виде инфузионных растворов в качестве источников для парентерального питания, а к данным лекарственным формам предъявляются требования изотоничности и изовязкости крови человека. Водные растворы индивидуальных аминокислот (глицина, α-аланина, ε-аминокапроновой кислоты, глутаминовой кислоты) характеризуются линейным изменением коллигативных и вязкостных свойств с ростом концентрации вплоть до достижения предела растворимости. Определены уравнения линейной регрессии соответствующих зависимостей. По величинам коэффициентов корреляции Пирсона доказано существование достоверной корреляционной связи между концентрацией аминокислот и температурами замерзания растворов, осмотическим давлением, кинематической, динамической и относительной вязкостью.
Аминокислоты как основные составные части белков участвуют во всех жизненных процессах наряду с нуклеиновыми кислотами, углеводами и липидами. При попадании в живой организм аминокислоты сразу же включаются в биохимические процессы [8]. Биохимические процессы, как химические реакции, сопровождаются изменением общей энергии системы, т.е. энергии живого организма. Функции аминокислот в системах живых организмов схематично показаны на рис. 1. Большинство α-аминокислот обладают широким спектром биологической активности. Так, лизин, треонин, фенилаланин, тирозин, аспарагин, глутамин, глицин, серин, аргинин являются исходными веществами для синтеза антител, гормонов, ферментов и других веществ. Аланин участвует в метаболизме сахаров и органических кислот. Метионин, триптофан, лизин, аргинин способствуют снижению уровня холестерина в крови, выведению тяжелых металлов из организма (метионин, цистеин), росту и восстановлению тканей (гистидин, изолейцин, лейцин, глицин, серин, пролин). α-Аминокислоты служат источником энергии на клеточном уровне (валин, лейцин, изолейцин, глутамин). Серосодержащие аминокислоты – метионин, цистеин – являются донорами серы, достаточное содержание которой в организме способствует полноценному формированию волос, кожи и ногтей. Эти аминокислоты принимают участие в создании вторичной структуры белков за счет образования дисульфидных мостиков [8].
Рассмотрим биологическую роль алифатических аминокислот линейного строения – глицина, β-аланина и ε-аминокапроновой кислоты – для организма человека. Глицину принадлежит важнейшая роль в деятельности мозга, поскольку глицин участвует в образовании важнейших биологически активных соединений (пуриновых нуклеотидов, гема, креатина и др). Глицин выполняет функцию тормозного нейромедиатора и контролирует процессы формирования тонкой моторики пластических процессов и тонусных реакций поперечнополосатой мускулатуры. Поэтому в неврологической практике глицин широко используется для устранения повышенного мышечного тонуса [1]. В организме человека основная масса глицина сконцентрирована в спинном мозге. Глицин является регулятором обмена веществ, нормализует и активирует процессы защитного торможения в центральной нервной системе. Глицин обладает адреноблокирующим, антиоксидантным и антитоксическим действием, за счет чего уменьшает психоэмоциональное напряжение, агрессивность, конфликтность, улучшает настроение, повышает социальную адаптацию; повышает умственную работоспособность; облегчает засыпание и нормализует сон; уменьшает проявления вегетососудистых расстройств в целом и выраженность общемозговых расстройств при ишемическом инсульте и черепно-мозговых травмах; уменьшает токсическое действие алкоголя и других лекарственных средств, угнетающих функцию центральной нервной системы.
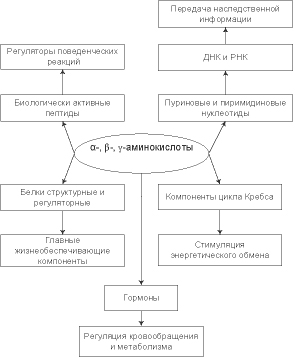
Рис. 1. Функции аминокислот в живом организме
Аминокислота β-аланин синтезируется в организме человека, поэтому не является незаменимой. Биологическая роль β-аланина заключается в его участии в синтезе пантотеновой кислоты (витамина В5), которая необходима для синтеза ацилкоэнзима А. В свою очередь ацилкоэнзим А необходим для ферментов цикла карбоновых кислот (цикл Кребса) и жизненно необходим для синтеза основного субстрата энергетического метаболизма – аденозинтрифосфата АТФ. β-Аланин участвует нормализации терморегуляции и способствует стабилизации энергетического метаболизма за счет увеличения содержания пантотеновой кислоты, является важнейшим координатором фонда возбуждающих и тормозных нейромедиаторов, повышает дыхательную активность нейроцитов, ускоряет утилизацию глюкозы и улучшает кровообращение. β-аланин широко используется в медицинской практике для лечения мигреней, цереброваскулярной недостаточности и других заболеваний нервной системы, связанных с нарушением кровообращения [1, 2, 8]. Данная аминокислота обладает выраженным диуретическим действием и при этом выгодно отличается от классических диуретических средств, так как не требует коррекции электролитов [1].
ε-аминокапроновая кислота не входит в перечень 20-ти аминокислот, из которых построены белки организма человека. При этом ε-аминокапроновая кислота проявляет выраженную биологическую активность, которая для организма человека заключается в активизации детоксикационной функции печени, проявлении противоаллергического действия, в специфическом кровоостанавливающем действии при кровотечениях (обеспечивает стабилизацию фибрина и его отложение в сосудистом русле, способствует агрегации тромбоцитов и эритроцитов крови).
Живые организмы, в том числе и человеческий организм, характеризуются высоким содержанием воды. При протекании биохимических процессов происходит расходование реагентов и образование продуктов реакции, поэтому любая биохимическая реакция сопровождается изменением концентрации целого набора веществ, а значит, возможны изменения осмотических характеристик и вязкостных свойств биологических жидкостей [3-7, 10, 12]. Из литературных данных [10] известно, что структура биологических жидкостей характеризуется наличием дальнего порядка, т.е. помимо согласованного взаимного расположения и ориентации близко расположенных групп и сегментов молекул (ближний порядок) проявляется согласованное действие молекул определенного функционального назначения. При этом молекулы биологических жидкостей не только перемещаются на определенные расстояния, но и принимают необходимую пространственную ориентацию [10]. Это в свою очередь также находит отражение на коллигативных и вязкостных характеристиках биологических жидкостей.
Биологические объекты – аминокислоты, белки, пептиды – являются сырьем для производства лекарственных препаратов: препараты крови и плазмы крови, препараты, содержащие определенный набор аминокислот, биологически активные добавки, включающие лецитин, витамины, ферменты, энзимы и т.д. Препараты аминокислот широко представлены как в ассортименте пищевых и биологически активных добавок, так и в ассортименте лекарственных веществ. Комплексными препаратами аминокислот являются инфузионные растворы («Аминостерил», «Аминоплазмаль», «Инфезол», «Ликвамин» и т.д.) или сухие смеси для спортивного питания. Индивидуальные аминокислоты входят в состав таблеток («Глицин Форте», «Клималанин» и т.д.), глазных капель («Тауфон»), растворов для инъекций («Тауфон», «Карнитен»), порошков («Левокарнитин», «Треонин», «Цистин» и т.д.).
В связи с этим целью данного исследования является обобщение и комплексный анализ коллигативных и вязкостных характеристик водных растворов аминокислот линейного строения.
Материалы и методы исследования
В качестве объекта исследования использовали водные растворы аминокислот: глицина, β-аланина, ε-аминокапроновой кислоты и глутаминовой кислоты. Определение температуры замерзания проводили на автоматическом криоскопическом осмометре ОМТ–5–02. Предварительно прибор калибровали с помощью серии растворов рабочих стандартных образцов натрия хлорида. Испытуемые растворы различной концентрации помещали в кювету прибора, погружали в термостат с контролируемой температурой и замораживали. Осмолярность раствора автоматически определяется по фиксированной температуре замерзания.
Определение вязкости термостатированных при 25оС растворов аминокислот проводили при помощи вискозиметра ВПЖ-2, диаметр капилляра 0,73 мм, константа капилляра 0,03045.
Обсуждение результатов
Охарактеризовать свойства растворов веществ с точки зрения их совместного присутствия позволяет криоскопический метод. При замораживании растворов оценивается изменение температуры замерзания раствора по сравнению с чистым растворителем, эффективная осмотическая концентрация растворенного вещества и осмотическое давление. Эти показатели, отражающие коллигативные свойства растворов, являются одними из важнейших для систем, применяемых для парентерального введения [1, 2].
Коллигативные свойства растворов в целом определяются общей концентрацией осмотически активных частиц. Проанализируем, как изменяется число частиц в водном растворе, содержащем аминокислоту. Молекулы аминокислот имеют в своем составе карбоксильную группу и аминогруппу, а поэтому являются амфолитами [8]. Диссоциация карбоксильной группы и протонирование аминогруппы протекает в соответствии с уравнениями:
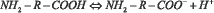
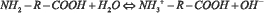
Возможен перескок протона от карбоксильной группы к аминогруппе и образование биполярного цвиттер-иона в соответствии с уравнением:
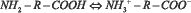 .
.
Сила молекул аминокислот как кислот и как оснований характеризуется константами диссоциации [5-7]. Константы диссоциации глицина, β-аланина и ε-аминокапроновой кислоты по типу кислоты или основания составляют величины порядка 10-10 – 10-11 независимо от расположения аминогруппы. Значения констант диссоциации очень малы, а, значит, диссоциация карбоксильной группы и/или протонирование аминогруппы в водных растворах протекают крайне незначительно. Реакция образования цвиттер-иона не сопровождается увеличением числа частиц. Изучение осмотических характеристик растворов глицина и β-аланина показывает, что эффективная осмотическая концентрация частиц, выраженная в единицах молярности, практически совпадает с аналитически рассчитанной молярной концентрацией аминокислот [5-7]. Значит, увеличения числа частиц в растворе не происходит, и при анализе осмотических характеристик растворов данных аминокислот не нужно учитывать процессы, изменяющие число частиц (диссоциацию, протонирование или образование ионных ассоциатов). Аналогичные результаты получены для глутаминовой кислоты, которая является двухосновной аминокислотой линейного строения и имеет существенно меньшую растворимость в воде и существенно бoльшую константу диссоциации одной из карбоксильных групп (Ка1=3,09·10-5) [8]. Экспериментально установлено, что для индивидуальных аминокислот в водных растворах характерно линейное понижение температуры замерзания и линейное увеличение осмотического давления с ростом концентрации аминокислоты вплоть до достижения предела растворимости (рис. 1, 2). Двухкомпонентные смеси низкомолекулярных аминокислот проявляют коллигативные свойства, аналогичные индивидуальным аминокислотам, т.е. сохраняется тенденция линейного изменения температуры замерзания растворов и осмотического давления с коэффициентами корреляции не ниже 0,99.
Таблица 1
Уравнения линейной аппроксимации и коэффициенты корреляции для вязкости глицина, β-аланина и ε-аминокапроновой кислоты.
|
Вязкость |
Глицин |
β-аланин |
ε-аминокапроновая кислота |
|
Кинематическая |
υ=0,935+0,0170·С% R=0,99 |
υ=0,930+0,0320·С% R=0,99 |
υ=0,90+0,051·С% R=0,98 |
|
Динамическая |
η=0,880+0,0200·С% R=0,99 |
η=0,89+0,038·С% R=0,99 |
η=0,84+0,049·С% R=0,97 |
|
Относительная |
ηотн=0,826+0,0200·С% R=0,99 |
ηотн=0,84+0,036·С% R=0,99 |
ηотн=0,79+0,047·С% R=0,97 |
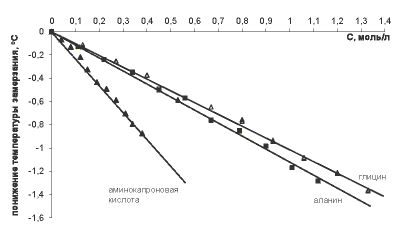
Рис. 1. Температура замерзания водных растворов одноосновных алифатических аминокислот
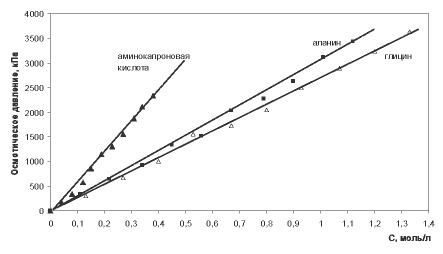
Рис. 2. Осмотическое давление водных растворов одноосновных алифатических аминокислот
Анализ вязкостных характеристик водных растворов алифатических аминокислот показывает, что для них характерна тенденция линейного изменения кинематической, динамической и относительной вязкости с ростом концентрации аминокислот и тенденция определенного влияния длины углеводородной цепи молекулы на вязкостные характеристики растворов. Наиболее выраженное влияние на вязкость растворов среди аминокислот линейного строения оказывает ε-аминокапроновая кислота. Каждый 1% ε-аминокапроновой кислоты в растворе увеличивает показатели кинематической, динамической и относительной вязкости на величину порядка 0,050 [11]. Глицин и β-аланин являются короткоцепочечными аминокислотами и характеризуются показателями увеличения вязкости на уровне 0,020 и 0,036 на каждый 1% аминокислоты соответственно (таблица 1). Корреляционную связь между характеристиками вязкости и концентрацией аминокислот следует оценивать как сильную и достоверную [9] согласно величине коэффициентов корреляции Пирсона, по модулю входящих в интервал [0,7; 1].
Выводы:
1. Выявлена общая тенденция линейного изменения коллигативных и вязкостных свойств водных растворов таких биологических объектов, как алифатические аминокислоты. Значимое отличие от растворов низкомолекулярных кислот – глицина и β-аланина – демонстрируют растворы ε-аминокапроновой кислоты, что может быть связано с наложением молекулярных характеристик (линейного размера молекулы) на свойства, определяемые общим числом частиц в растворе.
2. Тенденция линейного изменения коллигативных свойств сохраняется, если в водных растворах присутствуют двухкомпонентные смеси аминокислот.
Библиографическая ссылка
Миняева О.А. АМИНОКИСЛОТЫ, КАК БИОЛОГИЧЕСКИЕ ОБЪЕКТЫ, В ВОДНЫХ РАСТВОРАХ // Научное обозрение. Биологические науки. – 2016. – № 6. – С. 43-47;URL: https://science-biology.ru/ru/article/view?id=1021 (дата обращения: 20.04.2024).


 science-review.ru
science-review.ru