На протяжении последних десятилетий активно изучается роль гена, кодирующего рецептор витамина D (VDR). VDR является медиатором действия 1,25(OH)2D3 путем модуляции транскрипции генов-мишеней и был позиционирован как один из генов-кандидатов генетического контроля поддержания достаточной костной массы [33]. Исследования показали, что 1,25(OH)2D3 является стероидным гормоном, и его конечная точка приложения непосредственно связана с генетически детерминированными свойствами рецептора витамина D. Рецептор витамина D обнаружен во многих тканях и органах, включая желудочно-кишечный тракт, мочеполовую систему, органы эндокринной системы, а также в культуре клеточных линий скелетно-мышечной системы. Это явилось главным доказательством того, что биологическое действие 1,25(OH)2D3 выходит за рамки гомеостаза кальция и фосфора и играет ключевую роль в клеточной пролиферации и дифференцировке.
Рецептор витамина D (VDR) является членом надсемейства ядерных рецепторов транскрипционных регуляторов и посредником разнообразных биологических эффектов не только кальцитриола (1,25 (ОН)2D3), но и его аналогов. VDR предположительно возник путем дупликации анцестрального гена вместе с прегнан Х рецептором (PXR – оба члены подсемейства NR1I) [32].
Ген VDR расположен на коротком плече 12 хромосомы имеет размер 75 Кб и содержит 11 экзонов. В гене выделяют некодирующую и кодирующую области. Некодирующая область находится на 5-конце гена и включает экзоны 1А, 1В и 1С. Последующие 8 экзонов кодируют структурную часть белкового продукта гена VDR. В гене VDR описано значительное количество аллельных вариантов, однако наиболее функционально значимыми являются 4 полиморфных сайта в позиции соответствующих точкам узнавания эндонуклеаз: BsmL, TaqI, FokI (рисунок).
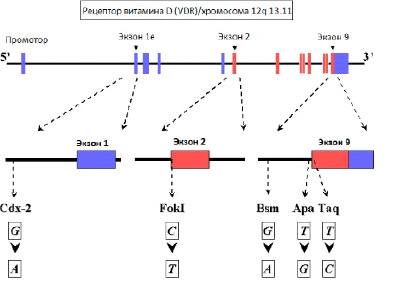
Структура гена VDR: Сdx-2, FokI, Bsm, Apa, Taq – сайты для узнавания соотвествующих рестриктаз; G – гуанин; A – аденин;C – цитозин; T – тимин
Сохранение в VDR 18 из 22 лиганд-связывающих остатков было показано на видах позвоночных, от миноги до человека [20]. Разнообразная роль витамина D в развитии иммунитета, пролиферации и дифференцировке клеток [34], адсорбции фосфата и гомеостазе кальция [5] является, скорее всего, причиной избытка VDR во всех видах [9].
Лиганд-связанный VDR в комплексе с X рецепторами ретиноидов действует как перспективный фактор транскрипции [11]. Он трансактивирует или подавляет многочисленные гены-мишени путем связывания с положительным или отрицательным витамин-респонсивными элементами витамина D (VDREs и nVDREs, соответственно), присутствующими в промоторах, энхансерах или супрессорах этих генов [38]. В этом качестве VDR регулирует экспрессию генов, участвующих в разнообразных биологических функциях, включая развитие органов, контроль клеточного цикла, гомеостаз кальция и фосфата в метаболизме костей и детоксификацию ксенобиотиков [11]. VDR также играет роль в обеих врожденной и адаптивной ветвях иммунной системы, влияя таким образом на диапазон заболеваний. Неинфекционные заболевания, связанные с витамином D и VDR включают рак, а также аутоиммунные заболевания, такие как систематическая красная волчанка, болезнь Крона, диабет I типа, рассеянный склероз и ревматоидный артрит [16]. Инфекционные заболевания, связанные с VDR включают в первую очередь ВИЧ, туберкулез (ТБ) и проказу [36].
Известно, что VDR участвует в пролиферации и дифференциации клеток. VDR экспрессируется в нескольких белых кровяных клетках, включая моноциты и активированные Т- и B-клетки. Витамин D увеличивает экспрессию гена тирозингидроксилазы в медуллярных клетках надпочечников. Он также принимает участие в биосинтезе нейротрофических факторов, синтезе синтетазы оксида азота и повышении уровня глутатиона. Помимо активации VDR, известны различные механизмы альтернативного действия. Важным из них является его роль как природного ингибитора передачи сигнала с помощью белка хеджехог (гормона, участвующего в морфогенезе). [35]
Анализ онтологии генов (ГО) предполагаемых 11031 генов-мишеней VDR обнаруживает, что эти гены-мишени были вовлечены в ряд различных функции, а именно, метаболизм клеток (43 %), и морфология тканей (19 %), слияние клеток и адгезия (10 %), дифференцировка и развитие (10 %), ангиогенез (9 %), и транзиция эпителиальной ткани в мезенхимальную (5 %) [6]. Участие VDR в таком большом количестве разнообразных болезней и физиологические функции делает его сильным координатором для изучения основных механизмов заболеваний и их возможной профилактики [1,37]. Следовательно, важность функции VDR, и развитие экспрессии VDR, гарантирует понимание основных механизмов регуляции гена VDR.
Регулирование VDR в основных условиях и при индукции многогранно; оно формируется под воздействием окружающей среды, генетики и эпигенетики. Изучение взаимодействия и комбинированной роли этих трех аспектов регуляции генов будет способствовать более общему пониманию предрасположенности и прогрессирования заболеваний, связанных с VDR, таких как рак и туберкулез. Этот подход к изучению регуляции генов по отношению к болезни был выдвинут Бьорнссоном и др в качестве гипотезы генетики и эпигенетики распространенных заболеваний (CDGE) (2004).
Разнообразные факторы окружающей среды регулируют VDR, среди которых диета [22], солнце [17], возраст [10], загрязнение окружающей среды [2] и инфекции [23]. Большинство из этих факторов оказывают свое воздействие на VDR регулирование путем изменения уровней витамина D. Витамин D является коллективным названием для холекальциферола (D3) и эргокальциферола (D2), которые являются предшественниками активного VDR лиганда – 1?,25 (ОН)2D. Витамин D связывающий белок (DBP) транслоцирует витамин D из кожи [18] или кишечника в кровеносную систему, где он остается связанным с ним во время циркуляции в крови. DBP поставляет витамин D в печень для активации [9], где 25-гидроксивитамин D (25(OH)D) синтезируются из витамина D и снова доставляется с помощью DBP в кровеносную систему. Затем многофункциональный эндоцитотический клиренс рецептор мегалин способствует поглощению DBP-25(OH)D комплекса в проксимальные канальцы почки посредством эндоцитоза [30]. Этому процесс способствует ассоциированный с мембранами корецептор кубулин, который локализуется с мегалином [31]. Синтез активного 1?,25(OH)2D происходит в почках или другой ткани-мишени, которая катализируется CYP27B1, экспрессирующегося в большинстве тканей, включая клетки иммунной системы [42]. Последний поддерживает паракринную и аутокринную функцию в процессах, связанных с иммуннитетом.
При связи с VDR, активный витамин D (1?,25(OH)2D) регулирует экспрессию VDR посредством VDREs находящегося в его собственных энхансерах [43], таким образом, витамин D саморегулирует VDR. Хотя точный механизм регуляции гена VDR пока не известен, этот тип регулирования часто достигается путем модификации хроматина ядра посредством модификации гистонов и метилирования ДНК или деметилирования, происходящим в связи с корепрессорами и коактиваторами [7, 20, 25]. Приобретение предшественника витамина D, а также производство и биодоступность активного лиганда является важным для регулирования и активности VDR. Стабилизация белка VDR посредством его лиганда, увеличение его полужизни, является еще одним механизмом, с помощью которого экологически приобретенный витамин D может модулировать уровни VDR [38].
Исследования Трампа и других показывают, что витамин D (1,25 дигидроксихолекальциферол или кальцитриол) имеет значительную противораковую активность in vitro и in vivo в различных моделях рака человека, мышей и крыс (карцинома, рак простаты, легких, поджелудочной железы и миелома) [12-26, 39-40]. Кальцитриол индуцирует арест клеточного цикла, индуцирует и модулирует маркеры апоптоза и снижает сигналы выживаемости [8-29] in vitro и in vivo в большинстве из этих модельных систем. Глюкокортикоиды усиливают кальцитриол-опосредованную активность в преклинике (in vitro и in vivo) и клинике. Исследования показали, что дексометазон (dex) значительно усиливает противораковый эффект кальцитриола и уменьшает гиперкальцемию, вызванную кальцитриолом. Dex увеличивает присоединение лиганда рецептора витамина D (VDR) в раковых клетках in vitro и in vivo, в то время как в слизистой кишечника [41], где происходит абсорбция кальция [19], он его снижает.
VDR обнаружен не только в классических органах-мишенях (слизистая кишечника, почки, кости) и во многих других эпителиальных и мезенхимальных клетках, но также и в лейкемических и других злокачественных клетках. Кальцитриол ингибирует рост клеток in vitro и in vivo в моделях рака толстой кишки и рака молочной железы. Кальцитриол может индуцировать дифференциацию, арест клеточного цикла и апоптоз в лейкемических и раковых клетках. Прогрессия посредством клеточного деления регулируется при помощи циклинов и ассоциированных с ними циклин-зависимых киназ. Ингибиторами циклин-зависимых киназ p21Waf1/Cip1 и p27Kip участвуют в аресте G1-фазы. В клетках HL-60 кальцитриол блокирует деление клетки в G1-фазе; этот эффект достигается посредством увеличения p27. Кальцитриол-опосредованный арест в фазах G0/G1 также наблюдается в линиях клеток рака молочной железы. В линиях миеломоноцитарных клеток человека U937 функциональный VDRE был идентифицирован в регионе промотора p21, а также было обнаружено, что транскрипционная активация p21 с помощью VDR способствовала дифференцировке в этой линии клеток. [4].
Таким образом, нами были рассмотрены функции рецептора витамина D в организме человека, также выявлено что низкий уровень экспрессии VDR приводит к развитию многих распространенных заболевании, к числу которых относится и лейкоз.


 science-review.ru
science-review.ru