В качестве биоиндикаторов загрязнения водоемов органическими веществами некоторые авторы выделяют следующие макрофиты-мезосапробы: элодея канадская, виды рода ряска, рдесты плавающий и рдест гребенчатый, кубышка желтая, роголистник погруженный, водяной лютик (род шелковник) [6]. Также существуют данные о способности к бионакоплению элементов группы тяжёлых металлов (ТМ) исследованными нами видами водных растений [2-4]. Вопрос очистки сточных и подсточных вод от загрязнения ТМ стоит остро на территории Брянской области, в связи с деятельностью предприятий металлургического и химического секторов производства, отличающихся высокими показателями относительно выбросов поллютантов в окружающую среду. Одно из направлений наших исследований – изучение поглотительной способности фоновых макрофитов (для территории южного Нечерноземья) по отношению к кобальту и цинку.
Для оценки накопительной и фиторемедиационной возможности водных растений по отношению к ионам ТМ с площади 0,25 м2 водоёмов г. Брянска собиралась биомасса растений. Исследовались макрофиты – Lemna minor L., Lemna trisulca L., Hydrocharis morsus-ranae L., Utricularia vulgaris L., Ceratophyllum demersum L., Elodea canadensis L., Batrachium aquatile L. Макрофиты принадлежат к экологическим группам плейстофитов и плавающих в толще воды гидрофитов [1]. Номенклатура видов сосудистых растений указана по работе С.К. Черепанова (1995) [5].
Собранные растения выращивались в лабораторных условиях при искусственном освещении (11-часовом световом дне) и температурой воды от +22 до +25 °С. Для выращивания макрофитов использовалась водопроводная отстоянная в течение 7 суток вода. Навеска макрофитов (1,5 ± 0,3 г.) помещалась в раствор ТМ с определенной концентрацией и выращивалась в стеклянных конических колбах ёмкостью 250 мл. В течение 15-22 суток через определенные промежутки времени проводился отбор и измерение концентрации ионов ТМ в растворах. Остаточная концентрация ТМ определялась методом спектрофотометрии и атомно-абсорбционной спектрометрии. Предельно допустимая концентрация (ПДК) для водных объектов хозяйственно-питьевого и культурно-бытового назначения принималась в 1 мг/л.
Изучена индивидуальная поглотительная особенность катионов цинка для макрофитов ряски малой, ряски трёхдольной, элодеи канадской и лютика водного (табл. 1). Предварительно готовили серию растворов хлорида цинка, концентрацией 2 мг/л. Для спектрофотометрического определения цинка применяли высокочувствительную методику с дитизоном [1].
Таблица 1
Остаточная концентрация Zn2+ в растворах с макрофитами (метод спектрофотометрии)
|
Макрофиты |
Концентрация цинка (мг/л) |
|||
|
1 сутки |
3 сутки |
6 сутки |
12 сутки |
|
|
Lеmna minor |
2,05 |
0,275 |
0,157 |
0,148 |
|
Lemna trisulca |
2,05 |
0,13 |
0,252 |
0,114 |
|
Ceratophyllum demersum |
2,05 |
0,159 |
0,051 |
0,043 |
|
Elodеa canadеnsis |
2,05 |
0,267 |
0,144 |
0,127 |
|
Batrachium aquatile |
2,05 |
0,347 |
0,233 |
0,160 |
Результаты позволяют сделать вывод о том, что гидатофиты на примере роголистника в данном опыте проявляют наибольшую, в сравнении с плейстофитами, накопительную способность. Так, концентрация катионов цинка в эксперименте с Ceratophyllum demersum на 3 сутки уменьшилась в 12 раз, а на 12 сутки в 47 раз, что составляет 97% очистки воды от загрязнения цинком. Наименьшая адсорбция ТМ наблюдалась в эксперименте с лютиком водным, данный вид также отличается худшей жизнеспособностью в камеральных условиях.
Также изучена способность поглощения катионов кобальта макрофитами. Измерение остаточной концентрации кобальта с содержанием ионов до экспонирования растений 2 мг/л проводили на атомно-абсорбционном спектрометре МГА-915.
Исследования поглотительной способности водных макрофитов различных экологических групп в одновидовых и двувидовых аккумулятивных комплексах показали следующее (табл. 2).
Таблица 2
Изменение концентрации ионов Со2+ в растворах с начальной концентрацией 2 мг/л в присутствии макрофитов
|
Видовой состав поглотительных комплексов |
1 сутки |
3 сутки |
6 сутки |
12 сутки |
|
Hydrocharis morsus-ranae |
1,98 |
0,0090 |
0,0105 |
0,0114 |
|
Ceratophyllum demersum |
1,98 |
0,0098 |
0,0066 |
0,0025 |
|
Lemna minor |
1,98 |
0,0083 |
0,0117 |
0,0120 |
|
Lemna trisulca |
1,98 |
0,0089 |
0,0106 |
0,0170 |
|
Elodеa canadеnsis |
1,98 |
0,0001 |
0,0094 |
0,0093 |
|
Ceratophyllum demersum и Hydrocharis morsus-ranae |
1,98 |
0,0098 |
0,0108 |
0,0130 |
|
Ceratophyllum demersum и Lemna trisulca |
1,98 |
0,0107 |
0,0079 |
0,0044 |
|
Batrachium |
1,98 |
0,0001 |
0,0001 |
0,0089 |
|
Контроль |
1,98 |
1,9765 |
1,9765 |
1,9765 |
На 7-12 сутки экспонирования наблюдались существенные морфологические изменения у водокраса лягушачего и двувидовых поглотительных комплексов с ним, поэтому поглотительная способность резко упала.
Во всех опытных растворах концентрация ионов Со2+ уменьшалась после добавления макробионтов, несмотря на значительную концентрацию этого ТМ. На шестые сутки концентрация Со2+ уменьшилась в сотни раз при экспонировании всех макрофитов. На 12 сутки наблюдалось явление десорбции у видов: Hydrocharis morsus-ranae, Lemna minor, Lemna trisulca и у комплекса с водокрасом. Особо необходимо выделить элодею канадскую, в опыте с которой, на 3 сутки прибором не зафиксировано присутствие ионов кобальта, следовые количества катиона появляются лишь на 6-12 сутки. Немного меньшую, но все же высокую поглотительную способность показал роголистник, как в одновидовом, так и в комплексном экспонировании. Явление десорбции для роголистника не наблюдалось. Низкие значения остаточной концентрации кобальта наблюдались после экспонирования в раствор с ТМ шелковника. Ниже ПДК содержание Со2+ ни в одном из поглотительных комплексов не снижалось. Поглотительная способность всех макрофитов по отношению к ионам Со2+ показала положительные результаты. Вид роголистник, шелковник и элодея канадская можно рекомендовать для фиторемедиационных мероприятий для поверхностных вод в отношении кобальта.
Также впервые нами изучена поглотительная способность макрофитов по отношению к группе ионов металлов кобальт-цинк при одновременном присутствии данных поллютантов в модельном растворе. Были составлены модели растворов с катионами двух металлов и проверена поглотительная способность макрофитов по отношению к Co : Zn при их совместном присутствии. Для вод Нечерноземья РФ эти данные представлены впервые. Камеральные исследования поглотительной способности водных макрофитов различных экологических групп представлены на рисунке.
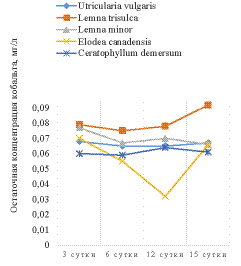
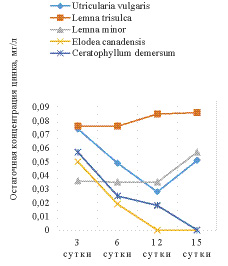
Рис. 1. Изменение концентрации ионов кобальта (слева) и цинка (справа) в присутствии макрофитов
Во всех опытных растворах наблюдалось снижение концентрации металлов, причем все виды, не зависимо от экологической группы преимущественно поглощали катионы цинка. Более того, в опыте с погруженными макрофитами – элодеей и роголистником – остаточная концентрация катионов цинка не фиксировалась атомно-адсорбционным спектрометром на 12 и 15 сутки соответственно. Также не наблюдалась обратной сорбции в раствор катионов цинка в эксперименте с этими растениями. В опыте с плавающими макрофитами, а также с пузырчаткой наблюдалось постепенное снижение концентрации тяжелых металлов с минимумом на 6 сутки в случае с цинком и на 12 с кобальтом, затем незначительное увеличение концентрации цинка и кобальта в последующие сутки. Это говорит о меньшей поглотительной способности плавающих гидрофитов.
Также можно отметить, что в растворе, содержащем в качестве ТМ только катионы цинка, на 12 сутки экспозиции в раствор роголистника, произошло падение концентрации ТМ на 97%. В растворе, содержащем два иона ТМ, падение концентрации цинка превысило 99%. Картина изменения концентрации кобальта в растворах противоположна. При присутствии в растворе только кобальта, биоочистка воды роголистником и элодеей протекает эффективнее, чем в растворе, содержащем кобальт и цинк в равных концентрациях.
Таким образом, в качестве сорбентов тяжелых металлов рекомендовано использовать Ceratophyllum demersum и Elodеa canadеnsis, в результате чего достигается снижение концентрации ионов цинка и кобальта ниже уровня ПДК в 1-12 сутки экспозиции растений. На 10-12 сутки в большинстве случаев начинается процесс сорбции металлов обратно в раствор, поэтому данные сроки необходимо учитывать при построении технологического цикла очистки вод.
Поглощение водными макрофитами различных химических элементов, в том числе и металлов, способствует очищению природных вод. Водные растения не только поглощают металлы в концентрациях, превышающих ПДК, но при этом не теряют жизнеспособность на момент сорбции и аккумуляции.


 science-review.ru
science-review.ru