Важным звеном в решении проблемы здорового питания является интенсификация животноводства, птицеводства и рыбоводства, которая возможна только при принятии и неукоснительном исполнении концепции рационального кормления животных.
На фоне высокой обсемененности кормов и различных объектов внешней среды условно-патогенными микроорганизмами происходит опережающее заселение кишечника новорожденных животных энтеробактериями и замедление процессов колонизации кишечной стенки, нормальной микрофлорой – молочнокислыми бактериями, бифидобактериями, пропионовокислыми бактериями и энтерококками. Проблема профилактики и лечения желудочно-кишечной патологий у животных и птицы, возбудителями которых являются условно-патогенные кишечные микроорганизмы, имеет не только экономическое, но и социальное значение. Экономические убытки от сальмонеллеза в США оцениваются в 2 млрд долларов, в Канаде 300 млн долларов. В странах СНГ за последние 15 лет заболеваемость людей и птицы сальмонеллезом возросла в 7 раз, при этом этиологическое значение S.enteridis в заболевании людей возросло на 30 %, у животных и птицы на 75 %, а индикация возбудителя в продуктах питания увеличилась на 50 % [25].
Избыточное или неправильное применение антибиотиков в животноводстве неизбежно приводит к накоплению их в сверхдопустимых количествах в основных продуктах питания, создавая угрозу для здоровья человека, вызывая дисбиозы, аллергии, снижая иммунитет [44, 51, 64]. Все эти обстоятельства заставляют признать необходимость использования нового поколения экологически безопасных препаратов, способных занять свое место в системе мероприятий по обеспечению биологической защиты животных.
Использование кормов, обогащенных биологически активными кормовыми добавками, натуральными продуктами с лекарственными свойствами, минеральными соединениями и витаминами позволяет предотвратить развитие многих патологий у животных [4, 63]. С этих позиций пробиотики следует рассматривать как эффективную альтернативу антибиотикам, как часть рационального потенциала животных, поддержания их здоровья и получения продукции высокого качества, безопасной как в бактериальном, так и в химическом отношении [9, 13, 34,48].
Пробиотики - живые микроорганизмы в форме моно- или смешанных культур; при употреблении в достаточных количествах пробиотики оказывают значительное положительное воздействие на здоровье хозяина [11, 66]. Наиболее важными аспектами взаимодействия пробиотических штаммов с микрофлорой кишечника и организмом животного являются образование антибактериальных веществ, конкуренция за питательные вещества и место адгезии, изменение микробного метаболизма (увеличение или уменьшение ферментативной активности), стимуляция иммунной системы, противораковое и антихолестеринемическое действия [6, 33].
Пробиотики сдерживают или лечат диарею [44], антибиотикоустойчивую диарею [51], синдром раздраженной толстой кишки [43, 59], воспалительные заболевания кишечника [52,53], вагинальные инфекции [68], атопический дерматит [67], аллергию [55], ревматоидный артрит [68], хронический высокий уровень холестерина и раковые образования [42, 56].
Принцип действия пробиотиков заключается в следующем:
– антагонистическая активность по отношеню к Escherichia coli, Staphilococcus aureus, Shigella sp., Salmonella typhimurium, enteritidis и др.
– продуцирование пищеварительных ферментов (амилаз, липаз, протеаз, пектиназ, эндоглюконаз);
– продуцирование рибофлавина и аминокислот, в т.ч. незаменимых;
– способность синтезировать биологически активные вещества, стимулирующие развитие целлюлолитических руминококков, лактобацилл;
– антитоксическое действие, в т.ч. подавление микотоксинов;
– иммуномодулирующее действие (активация макрофагов, стимулирование выработки интерферона, синтез иммуноглобулинов);
– восстанавливающее действие.
В последнее десятилетие концепция пробиотиков претерпела существенные изменения. Возросло внимание исследователей к структурным компонентам и продуктам метаболизма пробиотических микроорганизмов. Данные изменения связаны с расширением представлений о биологической эффективности пробиотиков и обнаружении того факта, что структурные элементы клеток и их метаболиты в ряде случаев оказываются не менее эффективными [60].
Антибактериальная активность пробиотиков обусловлена способностью продуцировать спирты, перекись водорода, молочную, уксусную и другие органические кислоты, синтезировать лизоцим и бактериоцины широкого спектра действия (лактолин, низин, ацидофилин, лактоцид и др.). Они могут угнетать рост других видов также за счет более высокого биологического потенциала, быстрого размножения и достижения М–концентрации, более короткой lag–фазы, изменения рН или окислительно-восстановительного потенциала среды. Пробиотики способны также синтезировать многие биологически активные вещества: такие как витамины, особенно группы В, соединения тетрапирольной структуры. Всасываясь в кровеносное русло, многие из них активно участвуют в энергетическом и витаминном обменах, играя важную роль в жизнеобеспечении организма хозяина [6]. Другой функцией пробиотиков является защита от патогенной микрофлоры, которая обеспечивается разными механизмами. Неспецифическую защиту кишечника от патогенных бактерий и вирусов, пробиотическая микрофлора, совместно с нормофлорой кишечника, выполняет путем создания антагонистического барьера, так называемой колонизационной резистентности кишечника. Вступая в тесный контакт со слизистой оболочкой кишечника и покрывая поверхность толстым слоем, она механически предохраняет ее от внедрения патогенных микроорганизмов.
По мнению ряда исследователей [6, 27, 58], чтобы быть включенными в группу пробиотиков, микроорганизмы должны соответствовать следующим критериям: предлагаемые для производства штаммы должны быть выделены от природных субстратов; идентифицированы до вида по фено- и генотипическим признакам; иметь генетический паспорт; штаммы должны обладать широким спектром антагонистической активности в отношении патогенных и условно-патогенных микроорганизмов; не должны угнетать нормальный микробиоценоз; оказывать положительный эффект на организм хозяина, например увеличивать противоинфекционную резистентность; иметь в своем составе жизнеспособные клетки или продукты их метаболизма; обладать способностью к выживанию и жизнедеятельности в условиях кишечного микроокружения, например, микроорганизм должен быть резистентен к низким значениям рН и органическим кислотам, к высокому содержанию желчи, солей натрия; должны быстро размножаться и/или адгезироваться на эпителиальных клетках кишечника с последующей колонизацией; должны быть непатогенными и нетоксичными, безопасными для людей, включая иммунологическую безопасность; производственные штаммы должны быть стабильны по биологической активности, сохранять жизнеспособные бактерии в течение длительного срока хранения и удовлетворять технологическим требованиям.
Указанным критериям в наибольшей степени соответствует автохтонная группа содружественных микроорганизмов, включающая такие постоянные обитатели кишечной экосистемы, как лакто- и бифидобактерии, кишечная палочка. Так, наиболее часто в состав пробиотиков входят микроорганизмы, безопасные для здоровья человека и животных, обладающие широким спектром протективных свойств, в частности, бифидобактерии видов Bifidobacterium adolescentis, Bif. bifidum, Bif. langum, Bif. globosum, Bif. thermophilus; молочнокислые бактерии Lactobacillus acidophilus, L. planlarum, L. bulgaricus. L. rhamnosus, L. fermentum; стрептококки Streptococcus faecium, Str. lactis diastaticus; Escherichia coli. Пробиотические эффекты могут быть вызваны и некоторыми группами аллохтонных микроорганизмов. Примером тому служит пробиотическое использование культуры дрожжей Saccharomyces boulardii, которые не являются нормофлорой желудочно-кишечного тракта человека, но вместе с тем способны предотвращать повторение псевдомембранозного колита, вызываемого Clostridium difficile. [29]. Некоторые представители обширной группы спорообразующих бактерий — Bacillus, Brevibacillus, Clostridium, Sporolactobacillus — способны предотвращать кишечные расстройства и порой даже в большей степени, чем традиционные пробиотики на основе лакто- и бифидобактерий ]. Однако, применение спорообразующих бактерий в качестве пробиотиков, особенно для потребителей с ослабленным иммунитетом, вызывает большие споры среди исследователей. Основными, вызывающими опасение ученых, факторами являются родство спорообразующих бактерий Bacillus subtilis, Bacillus licheniformis, Bacillus cereus van Toyi, Ruminococcus albus, Bacillus panthothenticus и других с патогенными и токсигенными видами, такими как Bacillus anthracis, Clostridium рerfringens, С.botulinum, а также то, что они в большинстве чужеродны микрофлоре кишечного тракта [29].
В настоящее время все микробные кормовые добавки в соответствии с Директивой № 70/254/EEC Европейского союза и руководящими принципами Научного комитета по питанию животных (Scientific Committee on Animal Nutrition — SCAN) подвергаются детальной оценке на безопасность с целью получения гарантий на предмет их безвредности как для самих животных, так и для потребителей животной продукции. Вся концепция безопасности пищи SCAN — в емкой формуле: «от фермы к вилке» (from the Farm to the Fork). Особое внимание уделяется тестированию микроорганизмов на присутствие передающихся маркеров устойчивости к антибиотикам и продукции вредных метаболитов. Недавно SCAN выступил с инициативой о внедрении концепции «Квалифицированного восприятия безопасности» (Qualified Perception of Safety — QPS), которая позволила бы штаммам с установленным безопасным статусом выходить на рынок без обширных испытаний. Вероятно, и далее Европейское агентство по безопасности пищевых продуктов (European Food Safety Authority, EFSA) будет играть центральную роль в регулировании пробиотиков как для людей, так и для животных.
В связи вышеизложенным, становится актуальным особенный акцент разработчиков пробиотиков для животноводства на использование лактобактерий. Они безвредны для организма, у них отсутствует привыкание при длительном употреблении, полностью отсутствуют побочные явления.
Известно, что молочнокислые бактерии продуцируют вещества с антимикробной активностью (такие, как органические кислоты, диацетил, перекись водорода, реутерин, реутерициклин, антифунгальные пептиды и бактериоцины). Среди них, особое место, занимают бактериоцины, рибосомально синтезируемые экстрацеллюлярные пептиды или белковые молекулы с бактериоцидным или бактериостатическим механизмом действия по отношению к близкородственным видам микроорганизмов [30]. Дальнейшие исследования показали их антибактериальную активность против более филогенетически отдаленных грампозитивных и иногда против грамнегативных бактерий.. Спектр ингибирования некоторых бактериоцинов включает микроорганизмы, вызывающие порчу продуктов и/или распространяющиеся через пищу (Campylobacter jejuni, Listeria monocytogenes, Salmonella typhimurium и др.). В настоящее время изучено и охарактеризовано много различных типов бактериоцинов МКБ, но самыми известными являются низин, лактицин, энтероцин, педиоцин и плантарицин [5,30,49,57]. Бактериоцины молочнокислых бактерий рассматриваются как безопасные натуральные презерванты или, биоконсерванты, относящиеся к группе безопасных веществ или, так называемой GRAS-группе (generally regarded as safe).
Лактобактерии имеют способность сорбировать вещества, вызывающие аллергические реакции и гиперчувствительность к компонентам корма. Они участвуют в формировании феномена «оральной толерантности» к пищевым антигенам, то есть помогают организму при пищевых аллергиях. Микроорганизмы поддерживают гуморальный и клеточный иммунитет, стимулируют выделение лизоцима, активируют фагоцитоз, что повышает общий уровень защиты организма от инфекций [62]. Последние исследования показали, что лактобациллы могут помогать в борьбе с некоторыми видами рака [3, 42].
Ацидофильные лактобактерии поддерживают состояние прямой кишки и предупреждают ее воспаление, дивертикулит (образование в слизистой оболочке кишки «карманов» из лишней ткани), синдром раздраженного кишечника.
Выполняющие защитную и детоксицирующую функцию в организме человека, участвующие в симбиозах как с животными, так и с растениями, лактобактерии интенсивно используются в производствах про- и пребиотических продуктов; продуктов, нетрадиционно обогащенных молочнокислыми бактериями, например, таких как мороженое, соевый йогурт, шоколад, овощные лактоферментированные соки; натуральные пищевые консерванты; а также применяются в медицине как лечебные средства, которые при попадании в желудочно-кишечный тракт быстро адаптируются и возобновляют активный метаболизм [22, 39, 40, 47, 50, 61].
Разнообразие разрабатываемых пробиотиков быстро растет благодаря широкому использованию микробных генетических ресурсов, доступность которых во многом связана с эффективной работой биологических коллекций, сохраняющих и изучающих микробное разнообразие, а также с развитием методологии генетической и метаболической инженерии [2]. В настоящее время по сведениям Всемирного центра насчитывается свыше 500 коллекций микроорганизмов различного профиля, и число их продолжает расти, а фонды достигают десятки тысяч культур микроорганизмов [15]. В мировой практике накоплением, хранением и распространением сведений о культурах микроорганизмов занимаются более чем в 60 странах, из которых 19 государств являются участниками Будапештского Договора о международном признании депонирования микроорганизмов. Многие коллекции получили статус международных организаций, к ним относятся CNCM (Франция), DСSM (Германия), NCAIM (Венгрия), JFO (Япония), CBS (Нидерланды), ВКМ, ВКПМ, ВНИНА, ВНИИГенетика (Россия). ССАР, CMCC, ECACC, NCIB, NCTC, NCYC (Великобритания), ARS (NRR), ATCC, IVI (США) и данное направление микробиологии занимает приоритетное положение [23, 41, 54, 65].
В Казахстане, кроме РГП «Республиканская коллекция микроорганизмов» КН МОН РК, основанной в 2001 году, существует 12 коллекций микроорганизмов, поддерживаемых в научно-исследовательских организациях, в том числе в Казахском НИИ перерабатывающей и пищевой промышленности.
Коллекция микроорганизмов Казахского НИИ перерабатывающей и пищевой промышленности постановлением Правительства республики Казахстан № 830 от 30 июля 2002 года «О республиканской коллекции микроорганизмов» определена Депозитарием промышленных микроорганизмов. В настоящее время в коллекции на хранении и исследовании находится 2022 культуры микроорганизмов для перерабатывающей и пищевой промышленности (молочнокислые бактерии, дрожжи и др.). В коллекции КазНИИППП к настоящему времени генотипировано 80 наиболее ценных штаммов молочнокислых бактерий и дрожжей, все эти культуры, имеют генетические паспорта, что является наиболее важной отличительной характеристикой нашей коллекции. Богатые генетические ресурсы коллекции являются основой прикладных исследований по изучению межштаммовых взаимодействий микроорганизмов, в том числе молочнокислых бактерий, созданию консорциумов и заквасок на их основе для хлебопекарной и молочной промышленности, пробиотических препаратов для сельскохозяйственных животных, птиц и рыб, биопрепаратов для силосования кормов [18, 35, 37, 38, 46]. Наличие коллекции микроорганизмов при разработке пробиотических препаратов способствует интенсификации поисковой части работы, исключает дублирование исследований, в частности, рутинное выделение и длительную идентификацию необходимой культуры из различных источников, проводящихся в институтах и лабораториях [15, 16].
Немаловажным аспектом отбора культур для конструирования пробиотиков является изучение межштаммовых взаимодействий молочнокислых бактерий. Процесс синтеза бактериоцинов контролируется и синхронизируется межклеточными коммуникативными взаимодействиями («чувство кворума») и является механизмом, позволяющим изменять плотность клеточной популяции [24]. Особую значимость изучение антагонистических свойств лактобацилл приобретает в свете внедрения в технологические циклы метода совместного культивирования микроорганизмов.
Для первичного исследования природы антагонистической и бактериоцинногенной активности пробиотических культур, наряду с традиционным методом отсроченного антагонизма, рекомендуется использовать метод диффузии в агар [20], с небольшой модификацией. Для устранения ингибирующей активности, обусловленной органическими кислотами, рН супернатанта культуральной жидкости исследуемого штамма доводят до значения рН 6,0 добавлением 1 М NaOH. Для ликвидации перекиси водорода в супернатант добавляют каталазу в конечной концентрации 1 мг в 1 мл. Положительным результатом на присутствие бактериоцина в супернатанте считается наличие зоны ингибирования роста тест-культуры для определения антибиотической активности (например, Bacillus subtilis ATCC 6633) вокруг лунки c рН 6,0 и в присутствии каталазы. Установка мембранной ультрафильтрации Vivaflow 50 (Sartorius, Германия) позволяет провести первичное разделение супернатанта, содержащего бактериоциногенное вещество на фракции с различной молекулярной массой (30000Д, 10000 Д и 5000Д) и определить их соотношение. Определение во фракциях растворимого белка подтверждает пептидную природу бактериоцинов, а прогревание на водяной бане при 700С в течение 10 минут позволяет оценить термостабильность бактериоциногенных фракций [35].
Более точную и тонкую идентификацию бактериоцинов, в зависимости от целей и задач исследования, следует проводить молекулярно-генетическими методами [9].
В настоящее время на рынке пробиотиков востребованы комбинированные препараты. Входящие в комплексный пробиотик штаммы бактерий объединяются в консорциум по способности штаммов продуцировать различные ферменты, биологически активные вещества так, чтобы они дополняли или усиливали друг друга по биологической активности. Особую значимость изучение биосовместимости, т.е. способности к совместному культивированию или хранению (межштаммовых антагонистических взаимодействий) микроорганизмов приобретает в свете внедрения в технологические циклы метода совместного культивирования, который является перспективным при создании препаратов и продуктов на основе нескольких штаммов микроорганизмов. Перспективными в этом отношении можно считать штаммы бактерий, которые обладают выраженным антагонизмом к патогенным и условно-патогенным микроорганизмам и средним уровнем антагонизма к другим штаммам этого же рода. Наиболее простым и удобным методом изучения биосовместимости пробиотических культур, на наш взгляд, является метод наложенных капель на твердой среде МРС-4 для лактобацилл и на агаризованной ГМС для бифидобактерий, предложенный Н.А. Глушановой [12]. Культуры считают биосовместимыми в случае обнаружения полного «слияния» пятен (рис. 1, А), или усиления роста исследуемых штаммов в зоне совместного культивирования (мутуализм, синергизм, сателлизм) (рис.1, В).


А В
Рис. 1. Характер роста колоний у биосовместимых штаммов (А-«слияние» пятен у штаммов Lb. casei 22 и Lb. casei 104; В- усиление роста в зоне совместного культивирования у штаммов Saccharomyces cerevisiae ЛВ и Lactobacillus paracasei 2)
Между молочнокислыми бактериями существуют симбиотические связи, при которых лактобациллы могут расти в ассоциативных средах, бедных ростовыми веществами, взаимно дополняя потребности друг друга . Также при совместном культивировании биосовместимых штаммов достигается цель создания консорциума, обладающего усиленным комплексом свойств, присущих отдельным штаммам. Накопление молочной кислоты одними штаммами способствует синтезу веществ - пробиотиков другими штаммами, что усиливает антимикробную активность консорциума в отношении патогенной микрофлоры.
В связи с этим, актуальным является изучение механизмов формирования ассоциации пробиотических культур, определение динамики развития отдельных штаммов в консорциуме. Здесь возникает вопрос об идентификации и контроле культур молочнокислых бактерий непосредственно в поливидовой культуральной жидкости, т.е. без выделения чистых культур. При идентификации лактобацилл только с использованием стандартных микробиологических тестов могут возникнуть трудности [1].
Альтернативой классической биохимической идентификации могут служить иммунологические и генетические методы–ИФА, МФА, методы на основе полимеразной цепной реакции [8, 19, 26].
Молекулярно-генетическая характеристика молочнокислых бактерий необходима для проведения идентификации культур на этапе подбора штаммов-продуцентов в состав пробиотиков, для контроля стабильности штаммового состава на всех этапах производства препаратов. Наиболее распространенными методами применяемыми для уточнения видовой принадлежности культур в составе пробиотических препаратов является генетическая идентификация штаммов методом определения прямой нуклеотидной последовательности фрагмента 16s rRNA гена. Однако, учитывая высокую консервативность нуклеотидной последовательности 16s rRNA гена, филогенетический анализ не всегда позволяет провести четкую видовую дифференциацию штаммов [8, 36]. Полученные данные о молекулярно-генетической структуре исследованных штаммов необходимо вносить в генетические паспорта штаммов и использовать для контроля структуры и стабильности препарата-пробиотика в производстве.
Учитывая тот факт, что молочнокислые бактерии разных видов отличаются антигенной обособленностью, наиболее простым и удобным для видовой дифференциации лактобацилл в процессе создания консорциума пробиотических культур является использование метода люминесцирующих антител (непрямой способ Кунса) [1, 17]. На примере создания полиштаммового пробиотика «Биоконс» показано, что при обработке препаратов консорциума молочнокислых бактерий иммунными гомологичными сыворотками против одного вида лактобацилл при микроскопировании видны клетки со светящимся ярким зеленым ободком по краю, центр клеток имеет темный фон, в поле зрения также трудно различимы темные клетки без ободка. Таким образом, в препарате люминесцируют и выявляются только молочнокислые бактерии одного вида гомологичные используемой сыворотке. В контроле негомологические сыворотки не окрашивают культуры, что свидетельствует о специфичности используемого метода, наблюдение в темном поле окрашенных клеток подтверждает, что используемый консорциум состоит из четырех различных видов лактобацилл, отличающихся морфологически. Наблюдение в темном поле за динамикой изменения видового соотношения культур Lb. plantarum 2, Lactobacillus fermentum – 104, Lactobacillus casei var. alactosus – 22, Lactobacillus brevis– 67 в консорциуме показали, что соотношение культур консорциума меняется на протяжении всех 48 часов культивирования (рисунок 2).
Так, при засеве (0 часов), соотношение культур составляет 1:1:1:1. После 12 часов совместного роста, культура Lb. plantarum 2 начинает превалировать над другими культурами и к 24 часам культивирования ее количество составляет 2/3 всех клеток консорциума. После 36 часов культивирования доля клеток Lb. plantarum 2 в консорциуме начинает уменьшаться и к 48 часам соотношение культур снова возвращается к значению-1:1:1:1.
Таким образом, для получения стабильной смешанной культуры с заданным соотношением штаммов, необходимо проводить культивирование не менее 48 часов. Полученные результаты свидетельствуют также о том, что для дифференциации отдельных видов молочнокислых бактерий в ассоциативных культурах, метод люминесцирующих (или флуоресцирующих) антител дает положительные результаты. Этот метод позволяет определять видовой состав и устанавливать количественное соотношение штаммов в исследуемом консорциуме примерно через час после отбора проб.
Таким образом, иммунологическая система детекции лактобацилл на основе МФА обладает высокой чувствительностью и специфичностью, являясь в то же время достаточно простой и доступной, например, в сравнении с ПЦР-методиками.
Известно, что молочнокислые бактерии отличаются высокой нестабильностью своих свойств и для них характерно появление в популяции особей, отличающихся от исходного типа внешним видом и структурой колоний, а также наследственно закреплёнными изменениями некоторых морфологических, культуральных и биологических свойств.
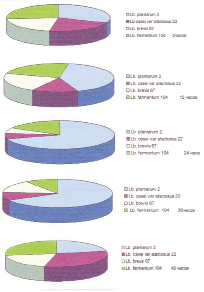
Рис. 2. Динамика соотношения клеток лактобацилл консорциума в процессе культивирования (%)
При этих изменениях основные таксономические характеристики данного вида обычно сохраняются. Соотношение активных и неактивных клеток определяет активность популяции в целом.
Распространенным методом косвенного определения активности молочнокислых бактерий является применение индикаторов-красителей, восстановленные формы которых под действием ферментов микроорганизмов изменяют окраску. Известна методика определения активности молочнокислых бактерий по скорости перехода голубой окраски метиленовой сини (0,01% р-р) в бесцветную [1].
Контроль стабильности генома пробиотических культур в процессе длительного использования и хранения можно проводить с использованием ISSR-маркеров[10,45].. В наших исследованиях показано применение 9 ISSR маркеров: M2-(ac)8ctg, M3-(ga)8(ct)c, M4-(ag)8(ct)c, M5-(at)8, M7-(cag)5, M8-(gtg)5, UBC 840- (ga)8ayt, UBC 855 – (ac)8cyt, UBC 881 – ggg-tgg-ggt-ggg-gtg для оценки молекулярно-генетической стабильности 17 штаммов бактерий рода Lactobacillus, Lacyococcus и Bifidobacterium: Lactobacillus acidophilus ББ-15; Lb. acidophilus КГ-5; Lb. delbrueckii subsp. bulgaricum AM-1;Lb. delbrueckii subsp. lactis СГ-1; Lb. brevis-67; Lb. brevis-8; Lb. caseivar.alactosus -22; Lb. fermentum -96; Lb. fermentum – 104; Lb. plantarum -2; Lb. acidophilus 3КН-2; Lb. acidophilus КН-1; Lb. acidophilus КМ-2; Lactococcus lactis subsp. cremoris TM-5; Lc. lactis subsp. lactis K-8; Bifidobacterium bifidum S; Bifidobacterium bifidum H, выделенных из зернового субстрата, муки, молока и молочной продукции, хранящихся в генбанке в лиофильно-высушенном виде в течение 10 лет. Изучен аллельный полиморфизм ISSRлокусов, всего получено 396 ампликонов. Установлено, что после 10 лет хранения в коллекции КазНИИППП, только у 4 штаммов Lb. brevis-67, Lb. casei var. alactosus -22, Lactobacillus acidophilus ББ-15 и Lb. delbrueckii subsp. bulgaricum AM-1 наблюдались изменения в геноме во фрагментах ДНК размером от 700 до 2000 п.н. Биохимические исследования показали, что изменения в ДНК этих лактобацилл не затронули структурные гены, влияющие, например, на один из фенотипических признаков – активность кислотообразования. Все изучаемые штаммы в период десятилетнего хранения сохраняли свою активность и высокий титр клеток на одном уровне.
Научное обоснование конструирования пробиотических препаратов основано на анализе взаимоотношений макро- и микроорганизма. Развитие фундаментальных исследований симбиотических взаимодействий организма и его микробиоты получило новое направление в связи с появлением представлений о существовании бактерий в виде биопленок, что определило уточнение роли пробиотиков и особенно - кормового назначения [14]. В настоящее время активно развивается представление о кишечной микробиоте как о самостоятельном «органе», который в виде биопленки покрывает стенку кишечника [28]. Сложившаяся в ходе развития организма биопленка - прочная система, препятствующая внедрению чужеродных штаммов. Коллективный иммунитет биопленки кишечника не позволяет в полной мере осуществлять коррекцию дисбактериозов с помощью препаратов живых культур пробиотиков - бифидобактерий, лактобацилл, энтеробактерий, поскольку промышленные штаммы микроорганизмов вследствие биологической несовместимости не могут войти компонентом в биопленку, и пополняют пул транзиторных бактерий.
На сегодняшний день существуют 5 типов пробиотических препаратов :
1 тип - Монокомпонентные препараты, содержащие один штамм бактерий.
2 тип - Самоэлиминирующиеся антагонисты, к которым относятся представители рода Bacillus.
3 тип - Комбинированные препараты, состоящие из нескольких штаммов бактерий (поликомпонентные или включающие добавки, усиливающие их действие).
4 тип - Иммобилизованные на сорбенте живые бактерии.
5 тип - Пробиотики в виде биопленки на твердом носителе.
Определяющим фактором эффективности пробиотиков во многом являются технологии получения этих препаратов. Современный подход к разработке пробиотических препаратов подразумевает, во-первых, применение различных видов микроорганизмов в определенных сочетаниях, во-вторых, выпуск их в форме, допускающей длительное хранение при обычной температуре, и в-третьих, не теряющих своих свойств при внесении их в процессе производства комбикормов и кормовых добавок.
В настоящее время на рынке пробиотиков востребованы комбинированные препараты. Входящие в комплексный пробиотик штаммы бактерий объединяются по способности штаммов продуцировать различные ферменты, биологически активные вещества так, чтобы они дополняли друг друга по биологической активности. Кроме того, для получения новых поликомпонентных биологически активных препаратов комбинируют пробиотики с пребиотическими веществами.
Пребиотики — это класс препаратов для регуляции кишечной микрофлоры, который приобретает все большую популярность. Пребиотики — субстраты, стимулирующие естественную микрофлору толстого отдела кишечника, не перевариваются и не всасываются в желудке и тонкой кишке. Попадая в толстый отдел кишечника, пребиотики используются в качестве питательной среды для нормальной микробиоты [52, 61].
Препараты в сухой форме имеют ряд положительных черт, например длительный срок годности, удобство хранения и реализации. Но процесс лиофилизации бактерий оказывает негативное влияние на структуру их поверхностных белков, активность адгезии, а также приводит к разрушению ценных бактериальных метаболитов.
К прогрессивным формам препаратов нового поколения относятся сорбированные (иммобилизованные) формы пробиотиков. Сорбированные пробиотики содержат бактерии, иммобилизованные на частицах твердого сорбента.
Иммобилизованные пробиотики имеют ряд принципиальных положительных отличий от традиционных форм. За счет химических и электростатических сил взаимодействие таких форм со стенкой кишечника выше. Иммобилизованная форма пробиотического препарата позволяет существенно повысить защиту микроорганизмов при прохождении через кислые условия желудка, где обычные препараты, содержащие лиофильно высушенные клетки пробиотиков, теряют более 90 % жизнеспособности. Это позволяет им беспрепятственно достигать нижних отделов пищеварительного тракта. Сорбенты, входящие в состав препаратов-пробиотиков, активно «собирают» токсические продукты при движении в просвете кишечника и принимают на себя их дренажно-детоксикационную и иммунную функции [31]. За счет комплексного действия высвободившихся пробиотических микроорганизмов и реализации собственных свойств сорбента-носителя инициируется репарация слизистой кишечника [21].
Известны исследования по конструированию жидкой формы иммобилизованных пробиотиков, оказывающих комплексное воздействие за счет положительного влияния сорбционной составляющей и пробиотических культур. Жидкая форма пробиотиков способствует реализации положительных свойств штаммов-продуцентов в полной мере, так как их клетки находятся в активном физиологическом состоянии, эффективно взаимодействуют со слизистой кишечника; кроме того, в жидкой среде сохраняются все бактериальные метаболиты [7, 32].
Разработка биотехнологий образования пробиотиками биопленок на твердом носителе - новое направление получения пробиотических препаратов повышенной биологической эффективности. Получение биопленки пробиотика позволяет не только повысить жизнеспособность клеток в неблагоприятных условиях высушивания, грануляции и т.п., но и адаптировать популяцию пробиотических микроорганизмов к условиям жизнедеятельности в кишечнике.
В целом пробиотики положительно влияют на организм хозяина, способствуют восстановлению пищеварения, биологического статуса, иммунного ответа, повышают эффективность вакцинаций. Применение пробиотиков существенно уменьшает расходы на лечение заболеваний у животных, повышает продуктивность последних и улучшает качество и безопасность готовой животноводческой продукции.


 science-review.ru
science-review.ru