Поиск препаратов направленного действия, способных осуществлять коррекцию иммунного статуса человека и животных, становится все более актуальной проблемой прикладной и фундаментальной иммунологии [12, 22, 24, 28, 29]. Особый интерес представляет поиск таких препаратов среди лекарственных растений [13, 18, 19, 23].
Можжевельник (Juniperus) издревле используется в народной и официальной медицине. Ископаемая древесина Juniperixylon Kalickii известна из палеоцена полуострова Челекен [1, 11]. В европейской медицинской практике наиболее известны и используемы – Juniperus communis L. (верес) – [1, 2], Junipеrus davurica – можжевельник даурский, можжевельник сибирский – Juniperus sibirica Burgs D., Juniperus nana Willd Pallas и можжевельник казацкий – Juniperus sabina LВ [26]. Из 60 видов можжевельников умеренного пояса северного полушария в бывшем СССР произрастало 20 видов, из которых 12 встречаются на территории Средней Азии [14, 15]. Juniperus turcomanica B. Fedtsch. – одна из разновидностей можжевельников, произрастающая в Туркменистане. Можжевельник туркменский (МТ) встречается в виде редколесья от нижнего до верхнего пояса гор в Юго-Западном и Центральном Копетдаге (Туркменистан) [26].
Целебные свойства можжевельника туркменского изучаются со времен Авиценны [2, 14] и привлекают внимание большого числа современных исследователей и в том числе авторов настоящей работы [8, 9, 20]. Сравнительно недавно нами было установлено, что при инкубации крови здоровых лиц в присутствии 5 % отвара МТ in vitro процентное содержание атипичных лимфоцитов (ALY) и больших незрелых клеток (LIC) прогрес-сивно снижается уже с 5 минуты инкубации. Поскольку истинного изменения численности лимфоцитов в пробе крови в закрытой системе невозможно, мы допустили, что препарат влияет на экспрессию мембранных рецепторов иммунокомпетентных клеток [17]. Однако фенотип лимфоцитов, чувствительных к отвару можжевельника, оставался не известным.
Цель настоящего исследования: изучить влияние 5 % отвара МТ на экспрессию мембранных рецепторов CD3+, CD19+, CD4+ , CD8+ , NK и T-NK субпопуляций лимфоцитов венозной крови практически здоровых лиц (ПЗЛ) in vitro.
Материалы и методы исследования
Изучены иммунограммы 40 ПЗЛ обоего пола в возрасте 19–25 лет. При выполнении работы был использован проточный цитофлюориметр Beckman coulter (USA). Кровь для исследования в количестве 5,0 мл забирали преимущественно из локтевой вены ПЗЛ при помощи вакутайнеров в специально предназначенные для приборов данного класса одноразовые пробирки (BD VACUTAINER K2E (EDTA) 5.0 ml). После первичного определения численности лимфоцитов фенотипов CD3+, CD19+ , CD4+ , CD8+ , NK и T-NK в пробирки вносили по 0,01 мл стерильного 5 % отвара МТ, тщательно перемешивали на шейкере при 150 колебаниях в минуту при комнатной температуре (+25С) в течение 60 минут. Через 5 и 60 минут инкубации повторно определяли численность указанных субпопуляций лимфоцитов в пробе крови.
МТ для исследования получали в Государственном институте лекарственных расте-ний АН Туркменистана в виде высушенной рубленой хвои, расфасованной в бумажные пакеты по 50 гр. 5 % отвар МТ (infusum ex 10:200) готовили в соответствии с требованиями Фармакопеи (1991) [27] по прописи для Juniperus communis L . [16]. В частности, 10,0 гр. сухой измельченной хвои можжевельника туркменского (Juniperus turcomanica) заливали водой комнатной температуры, доводили до кипения в водяной бане и выдерживали в этом режиме в течение 15 минут, баню отключали, отвар настаивали в течение 45 минут, затем процеживали и доливали первоначальный объем дистиллированной водой. Препарат готовили непосредственно перед проведением эксперимента.
Полученные данные математически обработаны при помощи компьютерной программы SPSS.
Результаты исследования и их обсуждение
Результаты исследования показали, что in vitro при условии длительного (в течение 1 часа) перемешивания при комнатной температуре пробы крови в присутствии фито-препарата изменяется численность некоторых субпопуляций лимфоцитов (табл. 1).
В частности, уже через 5 минут инкубации повышается численность лимфоцитов фенотипов CD3+, CD4+, NK и T-NK (p<0,05; 0,001; 0,05 и 0,05 соответственно). Несколько увеличивается против исходной численность CD8+ – и CD19+ – лимфоцитов, однако различие математически не достоверно (p>0,05 в обоих случаях). Через 60 минут инкубации несколько снижается, но остается выше исходного уровня численность CD3+- CD4+- , NK и T-NK-лимфоцитов, практически не изменяется численность CD8+ – и CD19+-лимфоцитов. Другими словами, рецепторы CD8+ – и CD19+-лимфоцитов ПЗЛ in vitro не чувствительны к фитопрепарату (в данном случае 5 % отвару МТ).
Таблица 1
Численность субпопуляций лимфоцитов ( %) в зависимости от времени инкубации в присутствии отвара Juniperus turcomanica
|
Группа |
Время |
Субпопуляции лимфоцитов |
|||||
|
CD3+ |
CD19+ |
CD4+ |
SD8+ |
NK |
T-NK |
||
|
I |
до введения препарата |
1200±98.3 |
157±62 |
632±28 |
405±39,3 |
130±12 |
79±8.7 |
|
II |
через 5 мин инкуб. |
1580±86* |
217±24 |
971±56** |
551±89,4 |
317±25*2,9 |
110,6±9,6* |
|
III |
Через 1 час инкуб. |
1440±78* |
203±16 |
892±62* |
481,3±56 |
267,7±26* |
105±10* |
Примечание. * – p<0,05; ** – p<0,001.
Поскольку в присутствии фитопрепарата наибольшие изменения численности пришлись на CD4+, NK и T-NK лимфоциты, мы провели корреляционный анализ между численностью изученных субпопуляций лимфоцитов (табл. 2).
Таблица 2
Корреляцилонный анализ численности некоторых субпопуляций лимфоцитов крови практически здоровых лиц
|
CD3+ |
CD19+ |
CD4+ |
CD8+ |
NK |
TNK |
|
|
CD3+ |
1 |
,101 |
,635 |
,630 |
,125 |
,224 |
|
CD19+ |
,101 |
1 |
-,415 |
,598 |
,367 |
,372 |
|
CD4+ |
,635 |
-,415 |
1 |
-,151 |
,270 |
-,338 |
|
CD8+ |
,630 |
,598 |
-,151 |
1 |
-,003 |
,689* |
|
NK |
,125 |
,367 |
,270 |
-,003 |
1 |
-,412 |
|
TNK |
,224 |
,372 |
-,338 |
,689* |
-,412 |
1 |
Корреляция значима на уровне 0.05 (2–сторон.).
Как видно из таблицы, численность CD3+-лимфоцитов связана достаточно сильной прямой зависимостью с численностью CD4+-, CD8+ – и слабой с – TNK лимфоцитов (r= 0,63; 0,63 и 0,22 соответственно). Она практически не связана корреляционной зависимостью с численностью NK-клеток (r=0,12). Но численность NK и TNK-клеток связана умеренной обратной зависимостью (r= –0,412).
Численность CD3+-лимфоцитов является одной из ведущих характеристик функционального состояния иммунной системы человека [28,29]. По этому параметру из числа ПЗЛ мы выделили 3 подгруппы – с численностью CD3+ – лимфоцитов, соответствующей популяционной норме (I группа), ниже популяционной нормы (II группа) и – выше таковой (III группа). В I группу вошли 52,5 %, во II группу 32,5 % и III группу 15 % из числа обследованных лиц. Результаты определения численности субпопуляций лимфоцитов в этих подгруппах представлены графически (рис. 1. А, В, С).
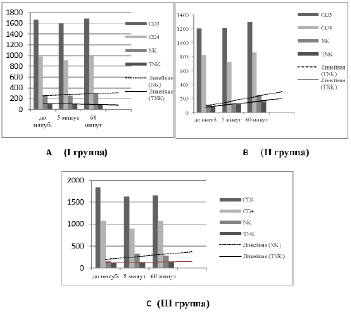
Рис. 1. Численность основных субпопуляций лимфоцитов в венозной крови практически здоровых лиц в зависимости от группы
На представленных диаграммах хорошо видно, что в случаях дисбаланса CD3+- клеток (II и III подгруппы) при инкубации пробы крови в присутствии отвара МТ наблюдается тенденция к нормализации численности CD3+, CD4+ , TNK-субпопуляций лимфоцитов и особенно NK клеток. Линии тренда для натуральных и тимусзависимых «киллеров» достаточно четко иллюстрируют зависимость их численности от исходного числа CD3+- лимфоцитов. Так, при исходно нормальном содержании в крови CD3+-лимфоцитов численность «киллеров» в присутствии МТ in vitro практически не изменяется (диаграмма А). При исходном дефиците CD3+ , равно как при избытке – численность TNK- лимфоцитов и NK клеток у ПЗЛ увеличивается, несмотря на исходную реципрокность их количества в целом по группе (диаграммы В и С). Однако динамика и степень изменения численности «киллеров» в подгруппах различны. Для более четкого представления о характере изменений мы ввели отношение NK/TNK и представили их графически (рис. 2).
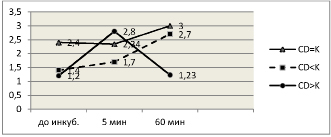
Рис. 2. Отношение численности NK/TNK в зависимости от времени инкубации и подгруппы обследованных лиц
На диаграмме видно, что при нормальном содержании CD3+ отношение NK/TNK составляет 2,4±0,5. Инкубация пробы крови в присутствии МТ приводит к некоторому увеличению этого отношения и через 60 минут инкубации оно составляет 3,0±0,6. Однако различие математически не достоверно (p>0,05). При исходном дефиците CD3+-лим-фоцитов и отношение NK/TNK составляет 1,4±0,1, что достоверно ниже против I группы (p<0,05). При инкубации крови в присутствии МТ оно прогрессивно увеличивается до 2,7±0,08 (различие достоверно против исходного уровня, p<0,001). При избытке CD3+ выявлено самое низкое отношение NK/TNK (1,2±0,08), которое резко увеличивается через 5 минут инкубации в присутствии МТ до 2,8±0,1 (p<0,001) и также резко возвращается к исходному уровню через 60 минут (1,23±0,09).
Таким образом, выявлена чувствительность натуральных и тимусзависимых «кил-леров» к МТ in vitro , а так же способность фитопрепарата нормализовать их соотношение. При этом, чем более выражен дисбаланс численности CD3+ -лимфоцитов, тем более чувствительны к препарату субпопуляции «киллеров».
Известно, что NK клетки (натуральные «киллеры») относятся к врожденной системе иммунитета и являются одной из важнейших составляющих первой линии обороны организма против вирус-инфицированных, мутировавших или раковых клеток [6,7, 25]. Натуральные «киллеры» обладают значительным генетически детерминированным репер-туаром мембранных рецепторов [7], экспрессия которых зависит от большого числа внешних и внутренних факторов [5]. Как натуральные, так и Т-киллеры распознают клетки-мишени за счет активации или ингибиции мембранных рецепторов [4]. Поскольку численность клеток, определяемая цитфлюориметром in vitro, в действительности не может изменяться можно, говорить о модуляциях экспрессии мембранных рецепторов лимфоцитов, инкубированных в присутствии отвара МТ. Известно, что NK клетки могут находиться в так называемом состоянии покоя и активация покоящихся натуральных киллеров происходит в основном под влиянием цитокинов Т-клеток и, в первую очередь, интерферона-гамма [3, 5, 10, 21]. В этой связи, полученные нами данные могут свидетельствовать о цитокиноподобной способности отвара МТ модулировать активность ре-цепторного аппарата определенных субпопуляций циркулирующих лимфоцитов и особенно «покоящихся» NK-клеток. Кроме того, отвар МТ, на наш взгляд, обладает противовирусным и противоопухолевым потенциалом.


 science-review.ru
science-review.ru