Азоспириллы (лат. Azospirillum) – род бактерий из семейства Rhodospirillaceae класса альфа-протеобактерий, представленный в настоящее время 18 видами. Большинство представителей данного рода являются природными симбионтами высших растений, в том числе пшеницы, риса и других злаков [1, 2]. Азоспириллы относятся к неспорообразующим бактериям и при неблагоприятных условиях формируют цисты.
В последние десятилетия уделяется большое внимание изучению состояния покоя у бактерий и получению некультивируемых форм значимых для человека микроорганизмов [3, 4]. Физиологические переходы покой – размножение у микроорганизмов мало изучены, что связано, прежде всего, с методическими трудностями получения их покоящихся форм. Что касается рода Azospirillum – подходы к получению покоящихся бактерий были разработаны и опробованы к началу нашей работы только на одном штамме – A. brasilense Sp245 [5, 6]. Учитывая тот факт, что штамм Sp245 обладает некоторыми уникальными чертами [1, 5], нельзя быть уверенным, что предложенный для него протокол подойдет для получения некультивируемых клеток других штаммов A. brasilense, а также других видов рода Azospirillum.
Цель исследования
Целью работы было получение, с использованием комплекса стрессовых факторов, и частичная характеристика покоящихся культур пяти представителей рода Azospirillum: A. brasilense SR80, A. doebereinerae GSF71, A. thiophilum VSU BV-S, A. fermentarium CC-LY743 и A. melinis TMCY 0552.
Материалы и методы исследования
Объектами исследования были 5 штаммов: A. brasilense SR80, A. doebereinerae GSF71, A. thiophilum VSU BV-S, A. fermentarium CC-LY743 и A. melinis TMCY 0552, полученных из Коллекции ризосферных микроорганизмов ИБФРМ РАН (г. Саратов, http://collection.ibppm.ru). Во всех случаях, за исключением экспериментов по получению покоящихся культур, бактерии культивировали с использованием синтетической малатной среды (СМС) следующего состава (г/л): K2HPO4×3H2O – 3,0; KH2PO4 – 2,0; NaCl – 0,1; NaMoO4×2H2O – 0,002; NaOH – 2,24; яблочная кислота – 3,76; NH4Cl – 0,5; дрожжевой экстракт – 0,1; MgSO4×7H2O – 0,2; СaCl2×2H2O – 0,02; FeSO4×7H2O – 0,02 (вносили в виде хелата) [6].
Бактерии выращивали при температуре 31°С в жидкой или на твердой СМС, pH среды 6,8. В качестве инокулята во всех экспериментах использовали культуру ранней стационарной фазы роста. Для получения покоящихся культур A. brasilense SR80 и A. doebereinerae GSF71 аликвоту вегетативной культуры вносили в физиологический раствор (0,9% NaCl), содержащий 4-н-гексилрезорцин и СuSO4 в концентрациях 0,3 и 0,4 мМ соответственно. Инокулят вносили в таком объеме, чтобы стартовая плотность бактерий в стрессовых условиях составляла 106 кл/мл. Число бактериальных клеток определяли, используя микробиологический стандарт мутности. Для получения бактерий A. doebereinerae, A. thiophilum, A. fermentarium и A. melinis в физиологическом состоянии покоя использовали СuSO4 в концентрации 0,3 мМ.
Для оценки колониеобразующей способности покоящихся (дормантных) клеток Azospirillum использовали чашечный метод Коха. Учет результатов проводили после 2-суточной инкубации при 31ºC. Для оценки возобновления роста покоящихся бактерий в свежей жидкой среде измеряли оптическую плотность культур при длине волны 595 нм на спектрофотометре Spekol 221 («CarlZeiss», Германия).
Световую микроскопию использовали в двух случаях – для контроля чистоты культур Azospirillum, а также для изучения возможного флокулообразования и кристаллообразования в исследуемых покоящихся культурах. Во всех случаях использовали препараты, приготовленные методом раздавленной капли. Образцы просматривали на лазерном диссекторе Leica LMD 7000 (Leica-microsystems, Германия) при увеличениях ×40, ×63, используя два режима: TL-BF (обычный просмотр) и TL-POL (режим поляризации). Работы проводилась в Центре коллективного пользования научным оборудованием в области физико-химической биологии и нанобиотехнологии «Симбиоз» ИБФРМ РАН.
Результаты исследования и их обсуждение
При получении покоящихся культур пяти видов рода Azospirillum за основу был взят подход, предложенный ранее для A. brasilense Sр245 [5, 6]. В случае A. brasilense SR80 в опубликованный протокол было внесено изменение (исключена одна процедура) – бактерии перед перенесением в условия жесткого стресса не отмывали, т.е. не удаляли факторы межклеточной коммуникации (табл. 1).
Использование модифицированного протокола позволило получить культуру A. brasilense SR80, содержащую жизнеспособные, но некультивируемые клетки (ЖНК). Бактерии при этом полностью утрачивали способность к размножению на твердой агаризованной среде СМС.
Таблица 1
Стрессовые факторы, использованные для получения некультивируемых клеток A. brasilense Sp245 [4] и SR80
|
№ |
Культуры Стрессовые факторы |
Sp245 |
SR80 |
|
1 |
Замена оптимальной среды на физиологический раствор |
+ |
+ |
|
2 |
Сниженная стартовая плотность культуры, 106 кл/мл |
+ |
+ |
|
3 |
Удаление факторов межклеточной коммуникации |
+ |
– |
|
4 |
Гексилрезорцин в среде, мМ |
0,3 |
0,3 |
|
5 |
CuSO4 в среде, мМ |
0,4 |
0,4 |
Примечание. Знаки «+» и «–» означают использование/неиспользование указанного стрессового фактора.
Эксперименты по оценке роста в свежей жидкой среде дали следующие результаты. При небольшом сроке действия стресса (от нескольких дней до нескольких недель) покоящиеся A. brasilense SR80 возобновляли размножение в свежей жидкой среде, но только в случае использования оптимального инокулята (рис. 1), то есть когда в свежую среду вносили достаточное количество ЖНК-содержащей покоящейся культуры – 10% от объема среды. С течением времени покоящиеся клетки штамма SR80 полностью утрачивали способность переходить к делению в свежей среде без внесения индукторов роста.
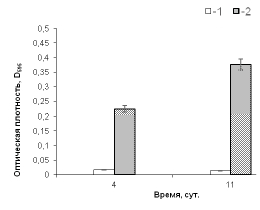
1 – инокулят, 5%; 2 – инокулят, 10%
Рис. 1. Возобновление роста покоящихся бактерий A. brasilense SR80 при пересеве в свежую жидкую среду СМС при субоптимальном (5%) и оптимальном (10%) инокуляте
В начальных экспериментах по получению покоящихся клеток A. doebereinerae комплекс стрессовых факторов был таким же, как и в случае A. brasilense SR80 и Sр245 (табл. 1). В результате было выяснено, что стрессоустойчивость A. doebereinerae GSF71 ниже, чем у штамма SR80 и Sр245 [4, 5]. Ни в одном из проведенных экспериментов не удалось зарегистрировать рост бактерий на твердой и в жидкой среде, что позволило предположить, что все бактериальные клетки погибали под действием стресса. В связи с этим для A. doebereinerae GSF71 и A. thiophilum VSU BV-S были взяты более мягкие стрессовые условия: концентрация сульфата меди была снижена с 0,4 мМ до 0,3 мМ. Так как сведения о стрессоустойчивости A. doebereinerae GSF71 и A. thiophilum VSU BV-S единичны, покоящиеся культуры каждого из штаммов готовили в двух вариантах: в первом случае в физиологический раствор с добавками 0,3 мМ гексилрезорцина и 0,3 мМ СuSO4 вносили 10% инокулята, во втором – 1% (от объема среды). В дальнейшей работе эти два варианта обозначали как ПК-1% и ПК-10% (покоящаяся культура с 1% и 10% инокулята соответственно).
Проведенные эксперименты показали, что клетки покоящихся культур A. doebereinerae GSF71 и A. thiophilum VSU BV-S утрачивают способность к образованию колоний на твердой агаризованной среде, но размножаются при перенесении в свежую жидкую среду СМС. Колониеобразующую способность дормантных бактерий A. doebereinerae GSF71 и A. thiophilum VSU BV-S проверяли трижды. Было установлено, что независимо от начальной плотности культуры (1 или 10 % инокулята) бактерии не образуют колоний на агаризованной синтетической среде (КОЕ = 0).
Следующим этапом работы было выяснение способности покоящихся бактерий штаммов GSF71 и VSU BV-S переходить к размножению в свежей жидкой среде без дополнительной стимуляции. Варианты A. doebereinerae GSF71: ПК-1% и ПК-10% (покоящаяся культура с 1% и 10% инокулята, соответственно) пересевали в свежую жидкую СМС и наблюдали за ними в течение 20 сут. Как видно из представленных данных (рис. 2), в случае 10%-ного инокулята бактерии со временем преодолевали стресс и достигали относительно высокой плотности (макс. среднее значение D595 = 0,4 через 16 сут.). При пониженной плотности (1% инокулята) оптические показатели роста были низкими (макс. среднее значение D595 =0,052 через 20 сут.).
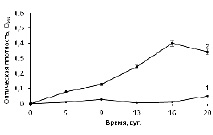
1 – культура ПК-1%, 2 – культура ПК-10%
Рис. 2. Возобновление роста покоящихся бактерий A. doebereinerae GSF71 из ПК-1% и ПК-10% в свежей жидкой среде СМС
Несмотря на сходство вариантов ПК-1% и ПК-10% A. thiophilum (оба утрачивали колониеобразующую способность), их физиологическое состояние было разным, что проявилось в эксперименте по возобновлению роста бактерий в свежей среде. Покоящиеся клетки ПК-1% не переходили к размножению, в то время как клетки ПК-10% размножались в свежей СМС, достигая достаточно высоких показателей роста (D595 = 0,45 через 20 сут.).
Подобные эксперименты были проведены с A. melinis TMCY 0552 и A. fermentarium CC-LY743, для каждого штамма получены варианты – ПК-1% и ПК-10%. После перенесения вегетативных клеток A. melinis TMCY 0552 и A. fermentarium CC-LY743 в стрессовые условия в вариантах ПК-1% и ПК-10% обеих культур наблюдалось увеличение оптической плотности. Это, в свою очередь, позволяет предположить, что на первых этапах формирования покоящихся культур происходило увеличение числа клеток, что хорошо согласуется с литературными данными [7]. Для того чтобы выяснить, утрачивают ли клетки дормантных культур A. melinis TMCY 0552 и A. fermentarium CC-LY743 колониеобразующую способность, делали высев бактерий на плотную агаризованную среду. Анализировали варианты ПК-1% и ПК-10% обеих культур дважды. Показано, что при увеличении продолжительности стресса покоящиеся культуры не формировали колонии на плотной среде.
Для более полной характеристики ростового потенциала покоящихся культур делали высевы из ПК-1% и ПК-10% A. melinis TMCY 0552 и A. fermentarium CC-LY743 в жидкую СМС. За ростом бактерий в свежей среде наблюдали в течение 3 недель (визуально и измеряя оптическую плотность). С течением времени культуры A. melinis TMCY 0552 и A. fermentarium CC-LY743 становились визуально мутными, D595 к концу наблюдения увеличилась в среднем до 0,1, что позволяло сделать вывод о переходе бактерий к делению.
При использовании современной световой микроскопии в покоящихся культурах изученных штаммов пяти видов рода Azospirillum были обнаружены флокулы, значительно варьирующие по размерам (рис. 3).
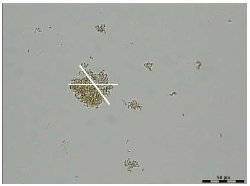
Рис. 3. Световая микроскопия дормантной культуры A. thiophilum VSU Bv-S. Размеры крупной флокулы (27×54 мкм)

А – в обычном режиме (TL-BF); Б – в режиме поляризации (TL-POL).
Рис. 4. Кристаллы в покоящейся культуре A. brasilense SR80
В ряде культур встречались флокулы двух типов. В первом случае они состояли преимущественно из матрикса, в то время как число покоящихся клеток было невелико. Флокулы второго типа состояли главным образом из плотно прилегающих друг к другу покоящихся клеток. Культуры разных видов рода Azospirillum различались между собой как по количеству свободных клеток, так и по их размерам. В покоящихся культурах A. brasilense SR80 и других видов помимо флокул обнаруживались также и кристаллы (рис. 4).
Их идентификацию проводили с использованием классического подхода – сравнивая изображения объекта в обычной режиме (рис. 4А) и в режиме поляризации (рис. 4Б).
Выводы
1. С использованием комплекса стрессовых факторов получены покоящиеся культуры представителей пяти видов рода Azospirillum – A. brasilense SR80, A. doebereinerae GSF71, A. thiophilum VSU BV-S, A. fermentarium CC-LY743 и A. melinis TMCY 0552.
2. Установлено, что в покоящихся культурах бактерии полностью утрачивают колониеобразующую способность, но при этом сохраняют способность возобновлять рост в свежей жидкой среде при оптимальном инокуляте.
3. В покоящихся культурах A. brasilense SR80, A. doebereinerae GSF71, A. thiophilum VSU BV-S, A. fermentarium CC-LY743 и A. melinis TMCY 0552 выявлено присутствие флокул и кристаллов.


 science-review.ru
science-review.ru