В настоящее время внимание исследователей и практиков стала привлекать взаимосвязь между сахарным диабетом и патологией желудочно-кишечного тракта. Это связано с тем, что имеется патогенетическая связь сахарного диабета с практически всеми органами желудочно-кишечного тракта, от пищевода до толстой кишки. Так, при диабете отмечены кандидоз, пародонтоз, кариес в полости рта, снижение секреции ферментов и соляной кислоты в желудке, ослабление рефлекторных реакций пищевода, жировая инфильтрация и дискинезия желчного пузыря, а также ослабление моторики желудочно-кишечного тракта. В тонкой кишке также при сахарном диабете зарегистрированы атрофические процессы в слизистой оболочке, изменения кишечной микрофлоры, нарушение кишечного всасывания и т.д. [1, 2].
Несмотря на то, что кишечная энтеропатия встречается у многих пациентов с диабетом [1, 2], научно обоснованных сведений для понимания этиопатогенеза заболеваний тонкой кишки и целевой терапии для противодействия вредного влияния сахарного диабета на морфофункциональное состояние тонкой кишки недостаточно, что требует более широких экспериментальных подходов. Исследование сдвигов кишечного пищеварения углеводов в тонкой кишке важно и потому, что кишечник играет весьма существенную роль в гомеостазе глюкозы, уровень которой при сахарном диабете в крови резко увеличивается [3]. Трудность понимания этиопатогенеза развития энтеральных патологий при диабете усугубляется и тем, что симптомы кишечной диабетической энтеропатии совпадают с другими симптомами кишечных нарушений или могут быть спутаны с побочными эффектами лекарств при лечении диабета [4]. Поэтому исследования гистоструктуры и особенностей гидролиза углеводов в тонкой кишке помогут пролить свет на развитие патологии кишечника, поспособствуют выбору адекватной комплексной терапии и предотвращению дальнейшего развития осложнений структурно-функциональных сдвигов тонкой кишки при сахарном диабете.
Цель исследования: изучить гистоструктуру тонкой кишки и активность энтеральных ферментов при аллоксан-индуцированном диабете крыс.
Материалы и методы исследования
В опытах были использованы белые беспородные крысы-самцы, массой 180–200 г. Животных содержали на стандартном рационе вивария, при комнатной температуре, естественном световом режиме и неограниченном доступе к воде и пище. Содержание, питание и уход за животными проводились согласно Европейской конвенции об охране позвоночных животных, используемых для экспериментов и в других научных целях [5].
Индукцию сахарного диабета вызывали внутрибрюшинным введением аллоксана моногидрата (DIAEM, OOO, Москва) в дозе 170 мг/кг массы тела животного. В экспериментальные наблюдения включали только крыс с устойчивой гипергликемией, т.е. тех животных, у которых уровень глюкозы в крови после введения аллоксана моногидрата был более чем в 3 раза больше контрольных величин. Крыс контрольной группы инъецировали тем же способом и в то же время эквивалентным объёмом физиологического раствора.
Забой животных проводили всегда в одно и то же время между 9.00 и 10.00 утра. При декапитации животных кровь собирали в парафиновые центрифужные пробирки и отстраивали при комнатной температуре в течение 30 мин. Затем пробы крови центрифугировали со скоростью 5000 об/мин в течение 15 мин. Супернатант осторожно отсасывали для определения в нем уровня глюкозы.
Для гистологического исследования извлеченнную из брюшной полости крыс тонкую кишку очищали от жировой ткани и промывали 10 мл холодного раствора Рингера (рН = 7,4). Затем из медиальной части тонкой кишки вырезали отрезок длиною в 1 см, который фиксировали в 10 % растворе формалина в течение не менее чем трех суток. Далее образцы для гистологического исследования тонкой кишки высушивали путем стандартной проводки по растворам с возрастающей концентрацией этилового спирта (70, 80, 96 и 100 %) и заливали парафином. Из парафиновых блоков готовили срезы толщиной 5–6 мкм, которые окрашивали гематоксилином-эозином. Препараты были сфотографированы световым цифровым микроскопом фирмы Лейка (DN-300M) (Германия).
Оставшиеся после взятия на анализ гистоструктуры части кишечника высушивали фильтровальной бумагой, взвешивали, разрезали вдоль органа и пластмассовым шпателем осторожно отделяли мукозу (слизистая и подслизистая оболочки) от серозы (соединительнотканный и мышечный слой). Мукозу тонкой кишки заливали раствором Рингера в отношении 1:9 и далее гомогенизировали тефлоновым пестиком при скорости 300 g в течение минуты. Все операции проводили на холоде.
В супернатанте тонкой кишки при соответствующих разведениях определяли активность щеточнокаёмных мальтазы (КФ 3.2.1.20), сахаразы (КФ.2.4.1.100) и лактазы (КФ 3.2.1.23). Определение активностей кишечных дисахаридаз, уровня глюкозы в сыворотке крови проводили глюкозооксидазным методом с использованием специальных наборов реактивов фирмы Human (Германия).
Полученные результаты были обработаны c определением коэффициента Стъюдента-t и показателя достоверности – Р. В работе данные представлены как средняя ± ошибка средней (M ± m). При Р < 0,05 различия в показателях между опытной и контрольной группами принимались за достоверные.
Результаты исследования и их обсуждение
Оказалось, что у крыс с аллоксан-индуцированным диабетом содержание глюкозы в сыворотке крови, как и ожидалось, увеличивалось. Увеличение концентрации глюкозы у крыс опытной группы в крови было в в 3,3 раза больше на 5-й день и в 3,7 раз больше на 10-й день наблюдения по сравнению с крысами контрольной группы (рис. 1).
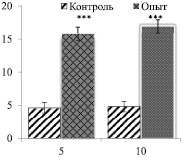
Рис. 1. Уровень глюкозы (Ммоль/л) в крови при аллоксан-индуцированном диабете крыс-самцов (M ± m: при n = 6).
По оси абсцисс – дни опыта; по оси ординат – концентрация глюкозы (Ммоль/л).
*** –<0,001
Аллоксан-индуцированный диабет оказывал заметное влияние и на массу тела, и на массу тонкой кишки крыс-самцов (табл. 1).
Таблица 1
Масса тела (г) и масса тонкой кишки (г) при аллоксан-индуцированном диабете крыс-самцов (M ± m; n = 6)
|
Группы животных |
Дни опыта |
|||||
|
5-й |
10-й |
|||||
|
M ± m |
% |
Р |
M ± m |
% |
Р |
|
|
Контроль Опыт |
Масса тела, г |
|||||
|
215,6 ± 12,0 172,6 ± 8,5 |
100,0 80,0 |
– <0,01 |
218,5 ± 14,5 168,2 ± 12,4 |
100,0 76,9 |
– <0,02 |
|
|
Контроль Опыт |
Масса тонкой кишки, г |
|||||
|
6,4 ± 0,3 5,6 ± 0,1 |
100,0 87,5 |
– <0,02 |
7,2 ± 0,4 5,5 ± 0,1 |
100,0 76,4 |
– <0,001 |
|
Из табл. 1 видно, что масса тела и тонкой кишки у крыс контрольной группы на протяжении опыта регистрировалась на одном уровне. Однако у крыс с аллоксан-индуцированным диабетом масса тела уменьшалась на 20,0 и 23,1 % на 5-й и 10-й дни опыта соответственно по сравнению с контрольными величинами. Уменьшение было отмечено и в массе тонкой кишки. У крыс с аллоксан-индуцированным диабетом масса тонкой кишки на 5-й день наблюдения уменьшалась на 12,5 %, а на 10-й день опытов – на 23,6 % по сравнению с крысами контрольной группы.
Аллоксан-индуцированный диабет оказывал неоднозначное влияние и на уменьшение массы мукозы и серозы тонкой кишки крыс (табл. 2).
Таблица 2
Масса серозы (г) и мукозы тонкой кишки (г) при аллоксан-индуцированном диабете крыс-самцов (M ± m; n = 6)
|
Группы животных |
Дни опыта |
|||||
|
5-й |
10-й |
|||||
|
M ± m |
% |
Р |
M ± m |
% |
Р |
|
|
Масса серозы |
||||||
|
Контроль Опыт |
3,98 ± 0,09 3,05 ± 0,12 |
100,0 76,6 |
– <0,001 |
4,42 ± 0,04 3,27 ± 0,07 |
100,0 73,9 |
– <0,001 |
|
Масса мукозы |
||||||
|
Контроль Опыт |
2,42 ± 0,03 2,35 ± 0,02 |
100,0 97,1 |
– >0,05 |
2,78 ± 0,02 2,43 ± 0,02 |
100,0 80,2 |
– <0,001 |
Так, масса мукозы на 5-й день эксперимента уменьшалась на 23,4 %, а на 10-й день наблюдений на 26,1 %. Масса серозы кишечника также уменьшалась, но это уменьшение было достоверным только на 10-й день наблюдения и составляло 19,8 %. Следовательно, при аллоксан-индуцированном диабете уменьшение массы мукозы более выражено, чем уменьшение массы серозы тонкой кишки.
Изменение массы мукозы сопровождалось и сдвигами в гистоструктуре стенки тонкой кишки у аллоксан-индуцированных диабетических крыс (рис. 2).
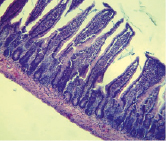
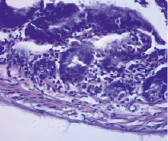
Контроль Опыт
Рис. 2. Гистоструктура тонкой кишки при аллоксан-индуцированном диабете у крыс-самцов (х 200, окраска – гематоксилин-эозин)
Из рис. 2 видно, что в контрольной группе крыс ворсинки расположены паралельно, крипто-ворсиночные структуры четко дифференциируются, мышечные клетки плотно прилегают друг к другу и соединительной ткани. У крыс опытной группы явно проявляется «разрыхленность» мышечного, подслизистого и слизистого слоёв стенки тонкой кишки. Кроме того, у крыс с аллоксан-индуцированным диабетом отмечается значительный отёк слизистой, десквамация кишечного эпителия, полнокровие капилляров собственной пластинки слизистой оболочки и подслизистой основы (рис. 2).
Как видно из табл. 3, на 5-й день опыта у крыс с аллоксан-индуцированным диабетом по сравнению с крысами контрольной группы активность мальтазы увеличивалась на 23,7 %, активность сахаразы – на 37,7 %, а лактазы – на 72,7 %. На 10-й день наблюдений у крыс с аллоксан-индуцированным диабетом активность мальтазы, сахаразы и лактазы возрастала соответственно на 25,6; 47,2 и 84,6 % по сравнению с крысами, получавшими физиологический раствор, т.е. активность всех кишечных мембраносвязанных дисахаридаз при аллоксановом диабете возрастала (табл. 3).
Таблица 3
Специфическая активность энтеральных дисахаридаз (мкмоль/мин/г ткани) при аллоксан-индуцированном диабете у крыс-самцов (M ± m; n = 6)
|
Группы животных |
Дни опыта |
|||||
|
5-й |
10-й |
|||||
|
M ± m |
% |
Р |
M ± m |
% |
Р |
|
|
Мальтаза |
||||||
|
Контроль Опыт |
72,6 + 5,2 89,8 + 6,8 |
100,0 123,7 |
– >0,05 |
75,4 + 6,4 94,7 + 7,3 |
100,0 125,6 |
– >0,1 |
|
Сахараза |
||||||
|
Контроль Опыт |
6,9 + 0,6 9,5 + 0,8 |
100,0 137,7 |
– <0,02 |
7,2 + 0,9 10,6 + 0,7 |
100,0 147,2 |
– <0,01 |
|
Лактаза |
||||||
|
Контроль Опыт |
1,1 + 0,06 1,9 + 0,04 |
100,0 172,7 |
– <0,001 |
1,3 + 0,05 2,4 + 0,09 |
100,0 184,6 |
– <0,001 |
Таким образом, результаты исследований показывают, что аллоксан-индуцированный диабет вызывает серьёзные нарушения как в структуре, так и в функции тонкой кишки. Это проявляется в сдвигах гистоструктуры (отсутствие упорядоченности в расположении ворсинок и миоцитов, эдема слизистой, десквамация эпителия, наполнение капилляров) стенки тонкой кишки и индукции активности мембраносвязанных дисахаридаз.
Считают, что уменьшение массы тела и органов может быть связано с увеличением интенсивности процессов липолиза, протеолиза и гликогенолиза при сахарном диабете [6, 7]. Разрушающее действие аллоксан-индуцированного диабета и гипергликемии на структуры и ткани, в том числе и на гистоструктуру тонкой кишки, возможно, обусловлено усилением перекисного окисления липидов, в связи с увеличением активных форм кислорода при сахарном диабете [8]. Тотальное нарушение упорядоченности гистоструктуры мукозы и серозы кишечника наряду с уменьшением массы кишечника, возможно, также является одной из причин уменьшения массы тела у крыс с аллоксан-индуцированным диабетом, так как структурная целостность слизистой кишечника, участвующей в ассимиляции пластического и энергетического материала нарушается. Уменьшение же массы мукозы тонкой кишки приводит к сокращению общей гидролитической и транспортной поверхности тонкой кишки – основного органа, участвующего в гидролизе и всасывании нутриентов.
Было показано, что морфофенотип эпителиальных клеток ворсинок (объем ядра, количество, площадь и объем клеток) у крыс со стрептозотоцин-индуцированным диабетом мало изменяется [9]. Однако в наших исследованиях влияние экспериментального диабета на гистоструктуру тонкой кишки проявлялось в весьма значимой деструкции мышечной и слизистой оболочки кишечника (рис. 2). Возможно, что это связано с тем, что опытах была использована другая линия крыс и в рассматриваемой работе был вызван не стрептозотоциновый, а аллоксановый диабет, обладающий большей токсичностью и повреждающим действием на другие ткани [10].
Влияние аллоксан-индуцированного диабета кроме нарушения гистологической структуры тонкого кишечника отразилось также в изменении специфической активности пищеварительных дисахаридаз, что проявлялось в заметном увеличении активности мембраносвязанных мальтазы, сахаразы и лактазы тонкой кишки. Увеличение активности энтеральных дисахаридаз было отмечено также И. Мукарами и Т. Икеда при стрептозотоцин-индуцированном диабете и гипергликемии крыс. Однако при этом авторы не описали возможные механизмы индукции активности энтеральных дисахаридаз при сахарном диабете или гипергликемии [11].
Считаем, что, возможно, этот феномен обусловлен дефицитом содержания глюкозы в тканях. Несмотря на увеличенное содержание глюкозы в крови, ее уровень в тканях из-за подавления утилизации глюкозы при диабете понижен [3]. По принципу обратной связи «глюкозный голод» основной массы клеток организма, возможно, и приводит к повышению активностей кишечных дисахаридаз. Однако такое предположение нуждается в дополнительных экспериментальных доказательствах.
Экспериментальный аллоксан-индуцированный диабет, будучи диабетом 1-го типа, известно, вызывает существенные сдвиги в структуре и функции β-клеток поджелудочной железы. Возникшие дефицит инсулина и гипергликемия, в свою очередь, являются причиной и/или поводом для дисфункции органов желудочной-кишечного тракта и других функциональных систем [2, 10]. В данной работе выявлена деструкция гистоструктуры стенки тонкой кишки и индукции гидролитической способности энтероцитов, которая выражена в повышении активности кишечных энтеральных мембраносвязанных олигосахаридаз. Это обстоятельство говорит о том, что при выявлении этногенеза и лечении сахарного диабета 1-го типа, который в экспериментах индуцируется введением аллоксана, следует учитывать сопутствующие морфофункциональные сдвиги в тонкой кишке.
Выводы
1. Аллоксан-индуцированный диабет вызывает уменьшение массы тела и тонкого кишечника крыс, нарушение гистоструктуры стенки тонкой кишки.
2. При аллоксан-индуцированном диабете имеет место увеличение специфической активности кишечных мальтазы, сахаразы и лактазы.


 science-review.ru
science-review.ru