Проблема регенерации длинных трубчатых костей и взаимодействие их с прилежащими мышцами является весьма актуальной в биологии и медицине. Это обусловлено, с одной стороны, частым травматизмом конечностей и необходимостью коррекции врожденных укорочений, с другой, знание морфологических особенностей окружающих кость тканей при различных воздействиях может позволить существенно сократить время лечения больных. Работы, раскрывающие общность биологических процессов при дистракционном остеосинтезе и в постнатальном развитии, посвящены периферическим нервам [1], фасциям скелетных мышц [2]. Выявлены особенности гемодинамики мышц-антагонистов при лечении оскольчатых переломов голени [3]. Определены гистологические параллели процессов естественного роста большеберцовой мышцы в раннем онтогенезе и индуцированных дозированным растяжением процессов при дистракции, показано преимущество высокодробной круглосуточной автодистракции [4]. Морфофункциональные характеристики икроножной мышцы, являющейся синергистом передней большеберцовой и также подвергающейся дистракционной нагрузке, в доступной литературе не обнаружены, что послужило целью данного исследования.
Цель работы – выявить гистологические, стромально-паренхиматозные и стереоультраструктурные особенности икроножной мышцы собак в периоде раннего постнатального онтогенеза.
Материалы и методы исследования
Исследована икроножная мышца 10 щенков в периоде постнатального развития: новорожденные, 7-, 14-, 21-, 28-суточные, n = 2 для каждого возрастного периода. Фрагменты икроножной мышцы погружали в жидкий азот, изготавливали поперечные криостатные срезы (микротом-криостат МК-25ТУ64-1-856-78, Россия), проводили гистохимическую реакцию по выявлению активности миозиновой АТФ-азы (рН 9,0) по Padycula, Herman в модификации З. Лойда. Часть мышц фиксировали в смеси равных объёмов 2 % глутарового и параформальдегида, полимеризовали в эпоксидных смолах, изготавливали полутонкие срезы (ультратом «Nova», Швеция), окрашивали по M. Ontell. Изучали с помощью стереомикроскопа «AxioScope.A1» и встроенной цифровой фотокамеры «AxioCam» (Carl Zeiss MicroImaging GmbH, Германия). Морфологические особенности стереоультраструктурной организации мышцы щенков исследовали посредством сканирующего электронного микроскопа «JSM-840» (JEOL, Япония). Криостатные срезы использовались для стереометрии [5], изображения получали посредством проекционного микроскопа «Visopan» (Reichert-Jung, Австрия). Определяли: объемную плотность (мм3/мм3) мышечных волокон (VVmf), микрососудов (VVmv), эндомизия (VVend); численную плотность (мм-2) миосимпластов и микрососудов (NAmf; NAmv). Рассчитывали параметр, оценивающий васкуляризацию мышцы и, косвенно, ее оксигенацию, NAmv/NAmf – индекс васкуляризации и видовая константа. Достоверность различий оценивали на основании непараметрического критерия Вилкоксона для независимых выборок, различия считали значимыми при Р < 0,05, обработку цифрового материала осуществляли в программе AtteStat версия 10.8.8, встроенной в Microsoft Excel [6].
Результаты исследования и их обсуждение
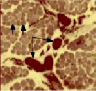
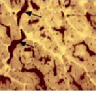
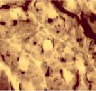
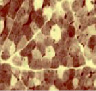
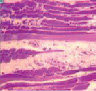
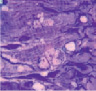
Для новорожденных щенков характерен несовершенный миофибриллярный аппарат, наблюдались очень мелкие мышечные волокна и огромное количество соединительнотканных прослоек с немногочисленными микрососудами (рис. 1 а), большое число мышечных волокон гофрированной, спиральной формы, волокна в состоянии контрактур различной степени, минимальное число микрососудов, крупные артерии и вены в широких прослойках перимизия (рис. 2, а). На 7 сутки роста наблюдались микрососуды в эндомизии, которые зачастую ориентировались продольно на поперечных срезах (рис. 1, б), были характерны парные миобласты и группы ядер (миотубы), примыкающие к предсуществующим волокнам либо формирующим самостоятельно новые миоциты (рис. 2, б). В последующие сроки онтогенеза отмечалось постепенное увеличение диаметров мышечных волокон и уменьшение прослоек эндо- и перимизия (рис. 1, в). К 14 суткам роста характерны волокна нормального строения, с поперечной исчерченностью, встречались контрактурно измененные волокна, доля соединительнотканных прослоек существенно уменьшалась по сравнению с новорожденными (рис. 2, в). К 28 суткам идентифицировались 3 метаболических типа мышечных волокон (рис. 1, г), визуализировались картины, описанные выше в различных сочетаниях, в частности пары миобластов вблизи мышечных волокон (рис. 2, г).
а) б) в) г)
Рис. 1. Икроножная мышца щенков в различные периоды роста: а) новорожденного: крупные сосуды в широких прослойках перимизия (длинные стрелки), мелкие мышечные волокна двух типов (короткие стрелки), микрососуды не идентифицируются; б) 7-суточного: в перимизии сосуды ориентированы продольно, в эндомизии визуализированы микрососуды; в) 14-суточного; г) 21–28-суточных: идентифицируются 3 типа мышечных волокон. Поперечные криостатные срезы с выявленной активностью АТФ-азы, ув. x200


а) б) в) г)
Рис. 2. Фрагменты икроножной мышцы щенков: a) новорожденного: узкие мышечные волокна, значительные прослойки эндомизия, спиральные волокна; б) 7-суточного: пары миобластов; в) 14-суточного: прослойки эндомизия уменьшены, контрактурно измененное волокно (в центре), г) 21–28-суточных: парные миобласты, примыкающие к мышечному волокну (стрелки). Полутонкие срезы, окраска по M. Ontell, ув.: a) x200; б), г) x1250; в) x500
Данные стереометрии икроножной мышцы щенков в периоде постнатального онтогенеза
|
Параметры Возраст щенков |
VVmf (мм3/мм3) |
NAmf (мм-2) |
VVmv (мм3/мм3) |
NAmv (мм-2) |
VVend (мм3/мм3) |
Ivasc |
|
Новорожденные |
0,7098 ± 0,0124 |
6755,3 ± 197 |
0,0594 ± 0,0069 |
1209,0 ± 45,7 |
0,2308 ± 0,0118 |
0,1790 |
|
7 суточные |
0,7333 ± 0,0119 |
5627,4 ± 88,9 |
0,1015 ± 0,0038 |
1758,7 ± 66,7 |
0,1682 ± 0,0071 |
0,3125 |
|
14 суточные |
0,7566 ± 0,0048 |
3581,4 ± 125,2 |
0,0559 ± 0,0042 |
910,0 ± 56,6 |
0,1868 ± 0,0058 |
0,2541 |
|
21-суточные |
0,8328 ± 0,0086 |
5907,6 ± 321,7 |
0,0263 ± 0,0034 |
769,1 ± 24,2 |
0,1429 ± 0,0076 |
0,1300 |
|
28-суточные |
0,8095 ± 0,0175 |
3873,2 ± 144,2 |
0,0332 ± 0,0042 |
1123,5 ± 35,8 |
0,1568 ± 0,01534 |
0,2901 |
Примечание. Жирным шрифтом выделены значения параметров, отличающиеся достоверно от соответствующих параметров на предыдущий срок исследования. Достоверность различий значима для уровня Р < 0,05.
По данным стереометрии объемная плотность мышечных волокон была минимальна у новорожденных животных, через 7, 14 и 21 сутки постнатального развития параметр плавно увеличивался, к 28 суткам несущественно снижался (таблица). Численная плотность миоцитов была максимальна у новорожденных щенков, к 7 суткам параметр снижался, составив 85 % от значения на предыдущий срок, к 14 суткам еще более уменьшался, но к 21 суткам развития вновь возрастал, составив 165 % (Р < 0,05) от значения на предыдущий срок и к 28 суткам вновь снижался, составив 66 % от значения параметра в предыдущий срок (Р < 0,05). Подобная ступенчатая динамика параметра была отмечена и для передней большеберцовой мышцы щенков [4].
Объемная и численная плотности микрососудов в раннем постнатальном периоде носили волнообразный характер: к 7 суткам роста значения данных параметров составили 171 и 146 % от значений новорожденных животных соответственно; к 14 суткам параметры снижались, составив 55 и 52 % от значений на предыдущий срок исследования (Р < 0,05); к 21 суткам также снижались значения параметров, составив 47 и 85 % соответственно от значений на 14 сутки (Р < 0,05), и на 28 сутки вновь возрастали, составив 126 и 146 % (Р < 0,05) соответственно от значений на 21 сутки роста. Индекс васкуляризации изменялся подобно численной плотности микрососудов.
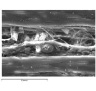
Методом сканирующей электронной микроскопии были выявлены особенности цитоархитектоники мышечных волокон и окружающей рыхлой волокнистой соединительной ткани икроножной мышцы. У новорожденных щенков наблюдались узкие мышечные волокна без видимой поперечной исчерченности (рис. 3, а), соединительнотканный компонент во всех сроках наблюдения был представлен тонкими эластическими волоконцами, образующими сети; неветвящимися тяжами коллагеновых волокон, фибробластами, фиброцитами, макрофагамии (рис. 3, б). К 7-м суткам мышечные волокна становились заметно шире, идентифицировалась поперечная исчерченность (рис. 3, в), отмечены веретеновидные фибробласты, различные соединительнотканные волокна (рис. 3, г). К 14-м суткам миоциты характеризовались четкой поперечной исчерченностью (рис. 3, д, е), на 21–28 сутки миоциты были оплетены микрососудами, в том числе в направлении, перпендикулярном ходу мышечных волокон, соединительнотканные прослойки были минимальны (рис. 3, ж, з).



а) б) в) г)




д) е) ж) з)
Рис. 3. Цитоархитектоника икроножной мышцы собак в постнатальном периоде. Сканограммы щенков: а, б – новорожденных, а) узкие мышечные волокна без поперечной исчерченности, ув. x850, б) сеть тонких эластических волоконец, более широкое коллагеновое волокно, макрофаг (справа), ув. x3700; в, г – 7-суточных, в) мышечные волокна, в центре – микрососуд, идущий параллельно волокнам, ув. x850; г) веретеновидный фибробласт (внизу), различные волокна, ув. x2500; д, е – 14-суточных, мышечные волокна с четкой поперечной исчерченностью, ув. x1900; ж – 21-суточного, ув. x1500; з – 28-суточного, ув. x300, мышечные волокна и сеть оплетающих их микрососудов, минимум эндомизия
В результате проведенного морфологического исследования выявлены особенности цитоархитектоники, микроциркуляторного русла и стромально-паренхиматозных отношений икроножной мышцы в периоде раннего постнатального развития. Установлено, что динамика большинства стереометрических параметров икроножной мышцы аналогична таковой для передней большеберцовой мышцы щенков [4]. В частности, имеет место волнообразный характер динамики показателей микрососудистого русла: максимальные цифры объемной и численной плотности микрососудов отмечены на 7 сутки постнатального развития, к 21 суткам показатели снижаются и вновь возрастают к 28 суткам. Для числа мышечных волокон выявлена также волнообразная динамика с максимальным увеличением параметра к третьей неделе роста.
Известно, что число мышечных волокон не фиксируется при рождении, а увеличивается в постнатальном периоде, как путем саркомерогенеза предсуществующих волокон, так и путем генеза новых миофибрилл, в основном между рождением и 3-недельным возрастом [7]. Показано, что в возрасте 21 суток очень мелкие волокна, экспрессирующие изоформу тяжелой цепи миозина (MyHC) эмбриона, были заметны по всей мышце. Это не противоречит данным, полученным в настоящем исследовании, где на 21 сутки онтогенеза численность мышечных волокон достоверно возрастает, приближаясь к значению параметра при рождении, при этом у новорожденных параметр обусловлен очень мелкими диаметрами волокон на фоне большого количества соединительнотканного компонента. К 3-недельному возрасту возрастает число волокон при существенном уменьшении доли соединительной ткани. К 28-м суткам роста имеет место увеличение диаметров миоцитов и, соответственно, уменьшение их числа в поле зрения. Известно о функции циклазо-ассоциированных белков (CAP) в регуляции обмена α-актина во время дифференцировки миофибрилл [8]. Переключение α-актина задерживалось у мышей с системной мутацией в CAP2, и миофибриллы оставались недифференцированными у постнатальных мышей. Задержка переключения α-актина совпадает с началом дефицита двигательной функции и гистопатологических изменений, включая высокую частоту встречаемости спиральных волокон типа IIB. То есть тонких нарушений постнатального ремоделирования F-актина достаточно для предрасположенности мышечных волокон к образованию спиральных волокон, которые также имеют место в представленной работе.
В процессе формирования структурно-функциональных единиц микрососудистого русла меняется количество, плотность расположения сосудов, их диаметр, ориентация в пространстве. Наиболее интенсивный рост у белой крысы наблюдался через 7 дней, число капилляров 1302 мм-2, у взрослых животных – 478 мм-2 [9]. В данном исследовании микрососудистое русло в мышце щенков максимально развивается также к 7 суткам, что подтверждено объемной и численной плотностью микрососудов.
В развитии скелетных мышц важную роль играют гормоны щитовидной железы, в частности трийодтиронин, который усиливается дейодиназой 2 типа (Dio2), глобальная инактивация гена Dio2 на ранних этапах онтогенеза нарушает дифференцировку и регенерацию скелетных мышц в ответ на мышечное повреждение [10]. Исследовали рост мышц и типы волокон в мышцах задних конечностей в постнатальном развитии у свиней: быстросокращающиеся волокна с низким окислительным метаболизмом (IIB) имели наибольшую площадь поперечного сечения [11]. В исследованиях митохондрий мышц выявлено, что их сеть изменяется с продольной ориентации на перпендикулярную по отношению к миосимпластам в течение 2–3 недель после рождения в гликолитических скелетных мышцах [12]. Эти структурные изменения сопровождаются изменением профиля экспрессии белков от митохондрий, предназначенных для сборки миосимпластов, в митохондрии, узкоспециализированные для клеточного энергетического метаболизма, определяя типы мышечных волокон. Выявлен микропептид, локализующийся в митохондриях, который усиливает их дыхательную активность и активизируется во время дифференцировки миобластов C2C12 in vitro и в мышцах раннего постнатального развития [13]. Сохранность митохондрий имеет решающее значение для поддержания функции скелетных мышц [14].
Заключение
Таким образом, в результате исследования икроножной мышцы щенков получены новые данные по морфогенезу мышечной ткани растущих животных. Выявлены особенности цитоархитектоники икроножной мышцы и её стромально-паренхиматозных отношений. Определены параллели по основным стереометрическим параметрам для передней большеберцовой и икроножной мышц. Результаты могут представлять интерес при сравнительном морфологическом анализе в различных экспериментальных моделях.


 science-review.ru
science-review.ru