Огромные количества осадков сточных вод, накапливающиеся в городах и промышленных центрах, представляют серьезную экологическую проблему [1]. Чтобы справиться со всем объемом образующихся отходов, нужна промышленная безотходная, экологически чистая технология. Анализ современного состояния почвенного покрова Республики Казахстан, в том числе его плодородия, показал, что в результате экстенсивного использования земельных ресурсов произошли существенные изменения в сторону снижения содержания гумуса в почве и интенсивной деградации и опустынивания земель [2].
Однако несомненным достоинством осадков сточных вод является высокое содержание в них органического вещества, которое может варьировать в пределах 40–75 %, и широкий набор микроэлементов [3]. В связи с чем использование осадков сточных вод в земледелии рассматривается как одно из перспективных направлений их утилизации [1].
С использованием технологии биологического компостирования возможна безопасная и экологически чистая переработка осадка сточных вод в органическое удобрение. Ключевым фактором успешного компостирования является выбор штамма при приготовлении эффективных комплексных микробных препаратов [4]. Широкий спектр микроорганизмов способен расщеплять и окислять макромолекулы. Ведущую роль в превращении органических веществ играют гидролитические ферменты [5]. При компостировании микроорганизмы используют как внеклеточные, так и внутриклеточные ферменты для гидролиза органических веществ и превращения сложных соединений в простые молекулы которые могут быть ассимилированы и, наконец, минерализованы [6]. Поиск новых штаммов, которые позволили бы сократить продолжительность биологической переработки отходов и в то же время обеспечить получение полноценного конечного продукта (например, компоста) или отходов, отвечающих требованиям законодательства (например, стабилизированных отходов), в настоящее время является одной из актуальных задач.
Целью данной работы является изучение, выделение и отбор штаммов, перспективных для переработки осадков сточных вод.
Материалы и методы исследования
Выделение чистых культур микроорганизмов проводили поэтапно: получение накопительной культуры; выделение чистой культуры; определение чистоты и определение ферментативной (протеолитической, липолитической, амилолитической и уреазной, целлюлолитической) активности [7].
Штаммы бактерий идентифицировали методом MALDI-TOF масс-спектрометрией при идентификации микроорганизмов на масс-спектрометре Microflex LT («Bruker Daltonics», Германия). Использовалась коммерческая база данных (MALDI Biotyper 4.0, Bruker Daltonics) согласно инструкции производителя.
Результаты исследования и их обсуждение
Производство осадка сточных вод в Казахстане составляет около 5 млн т в год, и этот объем постоянно увеличивается с увеличением населения страны. Поскольку осадок сточных вод может содержать вредные компоненты, такие как патогенные организмы, органические соединения, избыток фосфора и азота, неправильное обращение с ним может иметь много неблагоприятных последствий для окружающей среды. Одним из методов биоконверсии органических отходов в экологически чистое удобрение является компостирование. В ускорении процесса компостирования органических отходов существенную роль играют микроорганизмы, продуцирующие гидролитические ферменты (амилаза, протеаза, целлюлаза, липаза, уреаза), ответственные за разложение органических соединений [8]. В статье представлены данные по характеристике ферментативного потенциала бактерий, выделенных из осадка сточных вод канализационно-очистных сооружений г. Нур-Султан, Рудный, Форт-Шевченко, дачной почвы и свежескошенной травы с дачного участка (г. Нур-Султан), для переработки органических отходов и выявления активных штаммов.
Выделение микроорганизмов проводили методом накопительных культур на жидких питательных средах с последующим высевом на плотные среды для изолирования отдельных колоний (рис. 1).
Чистые культуры аэробных микроорганизмов пересевали на плотные питательные среды: СПА, МРС-4, трехсахарный агар, Гетчинсона, Macconkey, Hottinger, Pseudomonas методом истощающего штриха по Гоулду. Чистоту выделенных культур микроорганизмов оценивали микроскопическим контролем по Граму. В результате проведенных экспериментов выделено 60 микроорганизмов (рис. 2), из которых 3 были термофильными (DS1, DS2 и DS3).
Рис. 1. Накопительная культура
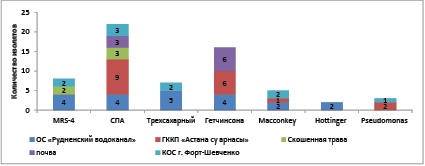
Рис. 2. Количество изолятов, выделенных из разных источников
Наибольшее количество изолятов выделено из иловых осадков и сточных вод г. Рудный ОС «Рудненский водоканал» и г. Нур-Султана ГККП «Астана су арнасы», 21 и 18 культур соответственно. Из сточных вод КОС г. Форт-Шевченко выделено 7 изолятов. Наименьшее количество изолятов отобрано из дачной почвы г. Нур-Султана и свежескошенной травы – 9 и 5 соответственно.
Для выбора перспективных микроорганизмов для переработки ОСВ выделенные штаммы бактерий были протестированы на ферментативные свойства (табл. 1) – липолитическую, протеолитическую, амилолитическую, целлюлолитическую, уреолитическую и нефтеокисляющую активность.
По результатам экспериментов гидролиз крахмала (амилолитическая активность) обнаружен у 2 изолятов – СВ2/2, СВ2/1, по наибольшей способности расщеплять казеин отобраны 3 культуры – СВ2, СВ2/1, СВ1/1. Из 60 культур максимальной способностью расщеплять жиры обладали 3 культуры – СВ3, СВГ1/1, ИЛ3. Данные изоляты были отобраны для дальнейшей работы.
Таблица 1
Ферментативная активность изолятов
|
Изолят |
Ферментативная активность (d, mm) |
|||||
|
Амилаза |
Протеаза |
Липаза |
Целлюлаза |
Уреаза |
Углеводород окисляющая |
|
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
СВ2 |
0 |
11,9±0,17 |
0 |
0 |
+ |
– |
|
СВ3 |
0 |
0 |
14,23±0,25 |
0 |
– |
+ |
|
СВ1/1 |
5,93±0,12 |
12,03±0,45 |
0 |
0 |
– |
– |
|
СВ2/2 |
11,93±0,12 |
7,00±0,20 |
0 |
5,73±0,25 |
+ |
– |
|
СВГ1/1 |
0 |
0 |
12,97±0,25 |
0 |
– |
– |
|
СВ2/1 |
8,03±0,25 |
10,03±0,25 |
0 |
0 |
+ |
– |
|
DS1 |
0 |
0 |
0 |
16,10±0,17 |
– |
– |
|
DS2 |
0 |
0 |
0 |
17,97±0,06 |
– |
– |
|
DS3 |
0 |
0 |
0 |
5,93±0,12 |
– |
– |
|
ИЛ3 |
0 |
0 |
12,27±0,25 |
20,60±0,53 |
+ |
– |
|
ИЛ5 |
0 |
4,07±0,31 |
0 |
18,07±0,12 |
– |
– |
|
П1 |
0 |
8,13±0,15 |
0 |
7,93±0,21 |
– |
– |
|
П2 |
0 |
0 |
0 |
16,03±0,06 |
– |
– |
|
П5 |
0 |
0 |
0 |
20,33±0,58 |
+ |
– |
|
П3 |
0 |
0 |
0 |
19,93±0,40 |
+ |
– |
В результате скрининга отобраны 7 штаммов активных, обладающих целлюлозолитической активностью (DS1, DS2, ИЛ3, ИЛ5, П2, П5, П3).
Способностью к быстрому разложению мочевины обладали 6 культур. Изолят П1 отобран по средней способности расщеплять казеин и целлюлозу. Изолят DS3 является термофильным и обладает целлюлозолитической активностью, поэтому также отобран для дальнейших исследований.
Таким образом, на основе проведенных исследований было отобрано 15 изолятов – СВ2, СВ3, СВ1/1, СВ2/2, СВГ1/1, СВ2/1, DS1, DS2, DS3, ИЛ3, ИЛ5, П1, П2, П5, П3.
В табл. 2 и 3 представлены культуральные свойства отобранных микроорганизмов.
Таблица 2
Макро- и микроскопия отобранных изолятов
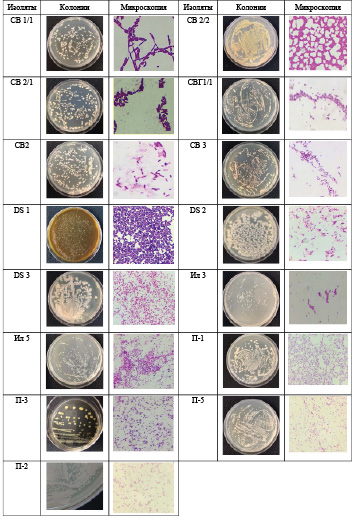
Таблица 3
Культуральные свойства изолятов
|
№ |
Изолят |
Размер, мм |
Форма |
Поверхн. |
Профиль |
Край |
Цвет |
Текстура (консистенция) |
|
1 |
СВ 2 |
2,5–3 |
круглая |
гладкая |
плоский |
неровный |
серо-бежевый |
мягкая |
|
2 |
СВ 3 |
1,5–2 |
круглая |
гладкая |
выпуклый |
ровный |
оранжевый |
мягкая |
|
3 |
СВ 1/1 |
3–5 |
круглая |
матовая |
плоский |
неровный |
светло-бежевый |
однородная |
|
4 |
СВ 2/2 |
1–3 |
неправильная |
глянцевая |
выпуклый |
неровный |
желтый |
однородная |
|
5 |
СВГ 1/1 |
1–1,5 |
круглая |
гладкая |
плоский |
ровный |
светло-оранжевый |
мягкая |
|
6 |
СВ 2/1 |
3–5 |
круглая |
глянцевая |
выпуклый |
неровный |
молочный |
однородная |
|
7 |
DS1 |
0,2 |
круглая |
глянцевая |
выпуклый |
ровный |
белые |
однородная, мягкая |
|
8 |
DS2 |
3–4 |
неправильная |
блестящая |
выпуклый |
неровные |
бежевые |
слизистая |
|
9 |
DS3 |
3-5 |
неправильная |
глянцевая |
выпуклый |
неровный |
белые |
неоднородная, слизистая |
|
10 |
ИЛ3 |
0,5-1 |
круглая |
глянцевая |
выпуклый |
ровный |
белые |
однородная, мягкая |
|
11 |
ИЛ5 |
0,5-1 |
круглая |
глянцевая |
выпуклый |
ровный |
бежевый |
однородная |
|
12 |
П1 |
3- 5 |
круглая |
матовая |
выпуклый |
неровный |
бежевый |
прозрачная, мягкая |
|
13 |
П2 |
0,5-1 |
круглая |
глянцевая |
плоский |
ровные |
бежевые |
однородная, мягкая |
|
14 |
П5 |
0,5-1 |
круглая |
глянцевая |
плоский |
ровные |
бежеый |
однородная, мягкая |
|
15 |
П3 |
0,5-3 |
круглая |
глянцевая |
плоский |
ровные |
белые |
однородная, мягкая |
Таблица 4
Идентификация штаммов по Мaldi-TOF
|
Штамм |
Мaldi-TOF |
|
|
Микроорганизм (наибольшее соответствие) |
Диапазон идентификации |
|
|
СВ 2 |
Bacillus cereus |
1,732 |
|
СВ 3 |
Rhodococcus rhodochrous |
2,072 |
|
СВ 1/1 |
Bacillus cereus |
2,3 |
|
СВ 2/2 |
Cryseobacterium arachidis |
1,849 |
|
СВГ 1/1 |
Pseudoxanthomonas sp. |
2,14 |
|
СВ 2/1 |
Bacillus megaterium |
2,108 |
|
DS1 |
Pediococcus acidilactici |
2,181 |
|
DS2 |
Paenibacillus residui |
2,238 |
|
DS3 |
Brevibacillus invocatus |
1,838 |
|
ИЛ3 |
Enterobacter cloacae |
2,126 |
|
ИЛ5 |
Ochrobactrum intermedium |
2,101 |
|
П1 |
Bacillus lichenoformis |
1,932 |
|
П2 |
Ochrobactrum intermedium |
1,852 |
|
П5 |
Enterobacter cloacae |
2,007 |
|
П3 |
Enterobacter cloacae |
2,048 |
Примечание: диапазон идентификации: 2,300–3,000 и более – высокая степень идентификации, 2,000–2,299 – вероятная идентификация вида, 1,700–1,999 – вероятная идентификация рода, 0,000–1,699 – идентификация невозможна
Большая часть отобранных изолятов грамположительные, 4 изолята – грамотрицательные. СВГ1/1 и DS1 имели кокообразную форму клеток, все остальные изоляты имели палочковидную форму клеток. Рост всех изолятов на плотных питательных средах отличается по размеру, форме колоний, цвету, текстуре, профилю, поверхности и краю колоний.
Спорообразование наблюдалось у 6 изолятов: СВ1/1, СВ2, СВ2/1, DS2, DS3, П1. Из отобранных культур 3 изолята способны к росту при температуре выше 45 °С, при 28 °С рост клеток останавливался. Для остальных культур оптимальным для роста является диапазон температур 28–37 °С.
Идентификация (табл. 4) отобранных микроорганизмов на масс-спектрометре (Maldi-TOF) выявила принадлежность выбранных штаммов к роду Rhodococcus rhodochrous – СВ 3, 2 штамма – СВ2, СB1/1 – Bacillus cereus, СВ 2/2 – Cryseobacterium arachidis, СВГ 1/1 – Pseudoxanthomonas sp., СВ2/1 – Bacillus megaterium, DS1 – Pediococcus acidilactici, DS2 – Paenibacillus residui, DS3 – Brevibacillus invocatus, 3 штамма ИЛ3, П5, П3 – Enterobacter cloacae, 2 штамма ИЛ5, П2 – Ochrobactrum intermedium, П1 – Bacillus lichenoformis.
Среди отобранных бактерий рода Bacillus представлен видами Bacillus cereus, B. megaterium, B. lichenoformis. Члены этого рода образуют эндоспоры, устойчивые к высоким температурам, коррозии и пагубным параметрам окружающей среды, они могут расти и размножаться даже при 80 °C и являются важными микроорганизмами в процессе компостирования [9].
Практически все представители отобранных видов микроорганизмов известны как активные разрушители органических веществ. Данные бактерии являются перспективными для дальнейшей переработки осадков сточных вод в органическое удобрение.
Заключение
Таким образом, из сточных вод КОС г. Нур-Султан, Рудный, Форт-Шевченко, дачной почвы и свежескошенной травы с дачного участка (г. Нур-Султан) выделено 60 изолятов. В процессе скрининга было отобрано 15 активных изолятов, установлена их видовая принадлежность. Отобранные штаммы будут использованы при создании эффективного биопрепарата для компостирования иловых осадков сточных вод.


 science-review.ru
science-review.ru