Животноводческие отходы являются источником загрязнения воздуха и водных ресурсов. Однако при правильном управлении данным видом отходов они могут служить энергетическим ресурсом [1].
Путем анаэробного сбраживания из животноводческих отходов получают биогаз. Использование навоза для получения биогаза имеет ряд достоинств, например производство энергии без ископаемого топлива, повторное использование питательных веществ и сокращение выбросов парниковых газов в сельском хозяйстве [2]. Потенциал производства биогаза из животноводческих отходов в Казахстане в целом высок, поэтому существует необходимость развития данной отрасли.
Животноводческие отходы имеют высокое содержание воды и клетчатки, что приводит к малым выработкам биогаза и эффективности разложения, что в свою очередь препятствует более широкому использованию биогазовой технологии в сельском хозяйстве [3]. Более того, патогенные микроорганизмы, которые могут встречаться в составе навоза, являются барьером для использования переработанного навоза в качестве удобрения [4]. Добавление специально подобранных микроорганизмов в животноводческие отходы позволит увеличить выход биогаза и снизить количество патогенных микроорганизмов.
В первой фазе анаэробного брожения активизируются гидролизные микроорганизмы. В этой фазе сложные органические вещества распадаются на простые водорастворимые соединения, которые могут поглощаться микробными клетками. Сложные макромолекулы, такие как углеводы, белки и жиры соответственно, превращаются в моносахариды, аминокислоты и жирные кислоты. Это происходит за счет ферментативного гидролиза, в котором различные факультативные и/или облигатные анаэробные гидролитические бактерии выделяют экзоферменты, которые способствуют расщеплению ковалентных связей в субстрате в результате химической реакции с водой. Ферменты, участвующие в процессе гидролиза, называют гидролазами. Разные гидролазы синтезируются специфичными видами гидролитических бактерий для деградации различных макромолекул. Например, целлюлозолитические бактерии синтезируют целлюлазу для гидролиза целлюлозы, в то время как липолитические бактерии синтезируют липазы для гидролиза жировых молекул. Гидролиз неструктурных углеводов происходит быстро, порядка нескольких часов, в то время как гидролиз белков и жиров может продолжаться до нескольких дней [5].
Гидролизные микроорганизмы играют очень важную роль в процессе получения биометана. Целью нашей работы явилось выделение и изучение гидролизных бактерий из субстрата биогазовой установки (БУ), работающей на навозе крупного рогатого скота (КРС), и навоза КРС.
Материалы и методы исследования
Изоляты микроорганизмов выделяли из субстрата БУ (навоза) с использованием общепринятого в бактериологической практике метода, который проходит в три этапа: получение накопительной культуры; выделение чистой культуры; определение чистоты выделенной культуры [6].
Для выделения мезофильных бактерий инкубацию субстрата БУ производили при 37 °С в течение 24 ч. Для выделения термофильных бактерий инкубацию субстрата производили при 45 °С – 24 ч. Для получения изолятов микроорганизмов выросшие колонии пересевали методом истощающего штриха по Голду.
Чистота выделенной культуры микроорганизмов тщательно проверялась. При визуальном контроле просматривался рост микроорганизмов по штриху на поверхности скошенной среды.
Оценку максимального показателя жизнеспособности (ЖСП) проводили методом Miles&Misra [7] с целью получения жизнеспособных культур с показателем 106–107 КОЕ/мл и более.
Скрининг выделенных изолятов проводили на основе изучения ферментативной активности путем определения амилолитической, протеолитической, целлюлолитической, липазной и уреазной активностей.
Проведена идентификация микроорганизмов c использованием MALDI-TOF масс-спектрометра Microflex («BrukerDaltonics», Германия). Полученные белковые спектры сравнивали с эталонными спектрами, имеющимися в базе данных BrukerDatabaseVersion 3.3.1.0, используя программное обеспечение Biotyper [8].
Результаты исследования и их обсуждение
Из лабораторной однокамерной БУ с рабочим объемом 10 л, в качестве субстрата использующей навоз КРС, и коровьего навоза путем посева на различные элективные питательные среды (СПА, МПА, Сабуро, МРС) было выделено 18 чистых изолятов. Из них один изолят был способен расти при температуре 45 °С, а остальные при 37 °С. Все выделенные объекты, по культурально-морфологическим признакам отнесены к бактериальным культурам.
Рост всех изолятов на плотных питательных средах отличался по форме колоний, цвету, текстуре, профилю, поверхности и краям колонии (табл. 1).
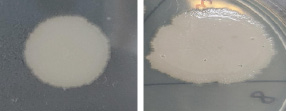
На рис. 1, а, представлена колония изолята В3: колония кремового цвета, поверхность матовая, края неровные; на рис. 1, б – изолят В6: колония бежевого цвета, поверхность гладкая, блестящая с неровными краями.
С помощью микроскопии окрашенных по Граму мазков было определено, что в исследуемых образцах присутствуют грамположительные микроорганизмы в форме палочек с закругленными концами, разных размеров, образующих или не образующих спор, расположенные одиночно, попарно, в цепочку или скоплениями. На рис. 2 представлена микроскопия некоторых выделенных чистых изолятов. Изоляты чистые, однородные.
Таблица 1
Культурально-морфологические свойства изолятов
|
№ |
Изолят |
Размер, мм |
Форма |
Поверхность |
Край |
Цвет |
Рост в жидкой среде |
ЖСП |
|
1 |
№ 846 |
2–3 |
НП |
М |
Р |
Б |
МНБО |
107 |
|
2 |
№ 847 |
3–5 |
К |
Г |
Р |
Б |
МНБО |
108 |
|
3 |
№ 848 |
1–3 |
НП |
Г |
Н |
Б |
МНПП |
108 |
|
4 |
№ 849 |
1–3 |
К |
Г |
Н |
Б |
МНБО |
108 |
|
5 |
№ 850 |
1–3 |
НП |
Г |
Н |
С |
МНПП |
108 |
|
6 |
№ 851 |
2–5 |
К |
М |
Р |
С |
МО |
107 |
|
7 |
№ 852 |
2–4 |
К |
Г |
Р |
Б |
МНПП |
108 |
|
8 |
№ 853 |
2–5 |
К |
Г |
Р |
Б |
МНПП |
108 |
|
9 |
№ 854 |
1–3 |
К |
М |
Н |
Б |
МО |
108 |
|
10 |
№ 855 |
1–3 |
К |
Г |
Н |
С |
МО |
108 |
|
11 |
№ 856 |
2–4 |
К |
Г |
Р |
Б |
МО |
107 |
|
12 |
№ 857 |
2–5 |
К |
Г |
Р |
Б |
МО |
107 |
|
13 |
№ 858 |
2–3 |
К |
Г |
Н |
Б |
МО |
108 |
|
14 |
В3 |
2–4 |
К |
М |
Н |
Б |
МО |
106 |
|
15 |
В4 |
2–3 |
К |
Г |
Н |
К |
МО |
106 |
|
16 |
В5 |
2,5–3 |
К |
Г |
Н |
К |
МО |
106 |
|
17 |
В6 |
2–3 |
НП |
М |
Н |
Б |
МНПП |
106 |
|
18 |
В7 |
2–5 |
НП |
М |
Н |
Б |
МНПП |
106 |
Примечание. К – круглая, НП – неправильная, Г – глянцевая, М – матовая, Р – ровная, Н – неровная, Б –беловатая, С – серая, МО – мутность, осадок, МНБО – мутность, небольшой осадок, МНПП – мутность, на поверхности пленка
а б
Рис. 1. Рост колоний изолятов В3 (а) и В6 (б) на питательной среде СПА
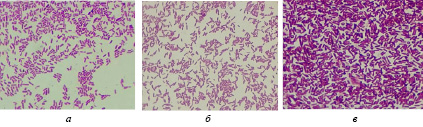
Рис. 2. Микроскопическая картина изолятов (по Граму), ×100: а) 855, б) 858, в) В4
Одной из характеристик скрининга является отбор микроорганизмов для дальнейшей работы по максимальному показателю ЖСП, чтобы иметь клетки с хорошей выживаемостью в различных условиях.
Всего из БУ и навоза КРС было получено 18 чистых культур. Из них 13 культур выделены из БУ (№ 846, № 847, № 848, № 849, № 850, № 851, № 852, № 853, № 854, № 855, № 856, № 857, № 858) и 5 чистых культур из навоза КРС: В3, В4, В5, В6, В7. Максимальный показатель ЖСП варьирует в пределах 106–108 КОЕ/мл.
Изучение ферментативной активности полученных изолятов, а именно активности гидролаз, показало, что 12 выделенных культур обладают протеолитической активностью: 846, 848, 850, 852, 853, 854, 856, 857, В3, В5, В6, В7. Наиболее активными были изоляты № 854, В6. Протеолитические ферменты (протеазы) катализируют расщепление белков на поли- и олигопептиды. Протеазы выделяются различными видами бацилл, актиномицетов, мицелиальных грибов и другими микроорганизмами. Активность внеклеточных протеаз определяли, используя в качестве субстрата желатин и казеин [9].
Амилолитической активностью обладали только два изолята – В5 и В6. Целлюлозу разлагали 11 культур: 846, 848, 852, 853, 854, 855, 856, 858, В3, В5, В6.
Способность разложения мочевины до аммиака отмечена у следующих изолятов: 846, 847, 849, В6. Уреаза – фермент, участвующий в регуляции азотного обмена в почве. Этот фермент катализирует гидролиз мочевины до аммиака и углекислого газа, вызывая гидролитическое расщепление связи между азотом и углеродом в молекулах органических веществ [10].
Липолитическую активность проявляли изоляты 846, 851 и 857. Липиды подвергаются гидролитическому разложению под действием липаз. Для выявления липолитической активности использовали твины [11].
Результаты представлены в табл. 2.
На рис. 3 представлены фотографии изолятов с протеолитической, амилолитической, целлюлозолитической, уреолитической и липолитической активностями.
Таблица 2
Ферментативная активность изолятов
|
Изоляты |
Амилазная активность |
Протеализ казеин |
Целлюлаза |
Уреазная активность |
Липаза |
|
№ 846 |
- |
+ |
+++ |
+++ |
+++ |
|
№ 847 |
- |
- |
- |
+++ |
- |
|
№ 848 |
- |
+ |
+++ |
- |
- |
|
№ 849 |
- |
- |
- |
+++ |
- |
|
№ 850 |
- |
+ |
- |
- |
- |
|
№ 851 |
- |
- |
- |
- |
+ |
|
№ 852 |
- |
+ |
+++ |
- |
- |
|
№ 853 |
- |
+ |
+++ |
- |
- |
|
№ 854 |
- |
++ |
+++ |
- |
- |
|
№ 855 |
- |
- |
+++ |
- |
- |
|
№856 |
- |
+ |
+++ |
- |
- |
|
№857 |
- |
+ |
- |
- |
+ |
|
№858 |
- |
- |
++ |
- |
- |
|
В3 |
- |
+ |
+++ |
- |
- |
|
В4 |
- |
- |
- |
- |
- |
|
В5 |
+ |
+ |
+++ |
- |
- |
|
В6 |
+ |
+++ |
++ |
+ |
- |
|
В7 |
- |
+ |
- |
- |
- |
Примечание:
- – отсутствие активности
+ – активность выражена слабо
++ – средняя активность
+++ – высокая активность

Рис. 3. Ферментативная активность выделенных культур микроорганизмов: а – протеолиз (В6 и В7), б – амилолитическая (В5 и В6), в – целлюлозная (853, 854, 855), г – уреазная (846, 847, 849), д – липолиз (846)
Таблица 3
Видовая принадлежность изолятов (Maldi-TOF, Bruker)
|
Наименование культур |
Источник выделения |
Идентификация Maldi |
Диапазон идентификации* |
|
№ 846 |
Субстрат с БУ |
Ochrobactrum tritici |
1.888 |
|
№ 847 |
Субстрат с БУ |
Ochrobactrum tritici |
1.882 |
|
№ 848 |
Субстрат с БУ |
Bacillus pumilus |
1.864 |
|
№ 849 |
Субстрат с БУ |
Pseudomonas citronellolis |
2.298 |
|
№ 851 |
Субстрат с БУ |
Lysinibacillus sphaericus |
2.152 |
|
№ 852 |
Субстрат с БУ |
Bacillus pumilus |
1.975 |
|
№ 853 |
Субстрат с БУ |
Bacillus pumilus |
1.905 |
|
№ 854 |
Субстрат с БУ |
Bacillus pumilus |
2.003 |
|
№ 855 |
Субстрат с БУ |
Lysinibacillus sphaericus |
2.107 |
|
№ 856 |
Субстрат с БУ |
Bacillus pumilus |
1.922 |
|
№ 857 |
Субстрат с БУ |
Acinetobacter johnsonii |
1.926 |
|
№ 858 |
Субстрат с БУ |
Bacillus cereus |
1.712 |
|
В3 |
Навоз КРС |
Bacillus subtilis |
2.108 |
|
В5 |
Навоз КРС |
Escherichia coli |
2.398 |
|
В6 |
Навоз КРС |
Bacillus cereus |
2.344 |
На основе полученных данных нами были отобраны наиболее активные гидролитические изоляты, которые были идентифицированы по методу MALDI-TOF. Из 18 изолятов для дальнейшей работы отобрано 15 изолятов, обладающих наиболее высокими ферментативными свойствами. Результаты идентификации активных изолятов микроорганизмов методом масс-спектрометрии представлены в табл. 3.
Результаты идентификации по MALDI-TOF, с высокой степенью идентификации штаммов с гомологией нуклеотидной последовательности 98–100 %.
В результате проведения генетической идентификации отобранных изолятов по MALDI-TOF выделенные микроорганизмы отнесены к Ochrobactrum tritici, Bacillus pumilus, Pseudomonas citronellolis, Lysinibacillus sphaericus, Acinetobacter johnsonii, Bacillus subtilis, Bacillus cereus, Escherichia coli.
Заключение
В Казахстане очень остро стоит проблема переработки животноводческих отходов. Эту проблему можно решить путем анаэробной ферментации с применением ферментативно активных микроорганизмов для ускорения процесса. В результате проведенных исследований из БУ и навоза КРС были выделены различные микроорганизмы. Изучены их культурально-морфологические и физиологические свойства. Отобрано 15 активных штаммов микроорганизмов для создания заквасок с целью бесперебойной работы БУ.
Ценность полученных данных заключается в получении из активных штаммов бактерий, перспективных для ускоренной переработки органических отходов и получения метана. Данные могут стать толчком для разработки новой отечественной микробной добавки для анаэробной ферментации органических отходов.


 science-review.ru
science-review.ru