Одной из актуальных проблем, проявляющихся при дезинфекции объектов или поверхностей, является устойчивость бактерий к применяемым средствам для стерилизации [1], что приводит к появлению и распространению резистентных штаммов микроорганизмов. Для решения данной проблемы необходим поиск новых или модификация существующих веществ, обладающих фунгицидным и бактериальным действием, отвечающих критериям безопасности и сочетающих в себе моющие и обеззараживающие свойства, как, например, полигуанидины. Этот класс полимеров характеризуется высокой антимикробной эффективностью, низкой токсичностью [2] и широко используется в составе многих антисептических средств: «Дезовер», «Дезавид», «Биопаг-Д», «ДеФлок», «Форбицид» – используемых для дезинфекции медицинских учреждений, стерилизации поверхностей. Гуанидиновая группировка в составе полигексаметиленгуанидина (ПГМГ) обладает высокой реакционной способностью, ее модификация позволяет увеличить антимикробную активность и безопасность получаемых полимеров [3]. ПГМГ используется в качестве биоцидного дезинфектанта в медицинских учреждениях с 2001 г., обладает одновременно бактерицидными и фунгицидными свойствами, применяется в качестве моющего, антикоррозионного средства, обладает флокулирующим действием. Все эти характеристики являются достоинствами при выборе эффективного средства для стерилизации растений на этапе введения в культуру in vitro.
Сегодня клональное размножение является современным способом массового и ускоренного получения объектов растительного происхождения in vitro, широко применяется при производстве посадочного материала садовых [4] и древесно-кустарниковых видов. Пролиферация пазушных меристем и побегов обеспечивает высокую генетическую стабильность размножаемых форм in vitro [5].
На процесс введения в культуру in vitro оказывают существенное влияние срок введения и тип экспланта, выбор стерилизатора, компонентный состав питательной среды. В случае ошибочно подобранной схемы для успешной стерилизации происходит контаминация питательной среды и эксплантов грибной и бактериальной инфекциями [6] даже спустя несколько недель культивирования, что ухудшает рост и развитие эксплантов [7]. Сегодня исследователи предлагают химические и физические способы стерилизации на этапе введения в культуру in vitro. Например, верхушки микропобегов Rubus fruticosus ‘Tupy’ облучали дозами гамма-излучения кобальт-60 для получения устойчивых к Botrytis sinerea линий [8]. В качестве химического способа стерилизации в исследованиях российских и зарубежных ученых встречаются две основные группы соединений – это ртутьсодержащие (например, раствор сулемы HgCl2, 0,1 %) [9] cоединения и хлорсодержащие (гипохлорит натрия NaOCl в концентрации 0,5–20 %) вещества с разным временем обработки: от 1 до 15 мин [6, 10]. Отбор нетоксичных стерилизующих агентов, подбор их эффективных концентраций, времени экспозиции для достижения высокого уровня получаемых стерильных эксплантов и их низкого уровня угнетения не теряет своей актуальности.
Одной из перспективных культур, используемых для восстановления пастбищ и деградированных земель, является джузгун безлистный (Calligonum aphyllum (Pall.) Guerke). Представляет собой кустарник из семейства Polygonaceae Juss (высота до 3 м). Имеет стержнекорневую, реже корневищно-стержнекорневую систему из 3–7 парциальных кустов, с красно-бурой корой старых ветвей, хорошо размножается вегетативным способом [11]. В Российской Федерации ареал распространения – Прикаспийская низменность (республики Дагестан и Калмыкия). Растет в типичной песчаной пустыне на мелкобугристых, закрепленных и полузакрепленных песках, у подножия барханов, песчаных гряд. Используется в народном хозяйстве как фитомелиорант, при создании пастбищезащитных полос и как закрепитель песков [12].
Цель исследования – изучение действия стерилизующих агентов на основе полигексаметиленгуанидин гидрохлорида на микрофлору, выделенную из эксплантов С. aphyllum для выявления возможности применения препаратов на их основе на этапе введения в культуру in vitro.
Материалы и методы исследования
Для достижения поставленной цели на первом этапе провели оценку возможного заражения культивируемых эксплантов. Модельные объекты исследования – бактериальные штаммы, полученные путем взятия смывов с образцов растений C. aphyllum, широко распространенных в зоне засушливого климата. Для этого каждый из образцов (экспланты исследуемого растения) помещали в стерильную пробирку, добавляли по 10 мл стерильного физиологического раствора, проводили периодическое встряхивание в течение 10‒15 мин. Далее образовавшиеся суспензии отбирали из пробирок стерильной пипеткой в количестве 1,0 мл и добавляли в пробирки с жидкой питательной средой – картофельно-сахарозной (КСА) или бульоном Чапека (9,0 мл) в трех повторностях и оставляли в термостате при температуре 28‒30 °С до 7 суток для накопления культур микроорганизмов После этого образовавшиеся суспензии отбирали из пробирок стерильной пипеткой по 1,0 мл и добавляли в пробирки с жидкой КСА или бульоном Чапека (производство Hi Media Laboratories PVT, India) (9,0 мл) в трех повторностях и оставляли в термостате при температуре 28‒30 °С до 7 суток для накопления культур микроорганизмов.
Полученные микробные суспензии высевали на чашки Петри со средой КМАФАнМ (производство ВНИИМС, г. Углич) стандартными бактериологическими методами [13]. Для оценки антимикробного действия использовали препараты с содержанием действующего вещества – ПГМГ для эффективной дезинфекции поверхностей и обладающих широким спектром действия: «Дезовер» (ООО «Компания Вереск»), «Дезавид в дорогу» (ООО «Адекватные технологии», Россия). Данные средства содержат ПГМГ в концентрациях 20 % и 0,14 % соответственно. Кроме того, в состав препарата «Дезавид в дорогу» входит алкилдиметилбензиламмоний хлорид (АДБАХ), 0,02 %. Сравнение дезинфицирующих растворов с ПГМГ проводили с препаратами, применяемыми в стерилизации при микроклональном размножении: «Белизна-эконом» и раствор пероксида водорода (10 % об.), раствор нитрата серебра (0,1 % об.).
Определение чувствительности штаммов к стерилизующим агентам проводили диффузионным методом в агар [14]. В чашки Петри наливали питательную агаризованную среду в количестве 25 мл среды на круглую чашку Петри диаметром 100 мм. Вегетативные клетки каждого тест-объекта были приготовлены в стерильном физиологическом растворе из односуточных культур. Для получения сплошного роста исследуемых культур в подготовленные чашки, соблюдая стерильность, вносили по 1 мл суточной бактериальной суспензии (5×105 КОЕ/мл) и равномерно раскатывали суспензию по всей поверхности питательной среды, оставляли впитаться в боксе на 5–10 мин, а затем лишнюю взвесь удаляли дозатором. Далее в чашке Петри проделывали 4 лунки диаметром 5 мм с помощью металлического пробойника, которые заполняли одинаковым количеством капель исследуемого препарата. Через 24–48 ч снимали результаты [15].
Для определения действия препарата на грибной штамм 6.4 исследование проводили в жидкой среде Чапека. Для заражения использовали агаровые блоки диаметром 0,5 мм (вырезали металлическим стерильным пробойником из культивируемого на плотной питательной среде Чапека в течение 7 суток грибного штамма). Препараты готовили с заведомо увеличенной концентрацией в 10 раз, далее в пробирки добавляли по 0,5 мл в 4,5 мл среды Чапека в трех повторностях. Туда же в асептических условиях помещали пинцетом диски, содержащие грибковую культуру, и оставляли в термостате при температуре 30 °С на 7–10 суток для выявления положительного или отрицательного действия препарата. Результат оценивали визуально по наличию или отсутствию грибного роста в пробирке.
Каждый эксперимент был повторен дважды. Статистическую обработку данных проводили с помощью программного обеспечения STATISTICA StatSoft Inc. (USA). Для определения статистически значимых различий для групп с нормальным распределением использовали тест Манна – Уитни (р ≤ 0,05). Размер зон задержки роста определяли с помощью программы ImageJ (США). Полученные данные представлены графически в виде средней арифметической с учетом ошибки среднего.
Результаты исследования и их обсуждение
Для выявления действия стерилизующих агентов в ходе эксперимента с образцов выделено 6 штаммов: 5 бактериальных и 1 грибной (рис. 1).

Рис. 1. Зараженный эксплант С. aphylum (а), бактериальный и грибной рост в жидкой среде через 72 ч (б) и выделение агаровых блоков с плотной среды Чапека с выделенным грибным штаммом (в)
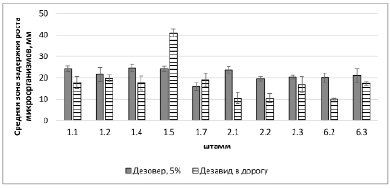
Рис. 2. Действие препаратов «Дезовер» и «Дезавид в дорогу» на исследуемые микроорганизмы
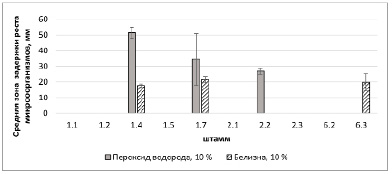
Рис. 3. Нестабильное действие растворов пероксида водорода (10 %) и «Белизны» (10 %) на исследуемые микроорганизмы
На следующем этапе исследования определены средние зоны задержки роста микроорганизмов для используемых в исследовании стерилизующих агентов (рис. 1).
Препарат «Дезовер» оказал стабильное действие на все исследуемые бактериальные культуры, выявлены зоны задержки роста в относительно небольшом диапазоне от 19,60 до 23,67 мм по сравнению с другими препаратами, действие которых оценивалось на этих же штаммах.
При обработке результатов средняя зона задержки роста при действии препарата «Дезовер» составила 20,92 мм, минимальное действие было отмечено при действии на штамм 2.2 – 19,60 мм. Раствор перекиси водорода (10 %) оказался эффективным только для штамма 2.2 (рис. 3).
Обеззараживание раствором пероксида водорода (10 %) было эффективным в первые часы после обработки, но через сутки образовалась вторичная зона роста исследуемого штамма. Раствор белизны (10 %) подействовал только на штамм 6.3, выделенный c исследуемых образцов, средняя зона задержки роста составила 19,8 мм, что на 26,4 % менее эффективно, чем действие раствора Н2О2 (10 %) на исследуемые микроорганизмы. Полученные результаты согласуются с данными [6], где обработка эксплантов косточковых культур раствором белизны (1:3) обеспечила всего 28 % чистых жизнеспособных эксплантов. Раствор нитрата серебра (0,1 % об.) не оказал подавляющего действия на исследуемые микроорганизмы, зоны задержки во всех случаях не были выявлены, все бактериальные штаммы, выделенные с эксплантов С. Aphyllum, оказались к данному раствору нечувствительны.

Рис. 4. Регенеранты С. aphyllum после введения и стерилизации препаратом «Дезавид»: а) третий пассаж, б) пятый пассаж
В ходе исследования по выявлению фунгицидного действия препаратов на выделенный грибной штамм определили эффективность действия растворов перекиси водорода и «Белизна-эконом» (10 %), к которым исследуемый штамм проявил чувствительность. После культивирования в течение 10 дней не было зафиксировано роста при высеве в жидкую среду Чапека. При воздействии на грибной штамм раствора нитрата серебра 0,1 % в жидкой среде положительного эффекта отмечено не было (наблюдали рост микроорганизмов).
Препараты «Дезовер» и «Дезавид в дорогу» в исследуемых концентрациях оказали фунгицидное действие на выделенный грибной штамм, то есть роста микроорганизмов не отмечали после 10-дневного культивирования в жидкой среде Чапека.
Таким образом, растворы перекиси водорода Н2O2 (10 %) и «Белизна-эконом» (10 %), «Дезовер» (5 %) и «Дезавид в дорогу» задерживали рост грибного штамма и могут быть рекомендованы для стерилизационной фунгицидной обработки при увеличении времени воздействия исследуемых препаратов.
Анализируя эффективность действия рассматриваемых препаратов, можно отметить, что «Дезовер» (5 %, концентрация ПГМГ 1 %) оказывал подавляющее действие на рост всех исследуемых микроорганизмов. Препарат «Дезавид в дорогу» показал эффективность в отношении всех бактериальных штаммов, действовал на 31,1 % меньше, чем «Дезовер» (5 %), но при этом концентрация ПГМГ была почти в 10 раз меньше. Препарат «Дезавид» более стабилен, он давал равномерные зоны задержки. В то же время «Дезовер» показал большую эффективность, так как действовал на все бактериальные штаммы в отличие от растворов пероксида водорода и «Белизны» (подействовали только на 20 % исследуемых культур). Раствор нитрата серебра оказался неэффективным в качестве стерилизующего агента. Таким образом, препараты «Дезавид в дорогу» без разведения и «Дезовер» в концентрации 5 % эффективнее, чем стандартно применяемые для стерилизации растворы пероксида водорода и «Белизны» (10 %) (рис. 3), так как оказывают действие и на бактериальные, и на грибные штаммы.
Заключение
Препараты на основе полигексаметиленгуанидин хлорида оказали эффективное антимикробное действие на все выделенные штаммы с эксплантов С. aphyllum. При оценке влияния исследуемых препаратов на бактериальные и грибные штаммы микроорганизмов выявлено, что растворы перекиси водорода и «Белизны» (10 %), а также раствор нитрата серебра (0,1 %) неэффективны в отношении большинства исследуемых штаммов, которые оказались нечувствительны к ним. Поэтому препараты «Дезовер» и «Дезавид в дорогу» можно использовать в ходе подготовительного этапа при введении в культуру in vitro.


 science-review.ru
science-review.ru