Биогенез вируса SARS-CoV-2, вызвавшего самую масштабную эпидемию XXI в., продолжает активно изучаться учеными всего мира. На сегодняшний день расшифрована структура и основные белки вируса. Однако остаются неясными целый ряд ключевых вопросов взаимодействия вируса с клеткой и его внутриклеточного транспорта.
Цель обзора – провести критический анализ данных о биогенезе вируса SARS-CoV-2 и предложить гипотезы для понимания механизмов взаимодействия вируса с инфицированными клетками.
Особенности строения вируса SARS-CoV-2
Вирус SARS-CoV-2 – представитель семейства коронавирусов, имеет сферическую форму с диаметром вириона 90–100 нм и «корону» из 25–50 «шипов» спайковых белков длиной 23 нм. Это самый большой одноцепочечный РНК-вирус с геномом около 29903 пар оснований, 5’-конец РНК-вируса содержит метилированный КЭП, а на 3’-конце находятся несколько аденинов [1]. РНК и нуклеопротеины окружены липидным би-слоем, состоящим в первую очередь из фосфолипидов. Би-слой является производным мембраны эндоплазматического ретикулюма клетки-хозяина, поэтому его толщина меньше, чем у плазмолеммы инфицированной клетки, и составляет соответственно 3,6±0,5 нм.
На поверхности «шипов» SARS-CoV-2 находится большое количество сильно гликозилированных белков и полисахаридов, благодаря которым вирус может долго оставаться незамеченным для иммунной системы человека [2].
Геном SARS-CoV-2 кодирует 29 белков, в том числе 4 структурных и 16 неструктурных белков (NSP1–NSP16), необходимых для реализации жизненного цикла вируса, а также 9 вспомогательных белковых факторов (ORF3a, ORF3b, ORF6, ORF7a, ORF7b, ORF8, ORF9b, ORF9c и ORF10) [3].
К структурным белкам вируса SARS-CoV-2 относятся 4 основных: спайковый белок (S-белок), белок мембраны (M-белок), белок оболочки (E-белок), белок нуклеокапсида (N-белок) [3].
S-белок «шипа» вируса представляет собой трансмембранный гликопротеид I типа с молекулярной массой 600 кДа, который состоит из двух субъединиц – S1 и S2 [2]. S1-субъединица белка отвечает за связывание с рецептором и стабилизацию вириона перед слиянием. С помощью S2-субъединицы происходит слияние вириона с плазматической мембраной клетки-хозяина.
S-белки SARS-CoV и SARS-CoV-2 имеют 75 % совпадений аминокислотных последовательностей [4]. Однако существуют и важные различия. Участок связывания S1 и S2 субъединицы у SARS-CoV-2, в отличие от SARS-CoV, имеет вставку из четырех аминокислот, что повышает аффинность субъединицы к рецептору – ангиотензинпревращающему ферменту-2 (АПФ-2). Сайт S1-S2 SARS-CoV-2 расщепляется протеазой фурин (и некоторыми другими), что активирует S-белок и облегчает его проникновение в клетку [5]. Кроме того, в строении С-хвоста «шипов» SARS-CoV-2 и SARS-CoV выявлена разница в одну аминокислоту: Cys1247 вместо Ala1229 соответственно [6].
Трансмембранный М-белок необходим для поддержания сферической формы вируса. Он может менять конформацию, связываясь при этом с нуклеокапсидом и искривляет мембрану клетки-хозяина. М-белок способен образовывать комплекс с Е-белком, который обеспечивает одинаковый размер вирусных частиц и опосредует высвобождение вирионов.
Трансмембранный Е-белок активно реплицируется внутри инфицированной клетки, но обнаруживается в основном в эндоплазматическом ретикулюме (ЭР) и комплексе Гольджи. Важен для почкования и репликации вируса [6].
N-белок может взаимодействовать с геномной РНК и М-белком, имеет высокую скорость изменения конформации. Участвует в транскрипции и репликации вирусной РНК, а также необходим для сборки вирионов. Большинство белков семейства NSP интенсивно не изучались [7].
Механизм проникновения вируса SARS-CoV-2 в клетку
Клетки-мишени вируса. Заражение вирусом SARS-CoV-2, как сейчас хорошо известно, чаще всего происходит в верхних дыхательных путях человека. Показано, что проникновение вируса в клетку начинается после его прикрепления в плазматической мембране клетки через взаимодействие с АПФ-2 [8], который является для SARS-CoV-2 рецептором. Между тем АПФ-2 широко экспрессируется в различных тканях и органах: в легких, головном мозге, почках [9], тонкой и толстой кишке, яичках, сердечной мышце, щитовидной железе [10]. Не обнаружен АПФ-2 в клетках крови, нет доказательств проникновения вируса в альвеолярные макрофаги [11].
Дыхательные (воздухоносные) пути выстланы респираторной слизистой оболочкой, включающей в себя восемь основных типов клеток: реснитчатые, щеточные, бокаловидные, вставочные, базальные, «булавовидные» («клетки Клара») и эндокринные клетки. SARS-CoV-2 обнаружен на микроворсинках и на апикальной плазматической мембране реснитчатых клеток, микроворсинках «булавовидных» клеток и не выявлен на бокаловидных клетках [12]. Было показано in vivo, что в культуре MUC5B+ клетки Клара не были инфицированы вирусом [4]. В дыхательных путях наблюдается градиент экспрессии AПФ-2 от верхних к нижним отделам [13].
Предполагается, что бокаловидные клетки защищают клетки слизистой дыхательных путей от проникновения вируса выработкой слизи, нарушение секреции которой повышает чувствительность пациентов к вирусу, например больных муковисцидозом [14]. Кроме того, в слизь, вероятнее всего посредством бокаловидных клеток, попадает иммуноглобулин-А (IgA), который может предотвратить доступ большей части вируса к апикальной поверхности клетки-мишени [15]. Наиболее вероятный путь IgA через бокаловидную клетку нам видится следующим образом: синтез IgA плазматическими клетками собственной пластинки слизистой оболочки бронхов; базолатеральный эндоцитоз в транспортную систему комплекса Гольджи бокаловидной клетки с последующей секрецией вместе со слизью в дыхательные пути.
В обонятельной области полости носа бокаловидные клетки отсутствуют. Рецептор АПФ-2 экспрессируется в высокой степени на микроворсинках, поддерживающих эпителиоциты слизистой оболочки, при этом на самих нейросекреторных эпителиоцитах не обнаруживается [16]. Поэтому, вероятнее всего, что SARS-CoV-2 не является нейротропным вирусом [16] и проблемы со вкусом и обонянием у пациентов с COVID-19 не связаны с поражением самих нейросекреторных эпителиоцитов [13].
Между тем предполагается, что SARS-CoV-2 проникает в центральную нервную систему [17]. Через 7 дней после попадания в клетку вирус наблюдался в обонятельной коре головного мозга макак-резусов [18]. У пациентов, умерших от COVID-19, SARS-CoV-2 был обнаружен в тканях головного мозга [19].
Маркер АПФ-2 регистрируется на щеточной каемке (микроворсинках) энтероцитов в подвздошной, двенадцатиперстной, тощей, слепой и толстой кишках [20]. Вирус найден в железистых клетках и эпителии слизистой оболочки выводных протоков больших слюнных желез полости рта [20]. Во всех имеющихся исследованиях АПФ-2 обнаруживается в эндотелиальных клетках мелких и крупных артерий и вен [21].
Клинически было показано и доказано на клетках культуры A549 (у которых трансфекция с АПФ-2 приводила к увеличению чувствительности к вирусу SARS-CoV-2), что клетки с низким уровнем экспрессии АПФ-2 менее чувствительны к заражению вирусом [22]. Вероятнее всего, поэтому дети, экспрессирующие меньше АПФ-2, чем взрослые, более устойчивы к вирусу [23]. Нужно также отметить, что экспрессия AПФ-2 выше у мужчин и увеличивается с возрастом [23].
Структура АПФ-2 рецептора. АПФ-2 – белок, который превращает ангиотензин I и II в ангиотензин I–IX и I–VII соответственно, а также действует на [Des-Arg937]-Bradykinin- кинин-калликреиновую систему, регулируя процессы воспаления и свертывания крови [24]. В организме человека АПФ-2 встречается в двух формах: мембранного белка I-типа и растворенной [9].
АПФ-2 первого типа состоит из 805 аминокислот и имеет: неклеточный N-концевой домен с каталитически активным цинк-связывающим участком HEXXH, трансмембранный домен и С-концевой цитозольный хвост [9]. Внеклеточный домен способен связываться с S1 участком S-белка [14, 15, 17]. Ген, кодирующий АПФ-2, находится в Х-хромосоме и имеет 40 % идентичности и 61 % сходства с AПФ-металлопротеазой [24].
Вторая, растворимая форма АПФ-2 редко обнаруживается в крови из-за ее низкой концентрации [25]. Однако показано, что повышенный уровень растворимого AПФ-2 коррелирует с тяжестью заболевания [25].
Таким образом, мембраносвязанная форма АПФ-2 представляет собой цинкосодержащий трансмембранный металлофермент, который экспрессируется большим количеством клеток.
Роль TMPRSS2 в проникновении SARS-CoV-2 в клетку. Белок TMPRSS2 – мембрано-связанная сериновая протеаза-II человека. Этот фермент стимулирует протеолитическое расщепление АПФ-2, сохраняя его связанную с мембраной форму и каталитическую функцию (в отличие от фермента ADAM17, регулирующего количество тканевой и циркулирующей формы АПФ-2) [25]. После инфицирования клетки SARS-CoV-2 TMPRSS2 расщепляет S-белок по S1–S2 последовательности, активируя последний [26].
Белок TMPRSS2 выявляется в респираторном эпителии [26], на щеточной кайме (микроворсинках) энтероцитов в подвздошной, двенадцатиперстной, тощей, слепой и толстой кишках [20], на микроворсинках поддерживающих клеток обонятельной области полости носа [16]. Так же как и АПФ-2, экспрессия TMPRSS2 демонстрирует градиент от верхних до нижних отделов дыхательных путей. В отличие от АПФ-2, TMPRSS2 наблюдается не только на мембранах микроворсинок, но и в тонком слое апикальной цитоплазмы в реснитчатых клетках и клетках [21]. Нужно отметить, что и другие протеазы (фурин/фуриноподобные, сериновая эндопротеаза, пропротеинконвертаза-1 (PC1), трипсин, матриптаза, катепсины) могут быть вовлечены в процесс проникновения SARS-CoV-2 в клетку и усиливать его инфекционность [27].
Проникновение вируса в клетку. SARS-CoV-2 для проникновения в клетку использует как клатринзависимый, так и клатриннезависимый эндоцитоз [7]. На первом этапе вирус прикрепляется к плазматической мембране клеток слизистой оболочки дыхательных путей человека (преимущественно реснитчатых клеток) [28] с помощью S1 субъединицы S-белка, которая связывается с рецептором AПФ-2. При этом важным механизмом, способствующим доставке вируса в клетку, являются реснички [15]. Далее, мембраносвязанная протеаза TMPRSS2 (возможно, фурин и др.) расщепляет S-белок на участке между S1 и S2 субъединицами, тем самым активируя его. В эксперименте было показано, что ингибирование активности TMPRSS2, а также фурина блокирует проникновение SARS-CoV-2 в клетку [4]. Напротив, повышенная экспрессия TMPRSS2 или фурина стимулирует инфекцию [16].
Согласно наиболее доказанной в настоящее время гипотезе, связывание AПФ-2 с S-белком вызывает эндоцитоз вириона (рис. 1). Необходимость кислой среды для процессинга S-белка также предполагает важность эндоцитоза для проникновения SARS-CoV-2 в клетки. Однако имеются редкие данные, свидетельствующие о том, что среда с низким pH не является решающим фактором для инфицирования, что также было показано во время наблюдений за SARS-CoV, MERS-CoV и вирусом мышиного гепатита [27]. Существуют предположения, что мембрана SARS-CoV-2 может напрямую сливаться с апикальной частью плазматической мембраны клетки-хозяина, без эндоцитоза, что было обнаружено, но только в клеточных культурах [28]. Согласно этой гипотезе, SARS-CoV-2 прикрепляется к поверхности клетки зависимым от AПФ-2 способом, а после расщепления S-белка мембрана вируса сливается с плазматической мембраной микроворсинки клетки-хозяина, и нуклеокапсид выходит в цитозоль [15]. Такой путь возможен для неполяризованных клеток в культуре.
В поляризованных клетках слизистой дыхательных путей плазматическая мембрана в основании микроворсинки содержит клатриновые почки, которые, при захвате вириона, сразу сформируют клатриновую везикулу. Слияние с плазматической мембраной микроворсинки проблематично, так как неизвестны механизмы для доставки нуклеокапсида в перинуклеарную часть клетки. Кроме того, в микроворсинке «мало места» для высвобождения нуклеокапсида.
Таким образом, связывание AПФ-2 с S-белком вызывает эндоцитоз вириона, после чего вирусная оболочка сливается с эндосомальной мембраной клетки-хозяина, что позволяет вирусу высвободить свой геном в цитоплазму.
Биогенез SARS-CoV-2 в клетке-хозяине. Влияние вируса на клетку-хозяина
После проникновения вируса в клетке-хозяине трагически меняется морфология и метаболизм. Происходит накопление коркового актина вблизи плазматической мембраны инфицированных клеток [29]. SARS-CoV-2 запускает фрагментацию комплекса Гольджи посредством подавления белка GRASP55, а также повышает экспрессию белка TGN46 (напротив, увеличение экспрессии GRASP55 или уменьшение TGN46 в эксперименте снижает уровень инфицирования) [30]. При этом органелла не содержит стопок и приобретает вид скопления мелких мембранных фрагментов, рассеянных в цитоплазме клетки и содержащих вирионы [30].
Инфекция COVID-19 приводит не только к разборке «ленты Гольджи», но и мобилизации компартментов клетки-хозяина и белковых механизмов, которые способствуют доставке вириона на клеточную поверхность независимо от комплекса Гольджи [30]. Кроме того, происходит разборка микротрубочек, которые не нужны для биогенеза SARS-CoV-2 или других коронавирусов [17].
Вирус оказывает влияние на ЭР, в частности индуцирует повышенную экспрессию нескольких генов, например экспрессию белков GRP78 и GRP94, ключевых регуляторов реакции ЭР на стресс, которые сами регулируются глюкозой [17]. SARS-CoV-2 нарушает: липидный обмен [29]; вызывает слияние митохондрий [17]; ингибирует механизм метилирования РНК хозяина [30], работу SNAR-белков и аутофагию; предотвращает захват вакуолей с двойной мембраной (ДМВ), преобразованных вирусом в аутофагосомы [31].
SARS-CoV-2 вызывает острый респираторный дистресс-синдром, который характеризуется некрозом альвеолярного эпителия на ранней стадии заболевания. Некроз альвеолярных эпителиальных клеток включает два типа запрограммированного некроза, а именно: некроптоз и пироптоз [32]. Маркеры эпителиального некроза, и в особенности высокоподвижная группа box-1(HMGB-1), выходят в кровь. Уровень HMGB-1 в сыворотке является одним молекулярных маркеров, выделяемых из некротизированных клеток.
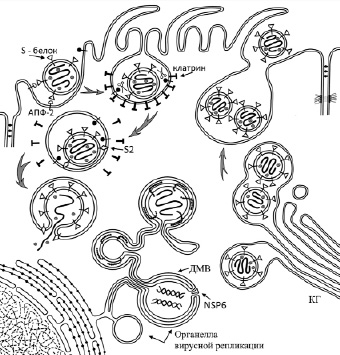
Рис. 1. Схема биогенеза вируса SARS-CoV-2
Репликация происходит в органелле вирусной репликации (рис. 1). С фрагмента ORF1ab считывается полипептид, который разрезается папаин-подобной протеазой (PLP) и 3C-подобной протеазой (3CL Pro) на 16 неструктурных белков вируса [33]. Среди них белки, необходимые для синтеза РНК-зависимой РНК-полимеразы и создания комплексов репликации и транскрипции.
В клетках, инфицированных SARS-CoV, ДМВ являются местами синтеза вирусной РНК [34]. Просвет ДМВ не содержит цитозольных белков, а вместо этого заполнен молекулами двухцепочечной РНК (дцРНК). Одноцепочечных РНК не наблюдается. Длина отдельных фрагментов дцРНК в ДМВ варьирует от 4 до 263 нм при их средней длине 52 нм [35]. ДМВ имеют поры, через которые в цитозоль выходят дцРНК. Мы предположили, что дцРНК служит матрицей для синтеза новой вирусной РНК, а также такая структура необходима для защиты вирусной РНК [36], так как в цитозоле находится много РНКаз, способных легко разрушать одноцепочечные РНК (рис. 2).
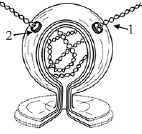
Рис. 2. Схема двухмембранной вакуоли SARS-CoV-2: 1 – двухцепочечная РНК вируса; 2 – мембранная пора
Наличие хеликаз в вирусном геноме предполагает важную роль дцРНК в биогенезе SARS-CoV-2. Хеликазы необходимы для раскручивания или деспирализации дцРНК и, таким образом, для эффективной репликации +РНК вирусных геномов. Описана трехмерная структура хеликаз-полимеразы в репликационно-транскрипционном комплексе SARS-CoV-2 [37].
Гипотеза о механизме формирования двойной мембранной вакуоли и функции NSP6 белка. Внутри ДМВ вакуоли обнаружена дцРНК вируса, что позволяет говорить о ее важности для созревания вириона и защиты от цитозольных РНКаз [38]. В межмембранном пространстве ДМВ отсутствует белковая матрица, при этом мембраны плотно «склеены» между собой [34]. Вероятно, что ДМВ формируется из мембран ЭР, однако в этом случае возникает целый ряд вопросов. Так, неясно, как ЭР образует парные мембраны и как белки NSP и другие вирусные белки, лишенные сигнальных пептидов, встраиваются в липидный би-слой. Неизвестен механизм удаления матрицы ЭР из парного мембранного домена и накопления дцРНК внутри просвета вакуоли при полностью закрытом межмембранном пространстве и то, как формируются и работают специальные (подобные ядерным) поры, с помощью которых дцРНК вируса выходит из ДМВ и, по-видимому, регулируется приток белков в вакуольное пространство [39].
В эксперименте было показано, что трансфекция белка NSP6 вызывает закрытие просвета ЭР с образованием очень плотно расположенных и не содержащих просвета двойных парных мембран, связанных с ЭР [17]. Это явление не может быть объяснено известными на сегодняшний день молекулярными механизмами. При этом мембраны ДМВ имеют низкое содержание холестерина [39]. Иногда на цитозольной стороне ДМВ у других коронавирусов выявляются рибосомы [40].
Между тем можно предположить, что две двойные мембраны соединяются друг с другом, а их края постепенно превращаются в поры, где скапливаются белки ядерных пор. Очень тонкие трубчатые соединения, наблюдаемые между ЭР и ДМВ, позволяют предположить, что ДМВ формируется из ЭР [40]. Поры будут регулировать транспорт молекул, в том числе позволяя проходить только дцРНК. Действительно, в инфицированных SARS-CoV-2 во время контакта двух ДМВ наблюдаются двойные парные мембраны [39].
Не вызывает сомнения, что белок NSP6 участвует в образовании двойной мембранной вакуоли [41]. Однако, как работают молекулярные механизмы, остается загадкой. NSP6 вырезается пептидазой NSP5 из мегаполипептида, после чего у него отсутствует сигнальный домен для встраивания в липидный би-слой мембраны ЭР. Вставка такого белка непосредственно из цитозоля в содержащий холестерин би-слой ЭР чрезвычайно затруднена. Трансфекция NSP6 [41] косвенно демонстрирует, что NSP6-содержащий замкнутый ЭР имеет низкую концентрацию холестерина. На эту роль могли бы подойти мембраны митохондрий, которые имеют мало холестерина и много ненасыщенных длинноцепочечных жирных кислот. Действительно, есть данные, что NSP6 нескольких других коронавирусов локализуется в митохондриях [42]. С другой стороны, инфекция клетки SARS-CoV-2 приводит к слиянию митохондрий [17] с образованием митохондриальных мультиламеллярных везикул митохондриального происхождения – митохондриальных мультиламеллярных органелл (ММО), которые могут служить резервуаром мембран для построения ДМВ [43], так как для их формирования большое количество мембран требуется в короткие сроки. В пользу этой гипотезы говорит тот факт, что ММО произошли от наружной мембраны грамотрицательных архей, следовательно, NSP6 с его шестью трансмембранными доменами может быстро проникнуть в липидный би-слой [35].
Кроме того, в строении двухмембранной вакуоли мог бы использоваться митохондриальный порин, который является основным интегральным мембранным белком ММО, но не взаимодействующим с собственно мембранами ЭР [44]. Тем не менее эта гипотеза требует дополнительного анализа.
Внутриклеточный транспорт вируса и выход вириона из клетки
Формирование вирусной оболочки происходит в так называемых местах выхода из ЭР. Известно, что для сборки SARS-CoV-2 необходим определенный температурный диапазон [45].
Сборка вирусной оболочки начинается с накопления S-белка на люминальной поверхности мембраны ЭР, где образует отдельный комплекс [35]. В накоплении S-белка необходимы E- или M-белки.
KxHxx-мотив в цитозольном хвосте «шипа» вируса слабо связывает ß-COP субъединицу коатомера COPI, что облегчает рециркуляцию шипа в комплекс Гольджи, высвобождая молекулу на поверхность клетки [5]. Образуются уменьшенные комплексы, состоящие из N-белков и РНК, позволяющие эффективно упаковывать большую молекулу РНК в мелкие вирусные частицы [17].
Мембранные белки SARS-CoV-2 сильно гликозилированы, поэтому они попадают из ЭР в комплекс Гольджи [17]. Механизм транспорта вирусных частиц через комплекс Гольджи неизвестен. Однако размер вириона SARS-CoV-2 свидетельствует против «везикулярной» и «диффузионной» моделей транспорта через органеллу [46]. С другой стороны, более высокая численная плотность вирионов на транс-полюсе комплекса Гольджи, по сравнению с цис-полюсом, свидетельствует и против модели «созревания и прогрессии цистерн» [47].
Опубликованы изображения, показывающие, что в пост-Гольджи переносчиках обнаружены частицы, идентичные вирионам, расположенным вне клеточной мембраны, что позволяет предположить, что в них находятся уже зрелые частицы вируса [48]. Утверждается, что коронавирусы используют лизосомы для своей секреции [48]. Однако большая часть частиц проходит через эндосомы, которые часто LAMP1-положительны [47].
Гликозилирование вирусных белков происходит в течение 4 ч после их синтеза. Пост-Гольджи переносчик, наполненный вирусными частицами, сливается с плазматической мембраной, и вирусы секретируются. Неясно, происходит ли секреция непосредственно через апикальную часть плазмолеммы, которая покрыта слизью, или первоначально вирусы доставляются к базолатеральной ее части, а затем в просвет дыхательных путей. Неизвестно, могут ли пост-Гольджи переносчики сливаться с базолатеральной частью плазмолеммы. Чтобы ответить на этот вопрос, необходим анализ распределения SNARE-белков на мембранах секреторного пути.
После люминальной секреции, SARS-CoV-2 связывается с микроворсинками дыхательных путей и индуцирует образование апикально вытянутых и сильно разветвленных микроворсинок, которые помогают SARSCoV-2 проходить через слизь [12]. Эти длинные микроворсинки объясняют, почему люди, выздоровевшие от COVID-19 страдают кашлем с обильным выделением слизи еще в течение длительного времени.
Между тем, несмотря на то, что достигнут значительный прогресс в изучении вируса, многие моменты, касающиеся механизмов взаимодействия SARS-CoV-2 с клетками, остаются непонятными. Неясно, почему АПФ-2 транспортируется к апикальной части плазмолеммы, тогда как сигналов для апикальной сортировки для него не обнаружено? Если AПФ-2 является апикальнонаправленным белком, то почему в клетке культуры могут быть инфицированы неполяризованные клетки? Какие механизмы участвуют в почковании SARSCoV-2? Как транспортируются незрелые вирионы в комплекс Гольджи? Каков механизм внутри-Гольджи транспорта незрелых и зрелых вирионов?
Между тем основные этапы биогенеза вируса в целом понятны. SARS-CoV-2 проникает в клетку путем клатрин-зависимого эндоцитоза. В эндосоме S-белок расщепляется с помощью TMDRSS2, и образовавшаяся S2-субъединица перфорирует мембраны эндосом. Оказавшись в цитозоле, РНК вируса вызывает образование органеллы вирусной репликации, состоящей из сети замкнутых мембран эндоплазматического ретикулюма и двухмембранных вакуолей (ДМВ), где вирус генерирует репликационную вилку. Из репликационной органеллы дцРНК вируса через поры ДМВ выходит в цитозоль и доставляется к комплексу Гольджи. Пройдя через комплекс Гольджи, вирус доставляется переносчиками к плазмалемме инфицированной клетки.
Понимая клеточные механизмы транспорта вируса, можно научиться эффективно воздействовать на целый ряд белков и молекулярных машин клетки и внутриклеточного транспорта, что может остановить или значительно уменьшить заражение SARS-CoV-2, например на ингибитор кальциевой помпы SERCA (тапсигаргин) и ингибитор гликозилирования белка (туникамицин); ингибитор ArfGEF (брефельдин А) и ингибитор транс-Гольджи транспорта (монензин); ингибитор Н+-АТФазы вакуолярного типа (бафиломицин А1) и вакуолин-1 (индуктор лизосом), ингибиторы лизосомальных гидролаз (E64d, лейпептин и пепстатин) и целый ряд других, ингибирующих внутриклеточный транспорт и эндоцитоз.


 science-review.ru
science-review.ru