Аутоиммунный тиреоидит (АИТ) – хроническое воспалительное заболевание щитовидной железы, при котором имеет место деструкция паренхимы щитовидной железы в результате длительной прогрессирующей лимфоидной инфильтрации. В настоящее время заболеваемость АИТ растет во всем мире и регистрируется у 3–5 % населения. Считают, что в действительности распространенность и встречаемость заболевания шире, так как зачастую патология просто не подозревается [1, 2].
Одним из последствий АИТ в самой щитовидной железе является не только разрушение тиреоцитов, но и снижение или даже прекращение синтеза гормонов – тироксина и трийодтиронина. В результате развиваются различные осложнения, связанные с патологией нервной, репродуктивной, сердечно-сосудистой и других систем [3]. Кроме того, хронический АИТ часто сочетается с другими аутоиммунными заболеваниями, такими как хроническая недостаточность слюнных желез, аутоиммунная гемолитическая анемия, мегалоцитарная анемия, тромбоцитопения, красная волчанка, ревматоидный артрит, склеродермия, васкулит [4]. Сочетание аутоиммунных патологий, считают, связано со способностью одного аутоиммунного заболевания быть причиной и/или предпосылкой другого [5].
Одним из самых распространенных аутоиммунных заболеваний в настоящее время является сахарный диабет, в основе генеза которого лежат дефицит инсулина или потеря чувствительности инсулиновых рецепторов к гормону [6]. Диабет проявляется прежде всего в повышенном уровне глюкозы из-за недостаточной продукция инсулина или неэффективности использования вырабатываемого инсулина. Инсулин является единственным гипогликемическим гормоном, снижающим уровень глюкозы в крови, благодаря регуляции утилизации глюкозы крови в гликоген печени или мышц [6, 7]. Гипергликемическим свойством обладают несколько гормонов, в том числе и тиреоидные [8]. Участие тиреоидных гормонов в гомеостазе глюкозы предполагает опосредованную взаимно обусловленную функциональную связь между щитовидной и поджелудочной железой. Такая зависимость, можно предположить, имеет место не только при патологии щитовидной железы, в том числе аутоиммунной, но и при коррекции сопутствующих нарушений различными препаратами.
В последние годы в профилактике и терапии эндокринных, в том числе аутоиммунных, заболеваний широко применяются эссенциальные микроэлементы [9]. Исходя из этого, нам показалось небезынтересным выявить, как изменяется уровень инсулина крови в динамике развития аутоиммунной патологии щитовидной железы при коррекции заболевания селеном.
Цель настоящей работы – сопоставить влияние различных доз селена на уровень инсулина в сыворотке крови при АИТ.
Материалы и методы исследования
В опытах были использованы белые беспородные крысы-самцы массой 200–220 г, которых содержали в хорошо вентилируемом светлом помещении при естественном освещении и влажности, при комнатной температуре на рационе вивария. Воду и корм животным давали в одно и то же время суток с избытком.
У крыс первой опытной группы вызывали экспериментальный АИТ. Для этого каждой крысе подкожно вводили 0,1 мл бычий тиреоглобулин (Merck KGaA, Germany) (100 мкг/крысу) с полным адъювантом Фрейнда (ПанЭко, Россия) в объемном соотношении 1:1. Затем на 6-й и 7-й дни после первой инъекции крысам также подкожно вводили смесь тиреоглобулина и неполного адъюванта Фрейнда в том же объеме и в той же дозе аналогичным способом. Далее на 21-й день после первой инъекции было определено содержание титра антител к тиреоидпероксидазе (анти-ТПО) в сыворотке крови. Для определения титра анти-ТПО кровь получали из десен. Только крысы с высоким титром были использованы в последующих наблюдениях. Титр анти-ТПО определяли при помощи набора фирмы «Assay Genie», Ирландия на иммуноферментном анализаторе RT-2100C Microplate Reader Rayto (Китай).
Крысам второй и третьей опытных групп для коррекции аутоиммунного заболевания ежедневно утром в течение трех месяцев интрагастрально вводили селен в средней (0,4 мг/кг) и высокой (1,2 мг/кг) дозах в составе селенометионина (Thorne Research, США).
Крыс контрольной группы обрабатывали вместо смеси для иммунизации и раствора селена метионина физиологическим раствором аналогичным способом, в таком же объеме и в те же сроки.
Для определения инсулина крыс забивали декапитацией в первый, второй и третий месяцы после создания модели АИТ. Инсулин определяли в 0,01 мл сыворотке крови на биохимическом анализаторе RT-2100C Microplate Reader Rayto (Китай) с использованием реактивов фирмы Human (Германия).
Полученные результаты были обработаны c применением t-критерия Стъюдента. Вычисляли среднюю арифметическую величину (М), стандартную ошибку и показатель достоверности (Р). Отличия считались статистически достоверными при вероятности более 95 % (Р < 0,05).
Результаты исследования и их обсуждение
Прежде всего, следует отметить, что титр анти-ТПО у животных с вызванным АИТ заметно увеличился.
Влияние АИТ на содержание анти-ТПО и инсулина в сыворотке крови крыс (M±m; н = 6)
|
Группы животных |
Продолжительность наблюдения |
||
|
1 месяц |
2 месяца |
3 месяца |
|
|
Анти-ТПО (ед/л) |
|||
|
Контроль |
0,41±0,02 100 |
0,45±0,02 100 |
0,40±0,02 100 |
|
АИТ* |
1,83±0,15 448,15 < 0,001 |
2,02±0,13 450,99 < 0,001 |
1,98±0,19 498,99 < 0,001 |
|
Инсулин (пг/мл) |
|||
|
Контроль % |
0,39±0,03 100 |
0,40±0,02 100 |
0,38±0,04 100 |
|
AIT % P |
1,03±0,15 261,56 < 0,005 |
1,38±0,09 263,89 < 0,001 |
1,53±0,15 391,01 < 0,001 |
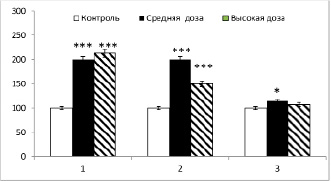
Рис. 1. Влияние селена на титр анти-ТПО в сыворотке крови у крыс с экспериментальным АИТ (M±m; при n = 6). По оси абсцисс – месяцы наблюдений, по оси ординат титр анти-ТПО в % по отношению к контрольной величине, принятой за 100 %
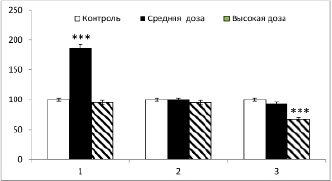
Рис. 2. Влияние селена на содержание инсулина в сыворотке крови у крыс с экспериментальным АИТ (M±m; при n = 6). По оси абсцисс – месяцы наблюдений, по оси ординат титр анти-ТПО в % по отношению к контрольной величине, принятой за 100 %
Титр к анти-ТПО был выше контрольных значений в 4,5 раз в первый и второй месяцы наблюдений и в 5,0 раз на третий месяц экспериментов.
Содержание инсулина в крови животных контрольной группы в течение всего периода экспериментов отмечалось на одном уровне. Однако у животных с вызванным АИТ содержание инсулина увеличивалось соответственно в 2,7; 3,5 и 4,0 раза в первый, второй и третий месяцы наблюдений по сравнению с контрольными значениями. Видно, что, несмотря на то, что уровень выраженности АИТ был идентичным на протяжении всего наблюдения, содержание инсулина в сыворотке крови увеличивалось по мере увеличения сроков длительности заболевания (таблица).
На рис. 1 показаны результаты по влиянию селена на титр анти-ТПО в средних и высоких дозах у крыс с АИТ.
Видно, что при применении средних доз селена для коррекции АИТ титр антител заметно приближался, но не достигал величин позитивного контроля к третьему месяцу наблюдения. При применении же высоких доз селена титр анти-ТПО статистически достоверно уменьшался на втором и третьем месяце исследований по сравнению с контрольными значениями, достигая уровня контроля только к третьему месяцу.
Данные показывают, что при длительном применении селена для коррекции аутоиммунной патологии щитовидной железы титр-АПО в сыворотке кровы уменьшается. Такой эффект более проявляется для высоких доз селена, по сравнению со средними дозами (рис. 1).
Рисунок 2 отражает результаты по влиянию селена на содержание инсулина в сыворотке крови в средних и высоких дозах у крыс с АИТ.
В этом случае при коррекции АИТ средними дозами селена в составе селенаметионина уровень инсулина у животных был в два раза больше по сравнению с контрольными значениями. Однако на второй и третий месяцы экспериментов инсулин в сыворотке крови регистрировался на уровне контроля. При интрагастральном введении крысам с АИТ высоких доз селена уровень инсулина приближался к контрольным значениям уже на первом месяце наблюдений и сохранялся на этом же уровне во втором. На третий месяц наблюдений уровень инсулина у крыс с вызванным АИТ регистрировался даже ниже значений, отмеченных у здоровых животных контрольной группы.
Результаты показывают, что как средние, так и высокие дозы селена, вводимые крысам с АИТ, вызывают приближение уровня инсулина к контролю. Корригирующий эффект при введении высоких доз селена проявлялся намного быстрее, и к концу экспериментов уровень гормона был даже ниже величин, отмеченных у крыс контрольной группы.
Таким образом, полученные данные показывают, что высокие дозы селена более эффективны для коррекции уровня как анти-ТПО, так и инсулина.
Положительное влияние селена на АИТ и сопутствующие сдвиги в эндокринной функции поджелудочной железы, скорее всего, обусловлены его огромной ролью в клеточном метаболизме. Известно, что в ткани щитовидной железы содержится самая высокая концентрация селена, так как этот элемент является важным компонентом биосинтеза и метаболизма гормонов щитовидной железы. Показано, что селен проявляет свою биологическую функцию через селенопротеины, основными классами которых являются глутатионпероксидаза, йодтирониндейодиназа, тиоредоксинредуктаза, селенопротеин K, селенопротеин P и др. Селенопротеины принимают участие во многих разнообразных биологических процессах, включая оксидоредукцию, антиоксидантную защиту, синтез ДНК, метаболизм гормонов щитовидной железы, иммунные реакции и т.д. [10].
В некоторых исследованиях доказана благотворная роль селена на прогрессирование аутоиммунных заболеваний щитовидной железы. Считают, что это связано с тем, что селен может подавлять чрезмерно реагирующую активность иммунной системы или нарушать иммунную функцию т-лимфоцитов посредством антиоксидантных механизмов, участвующих в патогенезе аутоиммунных заболеваний щитовидной железы Добавление селена может подавлять th1-зависимый иммунный ответ, тормозя воспалительную реакцию и деструктивное повреждение щитовидной железы [11].
Полученные результаты показывают, что под воздействием селена при АИТ имеет место не только коррекция аутоиммунных нарушений в щитовидной железе, что проявляется в заметном снижении анти-ТПО у крыс с АИТ, но и в эндокринной секреции поджелудочной железы, что проявляется в нормализации вызванной патологией гиперинсулинемии. Полученные данные подтверждают ранее высказанные предположения Chen и др. (2018) о взаимосвязи между аутоиммунной дисфункцией щитовидной железы и аутоиммунными поражениями поджелудочной железы, проявляющейся в тормозном влиянии инсулина на утилизацию глюкозы в связи с потерей чувствительности инсулин-зависимых рецепторов к гормону [12]. Возрастание уровня инсулина в сыворотке крови в зависимости от длительности заболевания (таблица), отмеченное в наших исследованиях, подтверждает выдвинутую этими авторами гипотезу.
Введение селена крысам с АИТ оказывает позитивный эффект как на содержание анти-ТПО, так и на уровень инсулина в сыворотке крови. Экзогенный селен практически полностью устраняет аутоиммунную патологию к третьему месяцу наблюдений, что особенно четко проявляется при применении высоких доз элемента. Выявленная аналогия в коррекции содержания анти-ТПО и инсулина в сыворотке крови крыс говорит о возможном участии АИП щитовидной железы в развитии сахарного диабета 2 типа.
Следует отметить, что при этом содержание инсулина в сыворотке крови под влиянием обеих примененных доз при АИТ восстанавливается в более ранние сроки, чем уровень анти-ТПО. Некоторое расхождение во времени в корригирующем влиянии селена на титр анти-ТПО и содержание инсулина при аутоиммунной патологии щитовидной железы указывает и на независимое от АИТ влияние селена на коррекцию вторичной патологии, скорее благодаря его сильным антиоксидантным свойствам [10].
Выводы
1. АИТ вызывает увеличение анти-ТПО и повышение уровня инсулина в сыворотке крови у крыс, что предполагает развитие сахарного диабета 2 типа у животных с аутоиммунной патологией.
2. Введение селена в средних и высоких дозах приводит к нормализации аутоиммунной патологии щитовидной железы, равно как и уровня инсулина. Нормализация инсулина имеет место в более ранние сроки по сравнению с восстановлением титра анти-ТПО. При этом высокие дозы оказались более эффективными.
3. Специфичная динамика изменений титра анти-ТПО и уровня инсулина свидетельствует об участии АИТ-зависимых и АИТ-независимых метаболических путей в регуляции уровня инсулина при аутоиммунной патологии щитовидной железы.


 science-review.ru
science-review.ru