Введение
Глобальная распространенность воспалительных заболеваний кишечника быстро растет, и в настоящее время этот показатель наблюдается примерно у одного из 200 человек в западных странах. В настоящее время патофизиология воспалительных заболеваний кишечника включает два отдельных заболевания: болезнь Крона и язвенный колит, которые различаются пораженными частями желудочно-кишечного тракта, симптомами, осложнениями, течением заболевания и лечением [1]. Болезнь Крона – это хроническое воспалительное заболевание желудочно-кишечного тракта, которое чаще встречается среди населения. Болезнь Крона может быть результатом сложного взаимодействия между наследственностью, факторами окружающей среды и измененной микробиотой кишечника. Пациенты с болезнью Крона будут испытывать симптомы боли в животе, хронической диареи, потери веса и усталости [2]. Болезнь Крона может возникать во всех частях желудочно-кишечного тракта, в основном в терминальной подвздошной и толстой кишках.
БК характеризуется поражениями кишечника (т.е. воспалительными участками, расположенными между нормальной видимой слизистой оболочкой) в любом месте желудочно-кишечного тракта и включает хроническое рецидивирующее трансмуральное воспаление, которое приводит к хронической боли в животе, диарее, непроходимости или перианальным поражениям. БК является прогрессирующей и разрушительной: 21-47% пациентов также испытывают системные экстракорпоральные проявления, которые сильно влияют на качество жизни пациентов и долгосрочные результаты, включая госпитализацию, осложнения и хирургическое вмешательство различными опасными способами. Кроме того, у половины всех пациентов с БК развиваются кишечные осложнения, такие как стриктуры или свищи, в течение 10 лет после постановки диагноза. Было обнаружено, что до 30% пациентов с КК имели повреждение кишечника на момент постановки диагноза, и половине этих пациентов требовалось хирургическое вмешательство в течение 20 лет после постановки диагноза. Хотя БК чаще всего встречается у пациентов моложе 30 лет, заболеваемость среди пожилых людей растет. Многие исследования не обнаружили половых различий в заболеваемости в западных странах, тогда как заболеваемость БК выше у мужчин, чем у женщин в азиатских популяциях [3].
Болезнь Крона возникает в результате взаимодействия генетической предрасположенности, факторов окружающей среды и микрофлоры кишечника, что нарушает иммунный ответ слизистой оболочки и нарушает барьерную функцию эпителия [4].
В западных странах курение было определено как единственный модифицируемый фактор риска БК. Курение более чем удваивает риск развития БК среди женщин (хотя и с возрастом). Курение также связано с ранним началом заболевания, необходимостью иммуносупрессии, повышенной потребностью в хирургическом вмешательстве и более высокой частотой рецидивов послеоперационного заболевания. Дисбактериоз кишечника является отличительной чертой БК, поскольку диета является фактором окружающей среды (которая изменилась за последнее десятилетие), способным повлиять на микробиоту кишечника. В частности, отношения организма-хозяина и микробиоты кишечника изменились с изменениями в составе пищи и переходом от продуктов с высоким содержанием клетчатки и низким содержанием жира к обработанным пищевым продуктам, содержащим пищевые добавки. Снижение потребления пищевых волокон, а также частые колебания между продуктами с высоким и низким содержанием клетчатки приводят к снижению разнообразия кишечной микробиоты и развитию БК. Два проспективных исследования, проведенных в Швеции, показали, что более строгое соблюдение средиземноморской диеты может значительно снизить риск более позднего развития БК [4; 5]. Заболеваемость болезнью Крона резко возросла, поскольку страны с низким уровнем риска, такие как Япония, Китай и Индия, приняли западный образ жизни. Несмотря на высокий уровень курения, в Азии и Африке болезнь Крона встречается очень редко. И наоборот, несмотря на низкий уровень курения в странах Северной Европы, заболеваемость болезнью Крона очень высока [5].
Несколько исследований показали, что состав микробиоты кишечника может изменяться в ответ на диету. Кроме того, компоненты диеты могут влиять на эпигенетические модификации и, таким образом, вызывать длительные фенотипические изменения. Выявление сложных взаимодействий между диетой и дисбактериозом кишечника при БК может улучшить наше понимание роли диеты в патогенезе БК. Частый прием антибиотиков в детстве увеличивает риск развития БК [6]. Кроме того, есть сообщения о том, что оральные контрацептивы, аспирин и НПВП увеличивают риск БК. Факторы окружающей среды, связанные со снижением риска БК, включают то, что грудное вскармливание снижает риск БК, а статины способствуют снижению риска [7]. Поскольку потенциально связанные факторы окружающей среды различаются в разных популяциях, выборочное вмешательство по профилактике заболеваний может быть нацелено на определенные группы населения. Изменение курения, разумное использование антибиотиков, поощрение грудного вскармливания и советы по правильному питанию могут служить надежными подходами к снижению прогрессирования БК и улучшению долгосрочных результатов. Ожидаются более качественные клинические испытания, диетические вмешательства, и новые элиминационные диеты могут лучше контролировать заболевание или предотвращать осложнения [8].
По сравнению с факторами окружающей среды, был достигнут больший успех в определении геномной изменчивости, определяющей риск заболевания. Выявлена наследственность БК от поколения к поколению. У близнецов, развившихся из одной яйцеклетки, развитие БK на 50% выше, чем ЯК. Около 12% пациентов имеют семейный анамнез болезни Крона [9]. Исследования геномных ассоциаций выявили более 200 аллелей, связанных с воспалительными заболеваниями кишечника, 37 из которых специфичны для болезни Крона. Только 13,1% наследования болезни объясняется наследственной изменчивостью, что подчеркивает важность эпигенетических и других негенетических факторов окружающей среды. Несмотря на все достижения, одна только генетика не может объяснить вариации и фенотипы заболевания, и поэтому генетическая оценка не используется в клинической практике [10]. После основополагающего открытия в 2001 году изменения кодирования гена рецептора внутриклеточного распознавания образов nod2 (также известного как CARD15), избирательно связанного с риском БK, более 200 локусов, связанных с БK, были идентифицированы у более чем 70 000 человек. Большинство небольших очагов риска КК имеют общие черты с широким спектром иммуномедиационных заболеваний. Важно отметить, что большая часть общего наследственного риска объясняется изменениями в нескольких локусах, включая ген аутофагии nod2 и atg16l1 (оба специфичны для CD) и ген рецептора IL-23 il23r (который увеличивает риск KK и ЯК) [11].
Метагеномные исследования показывают, что четыре основных типа бактерий (Bacteroidetes, Firmicutes, Actinobacteria и Proteobacteria), состоящие в основном из тысяч анаэробных видов, колонизируют кишечник человека с вертикальным проксимально-дистальным градиентом, контролируемым желудочной кислотой. Разнообразие типов в кишечнике также обычно зависит от временных, индивидуальных, диетических и лекарственных факторов. Однако изменчивость здоровой микробиоты кишечника в целом стратифицирована и не является непрерывной. Сравнительные исследования показали снижение кластеризации и разнообразия у пациентов с болезнью Крона, особенно у Firmicutes и Bacteroides fila. Это было связано с повышенным риском послеоперационного рецидива болезни Крона подвздошной кишки, и ее экспериментальное выздоровление имело противовоспалительный эффект. Болезнь Крона не только связана с уменьшением комменсального разнообразия, но и требует чувствительного генотипа – соответствующие мутации восприимчивости были подтверждены исследованиями на мышах с людьми [12].
Примерно одна треть пациентов с БК страдала заболеванием толстой кишки, одна треть – илеоколоническим заболеванием, а одна треть – заболеванием тонкой кишки. Распространенность поражения верхних отделов желудочно-кишечного тракта при БК значительно варьируется в зависимости от исследования. Первоначально считалось, что поражение верхних отделов желудочно-кишечного тракта имеет низкую распространенность (0,3-5%), но за последние два десятилетия была зарегистрирована более высокая распространенность (30-75%) [13]. «Поражение верхних отделов желудочно-кишечного тракта» относится к поражению пищевода, желудка, двенадцатиперстной кишки и тощей кишки по отдельности или в сочетании с другими участками. До трети пациентов имеют стриктурные или проникающие кишечные осложнения на момент постановки диагноза, а половина всех пациентов испытывают кишечные осложнения в течение 20 лет после постановки диагноза. Подавляющее большинство пациентов (40%) имеют повреждение кишечника в течение 1 года после постановки диагноза. Лечение иммуномодуляторами или антагонистами TNF в течение первых 2 лет после постановки диагноза снижает риск развития стриктуры кишечника по сравнению с началом лечения этими препаратами более 2 лет после постановки диагноза. Кроме того, раннее лечение иммуномодуляторами снижает риск хирургического вмешательства на кишечнике, перианальной хирургии и любых осложнений [14].
Симптомы могут быть скрытыми, неспецифическими и зависеть от локализации и тяжести заболевания. У некоторых пациентов симптомы могут проявляться годами до постановки диагноза БК. Диарея и боль в животе являются основными симптомами, о которых сообщают пациенты с БК [15]. Другие симптомы включают усталость, потерю веса, лихорадку, анемию и повторяющиеся свищи или другие перианальные образования (язвы или трещины). Непроходимость кишечника у пациентов с ригидностью приводит к отсутствию дефекации, что может привести к гиперактивным звукам кишечника, тошноте и рвоте. Свищи или абсцессы могут быть проявлением проникающего заболевания. При наличии абсцесса у пациентов могут наблюдаться системные симптомы, такие как лихорадка и озноб. Симптомы, вызванные свищами, зависят от местоположения свища: в случае энтероэнтеритных свищей может возникать такой симптом, как диарея, в случае энтеровезикулярных (между кишечником и мочевым пузырем) или энтероуретеральных свищей – инфекции мочевыводящих путей. Симптомы похожи у пациентов с ранним началом БК и у пациентов с поздним началом БК, но есть некоторые различия [16].
Основная цель исследования – создание экспериментальной модели болезни Крона в лабораторных условиях и анализ изменений в ней морфофункциональных показателей.
Материалы и методы исследования
Для проведения исследований использовались беспородные белые крысы обоих полов весом 165-200 граммов в возрасте 2-3 месяцев. Их кормили нормальной пищей. Каждую группу держали отдельно. Помещение, в котором содержались животные, содержали при температуре 20-28°С и влажности 50%. Всего было использовано 30 беспородных белых крыс. Одну группу крыс содержали в отдельной комнате для контроля, оставшейся группе крыс вводили ректально по 2 мл 4%-ного раствора уксусной кислоты. Через 24-48 часов животных забивали, определяли и сравнивали количество белков, жиров, углеводов в крови и кишечнике.
Через 24-48 часов с момента введения в стенке толстой кишки наблюдаются следующие изменения: нейтрофильная инфильтрация кишечной стенки, некроз слизистой и подслизистой оболочек, расширение сосудов, слой опухоли подслизистой оболочки и язвы. Также недостатком применения уксусной кислоты является то, что у подопытных животных наблюдается значительная частота летального исхода из-за перфорации стенки кишечника, значительное кровотечение и развитие перитонита.
Анализ крови у крыс с экспериментальной болезнью Крона. Белок был идентифицирован в крови после того, как была получена экспериментальная модель болезни Крона: крысы, инфицированные болезнью Крона, были признаны первой группой, а белок в крови крыс, дважды инфицированных болезнью Крона, – второй группой.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 13,044 г/л, в первой группе – 3,798 г/л, во второй – 20,524 г/л. Отмечено, что в группе с болезнью Крона было обнаружено снижение уровня белка на 70%. Предполагалось, что это результат полного нарушения всасывания в кишечнике. Однако в группе с двойной болезнью Крона наблюдалось увеличение общего белка в крови на 36,44% по сравнению с контрольной группой. Сделан вывод, что при обострении заболевания в 2 раза происходит апоптоз в клетках, повышение уровня белка в крови за счет усиления иммунологических реакций (рис. 1).
Углеводы были идентифицированы в крови после того, как была создана экспериментальная модель Крона: крысы, инфицированные болезнью Крона, были классифицированы как первая группа, а углеводы в крови крыс, дважды инфицированных болезнью Крона, были классифицированы как вторая группа.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 1,492 ммоль/л, в первой группе – 1,408 ммоль/л, во второй – 0,874 ммоль/л. Однократное снижение потребления углеводов на 5,63% было обнаружено в группе с болезнью Крона. Однако в группе с двойной болезнью Крона наблюдалось снижение потребления углеводов на 41,4% (рис. 2).
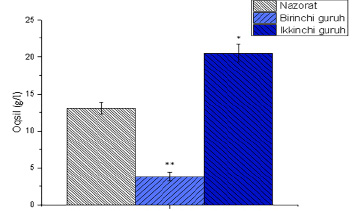
Рис. 1. Количество белка, определенное в крови крысы в экспериментальной модели Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
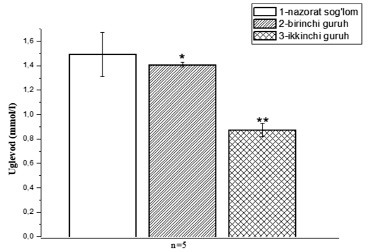
Рис. 2. Количество углеводов, определенное в крови крысы в экспериментальной модели Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
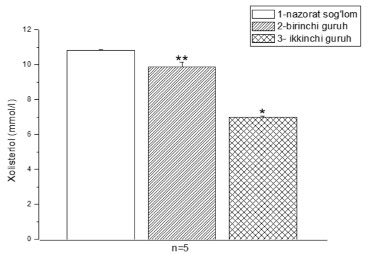
Рис. 3. Количество холестерина, определенное в крови крысы в экспериментальной модели Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
Когда была создана экспериментальная модель Крона, в крови был обнаружен холестерол: крысы, инфицированные болезнью Крона, были признаны первой группой, а кровь крыс, дважды инфицированных болезнью Крона, содержала холестерин – вторая группа.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 10,83 ммоль/л, в первой группе – 9,872 ммоль/л, во второй – 7,002 ммоль/л. Однажды было обнаружено, что в группе с болезнью Крона уровень холестерина снизился на 8,84%. Однако в группе, у которой было два случая болезни Крона, уровень холестерина снизился на 35,3% (рис. 3).
После создания экспериментальной модели Крона белок был идентифицирован в крови путем коррекции биологически активными веществами: первой группой были признаны крысы, инфицированные Кроном, с коррекцией тканевыми пептидами, а второй группой – крысы с белком в крови, с коррекцией тканевыми пептидами и дигидрокверцитином.
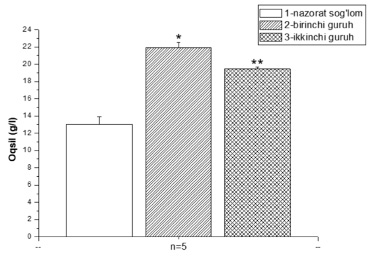
Рис. 4. Количество белка, обнаруженного в крови крыс в экспериментальной модели, было скорректировано тканевыми пептидами и дигидрокверцитином Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
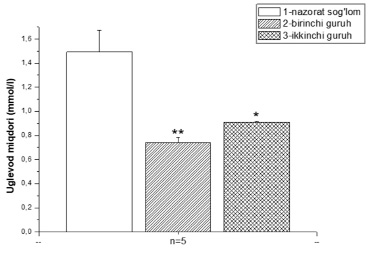
Рис. 5. Количество углеводов, обнаруженных в крови крыс в экспериментальной модели, было скорректировано тканевыми пептидами и дигидрокверцитином Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 13,044 г/л, в первой группе – 21,908 г/л, во второй – 19,44 г/л. В группе, инфицированной болезнью Крона и получавшей коррекцию тканевыми пептидами, было обнаружено увеличение уровня белка на 40,5%. Однако в группе с болезнью Крона, получавшей тканевые пептиды и коррекцию дигидрокверцитином, наблюдалось увеличение уровня белка на 32,9% (рис. 4).
Как только экспериментальная модель Крона была получена, углеводы были идентифицированы в крови путем коррекции биологически активными веществами: первой группой были признаны крысы, инфицированные болезнью Крона, с коррекцией тканевыми пептидами, а второй группой – углеводы в крови крыс, с коррекцией тканевыми пептидами и дигидрокверцитином.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 1,492 ммоль/л, в первой группе – 0,74 ммоль/л, во второй – 0,91 ммоль/л. В группе с болезнью Крона и коррекцией тканевых пептидов было обнаружено снижение уровня углеводов на 50,4%. Однако в группе с болезнью Крона, получавшей тканевые пептиды и дигидрокверцитин, наблюдалось снижение потребления углеводов на 39% (рис. 5).
После создания экспериментальной модели Крона холестерин был определен в крови путем коррекции биологически активными веществами: первой группой были признаны крысы, инфицированные Кроном, с коррекцией тканевыми пептидами, а второй группой – холестерин в крови крыс, с коррекцией тканевыми пептидами и дигидрокверцитином.
При анализе результатов выяснилось, что в контрольной группе средний показатель составил 10,83 ммоль/л, в первой группе – 9,472 ммоль/л, во второй – 8,984 ммоль/л.
В группе с болезнью Крона и коррекцией тканевыми пептидами было обнаружено снижение уровня холестерина на 12,54%. Однако в группе с болезнью Крона, получавшей тканевые пептиды и коррекцию дигидрокверцитином, уровень холестерина снизился на 17% (рис. 6).
Результаты гистологического исследования
Для гистологического подтверждения изменений в тканях и происхождения модели при индуцировании хронических воспалительных заболеваний кишечника у крыс в условиях эксперимента брали образцы тканей и сравнивали их морфофункциональное состояние.
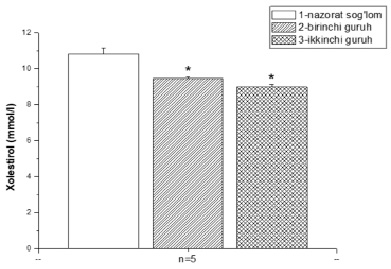
Рис. 6. Уровни холестерина, обнаруженные в крови крыс в экспериментальной модели, были скорректированы тканевыми пептидами и дигидрокверцитином Примечание: * – р<0,05; ** – р<0,01; *** – р<0,001.
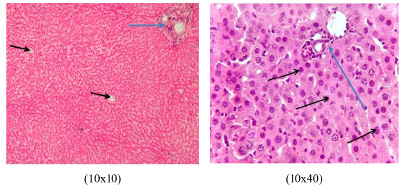
Рис. 7. Гистология ткани печени здоровой крысы (контрольная группа): а – венозное полнокровие в кровеносных сосудах отсутствует (показано черной стрелкой); b – ситоархитектоника печеночной триады (показано синей стрелкой); c – отсутствие очагов некробиоза в гепатоцитах; d – отсутствие структурных нарушений в ситоархитектонике печеночной триады. Окраска гематоксилином и эозином. X: 10х10
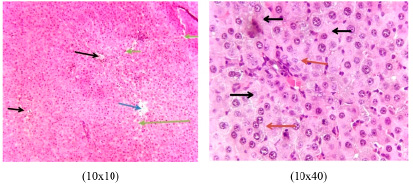
Рис. 8. Гистология ткани печени больной крысы: а – венозное полнокровие в венозных кровеносных сосудах (показано синей стрелкой); b – спазм и внутрисосудистый гемостаз в артериальных кровеносных сосудах (показано черной стрелкой); c – расширение синусоидальных пространств и области вокруг печеночной триады, что обычно наблюдается при острых или хронических интоксикациях (показано зеленой стрелкой); d – многочисленные очаги некробиоза в гепатоцитах: кариопикноз, кариорексис, кариолизис ядер клеток (показано черной стрелкой); e – общие дистрофические (метаболические) изменения (показано красной стрелкой). Окраска гематоксилином и эозином. X: 10х10
Гистология ткани печени здоровой крысы показывает сохранность структуры кровеносных сосудов и функциональное состояние печени без признаков венозного полнокровия. Печеночная триада имеет нормальную ситоархитектонику. Гепатоциты имеют овальную форму, ядро круглой формы расположено в центре клетки. Синусоидальные капилляры слегка расширены, пространства Диссе не видны. Количество гепатоцитов велико, очаги некробиоза отсутствуют (рис. 7).
Гистология ткани печени крысы с хронической экспериментальной моделью болезни Крона показывает венозное полнокровие в венозных сосудах, спазм и внутрисосудистый гемостаз в артериальных сосудах. Гистологические препараты показывают дезорганизацию печеночных балок. Наблюдается расширение синусоидальных пространств, что характерно для острых или хронических воспалений. В гепатоцитах присутствуют многочисленные очаги некробиоза. В ядрах клеток наблюдаются процессы кариопикноза, кариорексиса и кариолиза (рис. 8).
В легких здоровой крысы капилляры содержат нормальные клетки крови (эритроциты и лейкоциты). Альвеолы симметричные, в их стенке макрофаги или эпителий не обнаружены (рис. 9).
При исследовании ткани легкого крысы с хронической экспериментальной болезнью Крона был выявлен лизис множества эритроцитов и процессы лейкоцитоза. Альвеолы располагались асимметрично, эпителий на внутренней стенке был передвинут, выявлены эритроциты. Обнаружены признаки отека легкого (рис. 10).
У здоровой крысы кишечник в нормальном состоянии состоит из слизистой и мышечной оболочек. Кишечные ворсинки в норме, гранулемы не видны. Макрофагальная и лимфоцитарная инфильтрация не наблюдается. Состояние распада (эрозии) кишечника не установлено (рис. 11).
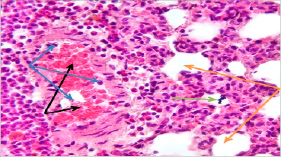
Рис. 9. Гистология ткани легкого здоровой крысы: а – нормальные клетки крови в капиллярах легкого: эритроциты (обозначены черной стрелкой) и лейкоциты (обозначены синей стрелкой); b – альвеолы симметричные, макрофаги или эпителий в стенке не обнаружены; v – артефакт (частицы пыли, попавшие на препарат при подготовке или фотографировании под микроскопом, обозначены зеленой стрелкой). Окраска гематоксилином и эозином. X: 10х40
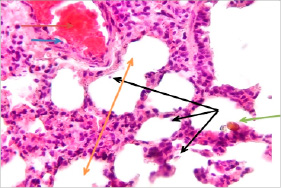
Рис. 10. Гистология ткани легкого больной крысы: а – нормальные клетки крови в капиллярах легкого: лизис множества эритроцитов (обозначено красной стрелкой) и снижение количества лейкоцитов (обозначено синей стрелкой); b – альвеолы асимметричны, десквамация (слущивание) эпителия на внутренней стенке (обозначено черной стрелкой) и обнаружение эритроцитов (обозначено зеленой стрелкой); v – признаки отека легкого (обозначено коричневой стрелкой). Окраска гематоксилином и эозином. X: 10х40
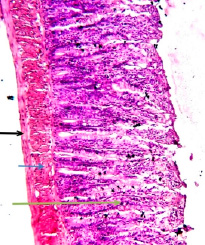
Рис. 11. Гистология кишечника здоровой крысы. Кишечник в нормальном виде: а – слизистая оболочка (черная стрелка); b – мышечный слой (синяя стрелка); v – ворсинки (зеленая стрелка). Красители гематоксилин и эозин. X: 10x10
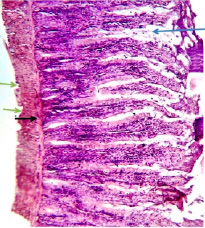
Рис. 12. Гистология кишечника больной крысы: а – макрофагальная и лимфоцитарная инфильтрация подслизистого слоя (обозначено черной стрелкой); b – разрушение ворсинок и образование гранулем (обозначено синей стрелкой); v – эрозия слизистой оболочки кишечника (обозначено зеленой стрелкой). Окраска гематоксилином и эозином. X: 10х10
При исследовании гистологических препаратов кишечника крысы с хронической экспериментальной болезнью Крона была выявлена макрофагальная и лимфоцитарная инфильтрация подслизистого слоя. Ворсинки стенки кишечника разрушены, образованы гранулемы. Обнаружена эрозия слизистой оболочки кишечника (рис. 12).
Заключение
В экспериментальной модели болезни Крона из-за изменений во всасывании пищеварительной системы масса тела уменьшилась в среднем в 2,3 раза. У крыс первой группы, которым была вызвана болезнь Крона, содержание белка в крови по сравнению с показателями у здоровых крыс уменьшилось в 3,4 раза, уровень глюкозы снизился на 44%, а при корректирующем воздействии дигидрокверцетина и тканевых пептидов уровень холестерина увеличился на 13,5%, углеводов на 26,7%, белка на 42,8%.
Модель считалась успешно воспроизведенной, так как у крыс с экспериментальной моделью болезни Крона были обнаружены все гистологические признаки, отсутствующие у здоровых крыс.


 science-review.ru
science-review.ru