Введение
Микропластик, определяемый как пластиковые частицы размером менее 5 мм, стал одной из наиболее актуальных экологических проблем современности [1]. Его повсеместное распространение в окружающей среде, включая водные ресурсы, почву и атмосферу, вызывает серьезные опасения у научного сообщества и общественности. Микропластик образуется в результате деградации крупных пластиковых изделий под воздействием физических, химических и биологических факторов, таких как ультрафиолетовое излучение, механическое истирание и деятельность микроорганизмов. Кроме того, он поступает в окружающую среду в виде первичных микрочастиц, которые изначально имеют небольшой размер и используются в косметике, промышленности и других сферах [2].
Устойчивость пластика к биологическому разложению и его способность накапливаться в экосистемах делают его потенциально опасным для живых организмов, включая человека.
Особую тревогу вызывает способность микропластика проникать в организмы животных и человека через пищевые цепи, воду и воздух [3]. Исследования последних лет показали, что микропластик может накапливаться в тканях и органах, вызывая воспалительные процессы, окислительный стресс и другие негативные последствия [4]. Однако механизмы воздействия микропластика на организм, особенно на репродуктивную систему, остаются недостаточно изученными. Репродуктивная система, являясь одной из наиболее чувствительных к воздействию внешних факторов, может служить индикатором долгосрочных последствий загрязнения окружающей среды [5].
Яичники как ключевой орган репродуктивной системы важны в поддержании фертильности и гормонального баланса. Воздействие микропластика на яичники может привести к нарушению оогенеза, изменению гормонального фона и, как следствие, к снижению репродуктивной функции [6]. При этом размер частиц микропластика может играть критическую роль в их распределении и биологическом воздействии. Частицы разного диаметра могут по-разному проникать в ткани, накапливаться и взаимодействовать с клетками, что требует детального изучения [7].
Изучение распределения микропластика в яичниках крыс позволит не только оценить потенциальные риски для репродуктивного здоровья, но и выявить закономерности накопления частиц в зависимости от их размера.
Цель исследования – в условиях эксперимента провести сравнительную полуколичественную оценку распределения и накопления частиц микропластика различных диаметров (100, 500 и 1000 нм) в яичниках крыс.
Материалы и методы исследования
Экспериментальные животные содержались в стандартных условиях вивария при температуре 20–25°C, с контролируемой влажностью и освещением. Уход за ними осуществляли в соответствии с ГОСТ 33215-2014 и Директивой Европейского парламента и Совета ЕС 2010/63/ЕС от 22.09.2010 о защите животных, используемых в научных целях.
Для эксперимента методом случайной выборки были отобраны 12 самок крыс массой 180–200 г в возрасте 3 месяцев. Животных разделили на 4 группы по 3 особи в каждой и содержали раздельно за 24 часа до начала эксперимента. Первая группа – контрольная группа без введения микропластика («К-»); вторая группа – с введением микропластика размером 100 нм («МП 100»); третья группа – с введением микропластика размером 500 нм («МП 500»); четвертая группа – с введением микропластика размером 1000 нм («МП 1000»). Для идентификации каждой крысы использовались индивидуальные метки на коже хвоста.
В качестве исследуемых материалов применяли микрочастицы полистирола диаметром 0,1 мкм, 0,5 мкм и 1,0 мкм (кат. № 7-3-0010, 7-3-0500, 7-3-0100, QiuHuan, КНР). Частицы были помечены флуоресцентным красителем (пик возбуждения – 488 нм, пик эмиссии – 518 нм) и представлены в виде 1%-ной суспензии в дистиллированной воде. Суспензии были ярко-желтого цвета и не имели запаха.
Контрольным веществом выступал физиологический раствор. Каждый исследуемый продукт высушивали при 37°C до стабилизации массы, после чего готовили суспензию в физиологическом растворе. Для равномерного распределения частиц использовали встряхиватель (вортекс-миницентрифуга BioSan), ультразвуковую ванну УЗО-«МЕДЭЛ» и ротатор BioSan.
В течение 5 часов после введения суспензий микропластика проводили наблюдение за состоянием животных, включая мониторинг их поведения, физиологических реакций и возможных признаков интоксикации. Затем животных умерщвляли методом декапитации. При вскрытии отбирали пробы тканей яичников от каждого животного для последующего анализа. Образцы размером 0,5×0,5×0,5 см³ помещали в криогель.
Криотомию выполняли на микротоме-криостате Leica CM 1520 (Leica BioSystems, Германия). Полученные срезы затем фотографировали при увеличении ×400 с использованием светофильтра EGFP на имиджере Celena X (Logos Biosystems, Южная Корея).
Для полуколичественной оценки накопления микропластика два исследователя анализировали количество флуоресцирующих объектов и тканевых элементов в 90 случайных полях зрения при увеличении ×400. Флуоресцирующие объекты определялись как элементы с четкими контурами и сферической формой, а также их конгломераты. Если контур объекта был нечетким, но наблюдалось свечение, область классифицировали как тканевой элемент. Использовалась ранговая шкала: «0» – отсутствие флуоресценции, «1» – малое количество, «2» – среднее количество, «3» – большое количество флуоресцирующих объектов или тканевых элементов.
Статистический анализ результатов эксперимента выполнен в программе SPSS Statistics. Различия признавали достоверными при уровне значимости p<0,05. Для статистической обработки результатов полуколичественной оценки содержания микропластика в биологических образцах использовали метод Bootstrap с поправкой Холма–Бонферрони.
Результаты исследования и их обсуждение
При полуколичественной оценке накопления микропластика в рамках оценки флюоресцирующих объектов и их конгломератов во внутренних органах контрольных животных и испытуемых животных выявлено, что большое их количество обнаруживается в яичниках.
На рисунке 1 представлены обзорные микрофотографии яичников, окрашенных флюоресцирующей краской, где определяются флюоресцирующие объекты и их конгломераты, что подтверждает накопление микропластика в тканях. На изображениях можно наблюдать различия в интенсивности свечения между контрольной группой и группами, подвергнутыми воздействию МП разных размеров. В контрольной группе флюоресценция практически отсутствует, тогда как в группах «МП 100», «МП 500» и «МП 1000» наблюдается яркое свечение, свидетельствующее о наличии частиц МП. Наиболее визуально интенсивное свечение было зафиксировано в группе «МП 100».
В ткани яичников было обнаружено, что количество флюоресцирующих объектов и их конгломератов статистически значимо отличается у животных, подвергшихся воздействию микропластика размером 100 нм, по сравнению с контрольной группой (р=0,001 для каждой из групп) (рис. 2). Кроме того, были выявлены значимые различия между всеми экспериментальными группами: между «МП 100» и «МП 500» (р=0,001), «МП 100» и «МП 1000» (р=0,001), а также «МП 500» и «МП 1000» (р=0,001). Наибольшее количество флюоресцирующих объектов наблюдалось в группе «МП 100». В то же время различия между группами «МП 500» и «МП 1000» также были значимыми, что подчеркивает влияние размера частиц на их распределение и накопление в репродуктивных органах.
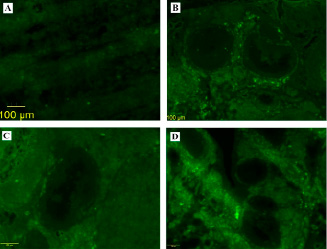
Рис. 1. Микрофотографии яичников крыс, окрашенных флюоресцирующей краской: А – контрольная группа; В – группа «МП 100»; С – группа «МП 500»; D – группа «МП 1000». Увеличение ×400
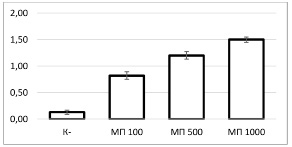
Рис. 2. Количество накопленного микропластика в яичниках крыс по группам
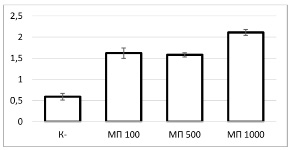
Рис. 3. Интенсивность флюоресценции тканевых элементов в яичниках крыс по группам
В ткани яичников количество флюоресцирующих тканевых элементов статистически значимо отличалось у животных, подвергшихся воздействию микропластика, по сравнению с контрольной группой (р=0,001 для каждой группы) (рис. 3). Это указывает на то, что введение частиц микропластика любого из изученных размеров приводит к их активному накоплению в тканях яичников. При этом между группами «МП 100» и «МП 1000» также были зафиксированы значимые различия (р=0,008), как и между группами «МП 500» и «МП 1000» (р=0,001). Однако между группами «МП 100» и «МП 500» статистически значимых различий выявлено не было (р=0,731), что может свидетельствовать о схожей степени накопления частиц этих размеров в яичниках.
Таким образом, полуколичественная оценка позволила получить углубленное представление о наличии и относительном количестве микропластика в репродуктивных органах лабораторных животных. Результаты демонстрируют, что яичники являются одним из органов, подверженных накоплению микропластика, что подчеркивает потенциальную уязвимость репродуктивной системы к воздействию данного загрязнителя [8]. Полученные данные имеют значимые результаты для понимания механизмов распределения микропластика в организме и его потенциального влияния на репродуктивное здоровье.
В ткани яичников количество флюоресцирующих объектов и их конгломератов статистически значимо отличалось у животных, подвергшихся воздействию микропластика, в сравнении с отрицательным контролем. Это свидетельствует о том, что введение частиц микропластика любого из изученных размеров приводит к их активному накоплению в тканях яичников [9]. Наибольшее количество флюоресцирующих объектов наблюдалось в группе «МП 100», что может быть связано с более высокой способностью наночастиц проникать через клеточные барьеры и накапливаться в тканях [10]. Это согласуется с данными других исследований, которые показывают, что частицы размером менее 1 мкм способны проникать в клетки через рецептор-опосредованный эндоцитоз, тогда как более крупные частицы поглощаются преимущественно посредством фагоцитоза [11].
Статистически значимые различия между группами «МП 100» и «МП 500» (р=0,001), «МП 100» и «МП 1000» (р=0,001), а также «МП 500» и «МП 1000» (р=0,001) указывают на то, что размер частиц микропластика играет ключевую роль в их распределении и накоплении в тканях яичников. При этом между группами «МП 100» и «МП 500» значимых различий не выявлено (р=0,731), что может свидетельствовать о схожей степени накопления частиц этих размеров. В то же время более крупные частицы (1000 нм) демонстрируют иной характер распределения, что подтверждается значимыми различиями с группами «МП 100» и «МП 500». Эти данные подчеркивают, что размер частиц влияет не только на их способность проникать в ткани, но и на механизмы их накопления.
Накопление микропластика в яичниках может быть связано с несколькими факторами. Во-первых, частицы размером менее 1 мкм способны проникать через клеточные барьеры и накапливаться в тканях, что объясняет их высокую концентрацию в яичниках [12]. Во-вторых, образование конгломератов из микрочастиц пластика может затруднять их визуальную идентификацию, а также влиять на их распределение [13]. В-третьих, внутрисердечное введение микропластика привело к их быстрому распределению по кровотоку, что способствовало накоплению в органах, включая яичники [14]. Это подтверждает гипотезу о том, что микропластик может преодолевать биологические барьеры и накапливаться в чувствительных тканях.
Результаты проведенного исследования свидетельствуют о том, что яичники входят в число органов, подверженных накоплению микропластика. Ключевым фактором, влияющим на распределение микрочастиц в организме, является их размер. В частности, частицы диаметром около 100 нм демонстрируют наибольшую способность к проникновению через биологические барьеры и накоплению в тканях, что делает их особенно опасными для репродуктивной системы. Эти данные указывают на необходимость углубленного изучения долгосрочных последствий воздействия микропластика на организм, особенно в контексте его влияния на фертильность и репродуктивное здоровье.
Кроме того, полученные результаты подчеркивают важность разработки стратегий, направленных на снижение воздействия микропластика на живые организмы. Это обусловливает как принятие мер по ограничению загрязнения окружающей среды пластиковыми отходами, так и поиск способов минимизации их проникновения в организм. Понимание механизмов накопления и распределения микропластика, а также его потенциального влияния на клеточные и тканевые структуры является критически важным для оценки рисков для здоровья человека и животных.
Заключение
Яичники входят в число органов, наиболее чувствительных к накоплению микропластика. Размер частиц оказывает существенное влияние на их распределение в тканях, при этом частицы диаметром 100 нм накапливаются в значительно большей степени по сравнению с частицами других размеров.


 science-review.ru
science-review.ru