Введение
Повсеместное применение полимерных материалов в различных сферах человеческой деятельности обусловлено их уникальными свойствами. Эти материалы, включая пластики, резины и композиты, характеризуются легкостью, прочностью и устойчивостью к химическим воздействиям, что делает их незаменимыми в современном мире. Значительный рост мирового производства пластика за последние 70 лет с 1,5 млн т до примерно 359,0 млн т свидетельствует о его широкомасштабном применении в различных отраслях, что подчеркивает его важную роль в современном обществе [1]. Однако вместе с удобством его использования возрастает озабоченность мирового сообщества в связи с воздействием на окружающую среду, в объектах которой идет накопление частиц пластика различных размеров – от макро- до наночастиц. Большая часть пластиковых отходов сжигается, сбрасывается на свалки и выбрасывается в окружающую среду, составляя более 75 % от общей доли отходов, загрязняющих моря и океаны. За последние несколько десятков лет накопление в окружающей среде частиц пластика достигло угрожающих масштабов [2–4]. В результате разложения более крупных полимеров под воздействием факторов окружающей среды возникают риски образования «вторичного» микропластика, частицы которого могут быть поглощены водными организмами [5]. Постепенно микропластик, попадая в пищевую цепь водных организмов и подвергаясь биоаккумуляции в их тканях, поднимается вверх по трофическим уровням. Таким образом, микропластик может оказывать непосредственное воздействие на здоровье человека при употреблении такой пищи.
Изучение токсичности частиц пластика и его способности проникать в различные органы и ткани живых организмов являются весьма актуальными вопросами современной науки. Многочисленными исследованиями показано, что микропластик может проявлять цитотоксичные свойства, которые во многом зависят от формы, размера частиц и их физико-химических свойств [6]. Изучение токсичности микропластика in vitro показало, что воздействие полиэтиленовых микросфер трех разных размеров, 1–10, 50 и 100 мкм, на клеточных культурах линии HeLa было связано с цитотоксичностью, высвобождением провоспалительных цитокинов и гемолизом клеток. Установлено также, что эффект зависел от концентрации и структуры полиэтиленовых микросфер [7].
Цитотоксичность микрочастиц пластика исследовалась с использованием человеческих клеточных линий Caco-2, HepG2 и HepaRG с целью обнаружения возможного воздействия на первые органы, которые вступают в контакт с проглоченными частицами: кишечник и печень. Показано, что частицы размером 1–4 мкм транспортировались через кишечный эпителий in vitro в большей степени, нежели частицы 10–20 мкм. Полученные результаты свидетельствуют о том, что воздействие микрочастиц пластика на кишечник зависит от материала и размера. Также авторами было показано, что только чрезмерно высокие концентрации, выходящие далеко за рамки реального пищевого воздействия, вызывают цитотоксические эффекты [8]. Проведенные исследования также свидетельствуют, что неправильная форма микропластика оказывает значительное биологическое воздействие, что перекликается с зависимостью степени токсичности наночастиц от их физических свойств: известно, что размер и форма, помимо поверхностного заряда и химического состава, имеют большое значение [9].
Исследованием Н.А. Золотовой и соавт. показано, что микрочастицы полистирола диаметром 5 мкм в дозах 0,023–2,3 мг/кг/сут при воздействии в течение 4 недель вызывают адаптивные морфофункциональные изменения в толстой кишке и селезенке у мышей. В том же исследовании не было выявлено патологических изменений в печени, почках, легких, тимусе, брыжеечных лимфатических узлах, головном мозге, сердце, семенниках и мышце бедра мышей при воздействии разных доз частиц полистирола диаметром 5 мкм [10].
В исследовании на 8-недельных крысах-самцах линии Sprague Dawley, массой тела 150–180 г на начало эксперимента, животным внутрижелудочно вводили полиэтиленовые микрочастицы пластика со средним размером частиц от 4,0 до 6,0 мкм в течение 35 дней ежедневно. Разовые дозы микрочастиц были равны 3,75; 15 и 60 мг/кг массы тела. В качестве носителя выступало кукурузное масло. Частицы были неправильной фрагментированной формы с острыми краями, что было выявлено методом сканирующей электронной микроскопии. Обнаружено, что все исследуемые дозы микрочастиц индуцировали истощение антиоксидантной системы, выраженное в снижении содержания супероксиддисмутазы и активности сывороточного глутатиона, усиление перекисного окисления липидов. В группах, подвергнутых воздействию микрочастиц в дозах 15 и 60 мг/кг массы тела, статистически значимо увеличилось число аномальных эритроцитов. Также установлено дозозависимое генотоксическое воздействие частиц на ДНК. Масса тела животных увеличивалась в группах, подвергавшихся воздействию в дозах 15 и 60 г/кг массы тела, в то время как в группе 3,75 мг/кг массы тела она оставалась на уровне контрольных значений [11].
Существует мнение, что идеальным биологическим объектом для проверки наличия микрочастиц пластика является кровь, потому что она забирается непосредственно из организма и не вступает в контакт с какими-либо пластиками – в особенности, если исследователи используют стальные иглы шприцев и стеклянную лабораторную посуду, чтобы избежать загрязнения. В исследовании H.A. Leslie и соавт. по определению и количественной оценке загрязнения крови человека пластиковыми частицами при использовании медицинских изделий из различных видов полимеров для взятия донорской крови показано, что пластиковые частицы биодоступны для поглощения в кровоток человека [12].
Несмотря на разнообразие проведенных исследований in vitro и in vivo, они не в полной мере отражают потенциальные риски неблагоприятного воздействия микрочастиц пластика на здоровье человека. Для объективной оценки существующих рисков негативного воздействия пластика на биологические объекты необходимо продолжение исследований по изучению патогенетических механизмов его воздействия на клеточных и животных экспериментальных моделях, а также его токсичности и условий накопления в различных органах и тканях.
Цель исследования – провести количественную оценку накопления микрочастиц пластика размером 500 нм в почках крыс после однократного введения.
Материалы и методы исследования
Исследование проведено на крысах-самках линии Wistar весом 180–200 г. Трем животным (опыт) внутрисердечно в объеме 0,5 мл вводили 1 % суспензию в дистиллированной воде меченных флуоресцентным красителем микрочастиц сферической формы полистирола (далее – МП) диаметром 500 нм. Другим трем крысам (контроль) аналогично вводили дистиллированную воду. МП предварительно «разбивали» в ультразвуковой ванне УЗО-«МЕДЭЛ» и ротаторе BioSan. Контроль состояния вводимой суспензии проводили в имиджере Celena X со светофильтром EGFP (Logos Biosystems, Южная Корея). Через 5 ч после введения осуществляли вскрытие эвтаназированных крыс и отбор образцов тканей почек в криогель. Криотомию производили на микротоме-криостате Leica СМ 1520 (Leica BioSystems, Германия), делая срезы толщиной 10 мкм, по 4 среза от каждого животного из разных фрагментов органа. Фотографировали срезы на предметном стекле при увеличении 200х и светофильтром EGFP в имиджере Celena X (Logos Biosystems, Южная Корея).
Количественную оценку микрочастиц пластика и их конгломератов в почках осуществляли с применением специально разработанной программы Microplastic detector [13]. Программное обеспечение было разработано на языке Python 3.10 с использованием библиотек OpenCV (для обработки изображений) и NumPy (для численных вычислений), результаты анализа выводились в виде таблицы Microsoft Excel. Статистическая обработка результатов осуществлялась с использованием метода Bootstrap с поправкой Холма – Бонферрони, языке Python 3.10. Различия признавали значимыми при р < 0,05. Данный подход позволил снизить влияние ограниченного размера выборки, обеспечивая при этом строгие критерии статистической значимости [14].
Результаты исследования и их обсуждение
На рис. 1 представлены микрофотографии срезов почек крыс контрольной группы. При анализе нескольких полей зрения у контрольных животных визуализировалась умеренная и равномерная флуоресценция с небольшим числом артефактов со слабой интенсивностью свечения (рис. 1, А, желтые стрелки). Желтые стрелки на рисунке указывают на аутофлуоресценцию тканей, которая наблюдается даже в отсутствие внешних флуорофоров. Это явление характерно для многих биологических структур, в том числе коллагена, эластина, липофусцина, и служит естественным «шумом», неминуемо сопровождающим флуоресцентную микроскопию. Важно отметить, что аутофлуоресценция не является артефактом и она отражает естественную метаболическую активность тканей.
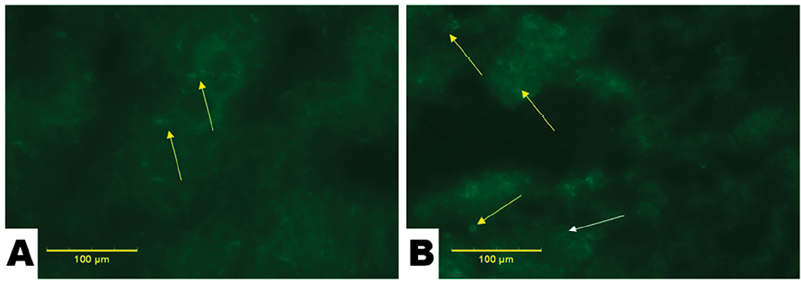
Рис. 1. Микрофотографии почек крыс, окрашенных флуоресцирующей краской после введения микропластика: А – контроль (после введения дистиллированной воды), В – опыт (после введения флуоресцентных микрочастиц). Желтые стрелки указывают на аутофлуоресценцию тканей, белые – на частицы микропластика
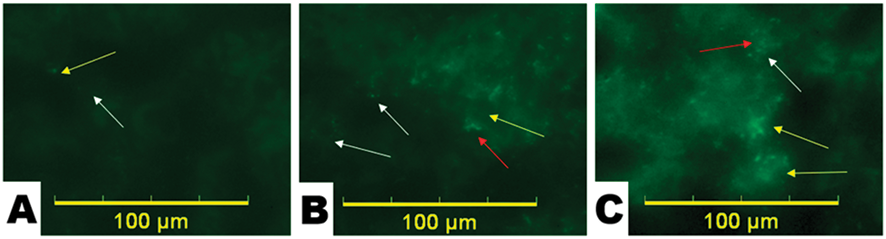
Рис. 2. Микрофотографии разных полей зрения почек крыс опытной группы, окрашенных флуоресцирующей краской после введения микропластика – мозговой (А) и корковый (С, В) слои. Желтые стрелки указывают на аутофлуоресценцию тканей, белые – на частицы микропластика, красные – на их конгломераты
Вместе с тем в почках опытных крыс встречались флуоресцирующие объекты сферической формы, отличные по своим размеру, форме и интенсивности свечения от фрагментов аутофлуоресценции тканей (рис. 1, В, белая стрелка).
На рис. 2 представлены микрофотографии нескольких полей зрения срезов почек крыс только опытной группы.
Частицы и их конгломераты локализуются неравномерно, а интенсивность аутофлуоресценции варьирует в зависимости от тканевого фрагмента – в мозговом слое она слабее, в отличие от коркового, что связано со структурно-функциональными особенностями органа. В связи с этим очевидна сложность визуальной оценки и дифференцировки флуоресцентных фрагментов: даже в присутствии МП сохраняется фоновая аутофлуоресценция (желтые стрелки). Более полное представление о распределении и накоплении частиц МП в почках может дать только сравнительная количественная оценка.
Количественные методы играют ключевую роль в экспериментальных исследованиях, обеспечивая высокую точность и воспроизводимость результатов. Их применение позволяет минимизировать субъективность интерпретации данных, что особенно важно при изучении воздействия антропогенных факторов, таких как микрочастицы пластика (МП), на биологические системы. Использование специально разработанной программы метода количественной оценки содержания МП в почках крыс позволило получить статистически значимые данные, подтверждающие их накопление в органе (таблица). Сравнение между опытной и контрольной группами было проведено на основе строгих метрических критериев, таких как количество и плотность микрочастиц, а также площадь и плотность их конгломератов. В результате были установлены статистически значимые различия (p < 0,05) между группами по всем изучаемым параметрам, что свидетельствует о значимом накоплении микрочастиц пластика в почках крыс даже при однократном воздействии.
Результаты количественной оценки содержания микрочастиц пластика в почках животных
|
Параметр |
Контроль |
Опыт |
Уровень значимости, р |
|
Количество визуализированных микрочастиц в почках, ед. на микропрепарат |
6,58±0,10 |
2088,67±562,31 |
0,0008 |
|
Плотность микрочастиц в почках на изображении размером 1000x1000 пикс. |
0,08±0,02 |
26,01±6,20 |
0,0001 |
|
Площадь конгломератов микрочастиц в почках на микропрепарат, µm^2 |
1290,04±357,77 |
88245,79±27878,82 |
0,0090 |
|
Плотность конгломератов микрочастиц в почках на изображении размером 1000x1000 пикс. |
1,42±0,42 |
60,33±16,74 |
0,0018 |
Применение стандартизированных протоколов измерения, включающих подсчет частиц на единицу площади гистологического среза, является критически важным для обеспечения сопоставимости полученных данных с результатами других исследований. В настоящей работе усреднение показателей по 12 микропрепаратам позволило минимизировать вариабельность, обусловленную индивидуальными различиями биологических образцов, что повышает достоверность статистического анализа.
Проведенное исследование выявило способность микропластических (МП) частиц проникать в почечную ткань и накапливаться в ней с образованием конгломератов. Механизм их агрегации может быть связан как с физической адсорбцией и простой коалесценцией частиц, так и с их взаимодействием с компонентами внеклеточного матрикса или клеточными мембранами. Об этом свидетельствует достоверное увеличение как общей площади конгломератов, так и количества отдельных частиц в опытной группе по сравнению с контролем. Полученные данные указывают на персистенцию МП в почечной паренхиме, причем их распределение носит гетерогенный характер с тенденцией к локальной аккумуляции в определенных зонах органа.
Эти результаты согласуются с современными литературными данными, демонстрирующими способность нано- и микропластиков преодолевать гистогематические барьеры и депонироваться в паренхиматозных органах [14]. Наблюдаемый феномен кумуляции МП в почках имеет значимые токсикологические последствия, поскольку длительная персистенция чужеродных частиц может приводить к механическому повреждению тканей, индукции окислительного стресса и нарушению клеточных функций. Полученные данные подчеркивают необходимость дальнейших исследований, направленных на изучение токсикокинетики МП, включая их биораспределение, элиминацию и потенциальное влияние на гистологическую архитектонику почечной ткани при хронической экспозиции.
Следует отметить, что аутофлуоресценция биологических структур способна искусственно увеличивать площадь детектируемых конгломератов, особенно при использовании флуоресцентной микроскопии. Аутофлуоресценция может влиять на оценку площади конгломератов, особенно при ручном визуальном анализе, в то время как применение данного количественного подхода в рамках разработанного нами программного обеспечения учитывает пороговую интенсивность сигнала, минимизируя вклад фонового свечения. В контрольной группе значения всех параметров (таблица) статистически значимо ниже, чем в опыте (p < 0,05), что исключает случайные ошибки.
Заключение
Применение количественных методов позволило не только подтвердить факт накопления микрочастиц пластика в почках крыс, но и установить конкретные параметры их распределения. Результаты проведенной количественной оценки содержания частиц МП размером 500 нм в почках крыс свидетельствуют, что он способен проникать и накапливаться в органе даже при однократном поступлении.


 science-review.ru
science-review.ru