Введение
Плазмиды являются незаменимым инструментом в генной инженерии и синтетической биологии [1]. Их применение в качестве научных инструментов существенно ускорило прогресс во многих областях. Разнообразие и многофункциональность плазмид позволяют исследователям решать широкий спектр задач [2, с. 7]. Например, плазмидные векторы используются для клонирования и экспрессии генов, создания генетически модифицированных организмов, при производстве рекомбинантных белков для медицинских и промышленных целей.
Плазмиды, приспособленные или искусственно созданные для нужд ученых, принято называть плазмидными векторами. От обычных плазмид их отличает универсальность применения и наличие элементов, отобранных по каким-либо критериям для использования этих векторов в исследовательских или терапевтических целях [3]. Чтобы из плазмиды получился действующий и эффективный вектор, она должна обладать некоторыми характеристиками и элементами [4]. Векторы наиболее часто применяют для получения рекомбинантных белков, а также для придания клеткам каких-либо уникальных свойств.
В последние десятилетия исследования в области плазмидных векторов направлены на повышение эффективности и безопасности их действия, в том числе для возможного терапевтического применения.
В настоящее время на рынке представлено множество коммерческих плазмидных векторов для разнообразных целей. Выбор вектора для экспрессии целевого гена при этом зависит от клеток, в которые вектор будет трансфицироваться, уровня экспрессии целевого гена и стабильности конструкции.
В плазмидах присутствуют гены, кодирующие белки, необходимые для конъюгации (tra-гены), сайты посадки рибосом, системы для обеспечения наследования в плазмидах и многие другие компоненты [5]. Вариативно в плазмиды могут быть добавлены различные необязательные для жизнеспособности или экспрессии элементы, которые помогают достигать поставленной экспериментальной цели. Такими элементами могут быть, например, индукторы, операторы или теговые последовательности. При этом есть минимальный набор элементов, которые должны присутствовать в плазмиде для поддержания ее существования в клетке и экспрессии целевого белка.
В клетках плазмиды существуют во множестве копий, постоянно реплицируясь для избегания деградации. Процесс репликации ДНК начинается в стартовой точке, которая называется ориджин репликации (ori). Ориджин репликации регулирует количество плазмидных копий внутри клетки-хозяина. Структура ориджина уникальна и позволяет обеспечивать видовую специфичность и совместимость с конкретным типом клеток.
Бактериальные плазмиды помещают в клетки посредством трансформации, эффективность которой зависит от многих факторов. Чтобы провести селекцию колоний, используют определенный маркер, ген которого должен присутствовать в плазмидной ДНК. Наиболее часто для этих целей используют гены, вызывающие устойчивость к антибиотикам у бактерий. Механизм селекции основан на выживании клеток, в которые трансформировалась плазмида с геном устойчивости, в среде с антибиотиком. Нетрансформированные клетки при этом не выживают в селективной среде.
Использование генов антибиотикорезистентности в плазмидных векторах для отбора трансформированных клеток остается актуальной проблемой в медицинской биотехнологии [6]. Риск связан с возможным распространением этих генов в окружающей среде, что может способствовать горизонтальному переносу генов устойчивости к патогенным или условно-патогенным бактериям. Кроме того, гены устойчивости к антибиотикам вносят существенный вклад в увеличение размера вектора [7]. Все эти факторы обуславливают необходимость разработки систем селекции без применения антибиотикорезистентных маркеров.
Для экспрессии рекомбинантного белка в плазмиду необходимо добавить ген, кодирующий целевой белок. Для удобства клонирования в векторах присутствует полилинкер (multiple cloning site, MCS) – участок с набором разнообразных рестрикционных сайтов. При конструировании вектора сайты рестрикции в MCS должны соответствовать сайтам, фланкирующим целевой ген, что обеспечивает правильное встраивание фрагмента.
Перед MCS находится промотор, контролирующий инициацию транскрипции гена. Он служит местом связывания РНК-полимеразы. Различные промоторы обеспечивают различный уровень экспрессии гена. Также промоторы могут быть конститутивными, индуцибельными или тканеспецифическими. Выбор промотора зависит от желаемого уровня экспрессии целевого гена.
В векторе обычно присутствуют элементы для процессинга РНК, последовательность Козака, терминатор трансляции, сайты сплайсинга РНК при необходимости. После вставки целевого гена обычно располагается терминатор транскрипции, который служит для сигнализации о завершении процесса транскрипции [8; 9]. Наглядно обобщенная структура плазмиды показана на рис. 1.
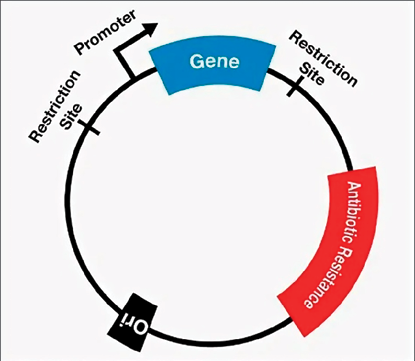
Рис. 1. Обобщенная структура плазмиды Источник: составлено авторами по [8]
Цель исследования – создание вектора для экспрессии в прокариотических клетках, обладающего минималистичным дизайном и методом селекции, основанным на элементах транспозона Tn10 RNA-IN и RNA-OUT.
Материалы и методы исследования
Для обеспечения стабильной саморепликации вектору необходим ориджин, а для экспрессии гена, клонированного в вектор, – промотор, терминатор транскрипции и полилинкер [10; 11]. Также нужен маркер селекции. Эти компоненты являются основными для использования плазмидного вектора при получении рекомбинантных белков [12]. В качестве маркера селекции были использованы участки транспозона Tn10 и мутантный ген pheS.
Исследования выявили фенилаланиновую (Phe) специфичность фенилаланил-тРНК-синтетазы (PheRS) из E. coli [13]. Модель связывания с субстратом предсказала, что замена Ala294 α субъединицы PheRS на меньший остаток Gly приводит к получению фермента со сниженной специфичностью к субстрату. Gly294 PheRS способна ферментировать производные Phe с объемными p-заместителями, такие как p-Cl-Phe и p-бромфенилаланин. Включение в метаболизм p-Cl-Phe с помощью ферментов приводит к включению аминокислот в клеточный белок [13]. В присутствии p-Cl-Phe ген pheS является доминантным и летальным, если только он не будет инактивирован каким-либо путем.
Транспозон Tn10 кодирует 69-нуклеотидную РНК (RNA-OUT), которая регулирует экспрессию транспозазы путем спаривания с мРНК транспозазы (RNA-IN). Это спаривание регулирует трансляцию транспозазы, изолируя 5’-участок инициации трансляции (TIR) от рибосомы, тем самым ограничивая трансляцию транспозазы в клетках E. coli [14]. Эту систему можно воссоздать, используя способность блокирования трансляции других генов. В результате наличие элемента RNA-IN в клетках перед экспрессируемым геном (в данном случае pheS*) в паре с RNA-OUT, расположенным в векторе, может заблокировать экспрессию этого гена. Тогда клетки с мутантным генотипом и успешно прошедшей трансформацией смогут вырасти на селективной среде с добавлением 4-хлор-фенилаланина. Эти компоненты являются основой данной системы селекции без использования антибиотиков.
Для правильной работы данного вектора необходимы клетки с модифицированным геномом. В них необходимо внести точечную мутацию гена pheS для обеспечения субстратного связывания, а также добавление последовательности RNA-IN перед промотором, инициирующим экспрессию данного гена.
Необходимые элементы конструкции:
1) prom – промоторная область гена человеческого фактора элонгации EF1A. Служит для обеспечения высокого уровня транскрипции рекомбинантных генов в большинстве тканей человека. Получен из коммерческого вектора pLV (Addgene, США);
2) MCS (Multiple cloning site) – полилинкер (сайт множественного клонирования), содержащий последовательно сайты рестрикции Eco53kI, SacI, AvaI, SmaI, BamHI, XbaI, Sall, SphI, HindIII и предназначенный для клонирования целевых генов, получен из коммерческого вектора pUC19 (Addgene, США);
3) RNA-out – регуляторный элемент РНК-out транспозона Т10, обеспечивающий возможность положительной селекции без использования антибиотиков при использовании модифицированного штамма E. coli DH5α;
4) ori – ориджин репликации pUCori, служащий для автономной репликации с однонуклеотидной заменой для повышения копийности плазмиды в клетках большинства штаммов E. coli. Получен из коммерческого вектора pUC19 (Addgene, США);
5) term – терминатор транскрипции BGH pA, получен из коммерческого вектора pSecTAG2 C (Invitrogen, США).
Элементы вектора амплифицированы и сшиты между собой с помощью ПЦР. Полимеразную цепную реакцию проводили в реакционной смеси объемом 30 мкл, содержащей 0,7 мкл (1 ед.) Tersus ДНК-полимеразы (Евроген, Россия), 3 мкл буфера для Tersus ДНК-полимеразы (20 мМ Tris-HCl (pH 8,8), 10 мМ (NH4)2SO4, 10 мМ KCl, 2 мМ MgCl₂, 0,1% Tween-20, 1 М бетаин, 0,1 мг/мл BSA), 1,5 мкл (2,5 мМ) смеси дезоксинуклеозидтрифосфатов (dNTP), по 0,3 мкл 100 мкМ олигонуклеотидов F1 и R1. Объем реакции доводили до 30 мкл деионизированной водой. Амплификацию проводили при следующем режиме: 1 цикл: денатурация +95 °С – 3 мин; 24 цикла: денатурация +95 °С – 20 с, отжиг праймеров (Тотж = 64°C) – 50 с, полимеризация при +72°С – 1 мин.
Полученный вектор в линейной форме лигирован в коммерческий вектор pAL2-T (Евроген, Россия) для выявления клонов, содержащих нуклеотидную последовательность без качественных мутаций по стандартной методике для коммерческого вектора. Вектор трансформировали в химически компетентные клетки E. coli штамма ТОР-10. Секвенирование проводили по методу Сенгера. Секвенирующую реакцию выполняли с использованием реакционной смеси в соответствии с протоколом фирмы-изготовителя (Applied Biosystems, США). Электрофоретическое разделение продуктов секвенирующей реакции – с помощью автоматического 24-капиллярного генетического анализатора Applied Biosystems 3500XL. Затем с отобранной после секвенирования плазмидой проводили реакцию рестрикции по стандартному протоколу для рестриктазы BamHI (Fermentas, США). Вектор лигировали на себя и готовили к тестированию в клетках E. coli, содержащих элемент транспозона Tn-10 и мутантный ген pheS.
Результаты исследования и их обсуждение
Было установлено [9], что размер плазмидной ДНК влияет на эффективность трансфекции. Компактные плазмиды демонстрировали более высокую трансфекционную активность по сравнению с крупными. Также размер влияет на диффузию ДНК в цитоплазме клеток, молекулы длиной свыше 2000 п.н. практически неподвижны. При этом в ядре ДНК всех размеров остается неподвижной [9]. Замедление диффузии может быть обусловлено связыванием с элементами цитоскелета, а также эффектами молекулярной перегрузки и взаимодействий при столкновениях. Проникновение ДНК через ядерные поры также зависит от размера. Доказано [10], что мини-кольцевые ДНК длиной 2900 п.н. трансфицируют клетки в 77 раз эффективнее, чем плазмиды размером 52 500 п.н. Более того, при изучении влияния размера вектора на активность промоторов [11] было выявлено, что снижение экспрессии происходит пропорционально увеличению длины вектора. Таким образом, уменьшение размера плазмидного вектора существенно повышает эффективность доставки целевого гена.
Изучение возможностей применения небольших векторов и мини-кольцевых ДНК несет в себе большой потенциал. Мини-кольцевые ДНК – это экспрессионные кассеты, генерируемые сайт-специфической рекомбинацией. Они лишены прокариотических последовательностей: ori и генов резистентности, которые удаляются в процессе создания мини-колец. Хотя этим конструкциям на некоторых этапах необходимы антибиотики для отбора, такие конструкции демонстрируют повышенную эффективность трансфекции и экспрессии благодаря компактности [12]. Однако их производство требует дорогостоящей хроматографии, что увеличивает себестоимость по сравнению с традиционной ферментацией. Вероятно, наиболее эффективной стратегией является создание стандартных векторов небольшого размера, которые обладали бы только необходимыми для поддержания жизнедеятельности плазмиды и экспрессии генов элементами.
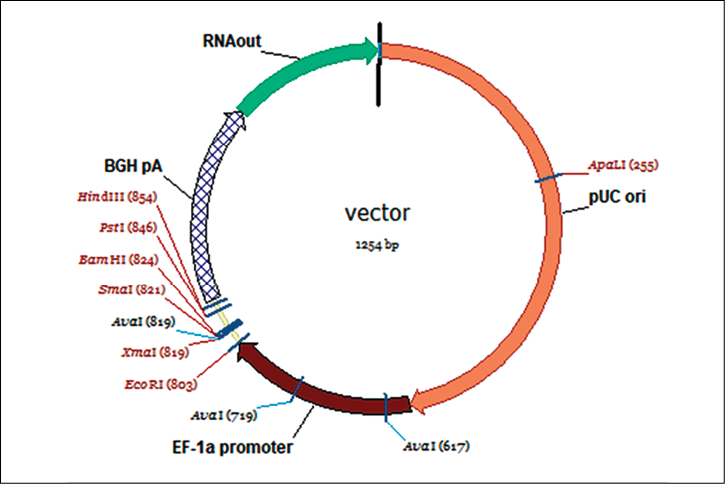
Рис. 2. Схема вектора с минимальным набором элементов Источник: составлено авторами
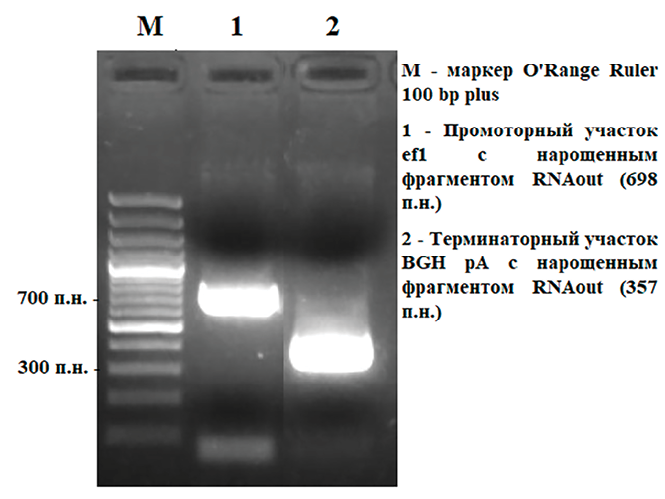

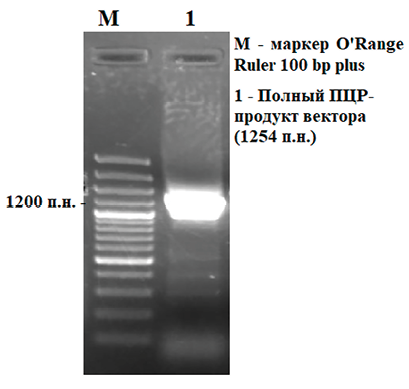
Рис. 3. Этапы сшивки элементов вектора Источник: составлено авторами
Таким образом, для наиболее эффективной работы плазмидного вектора желательно обеспечить их компактный размер до включения целевого гена. Также для повышения стабильности конструкции необходимо избегать токсичных для клеток элементов или последовательностей, в том числе элементов вирусных геномов. А маркер антибиотикорезистентности желательно заменить другим маркером селекции. При выборе вектора стоит помнить о том, что успех эксперимента во многом зависит от правильного и рационального дизайна плазмиды.
В программе VectorNTI была собрана конструкция вектора с минимальным набором компонентов (рис. 2). Также были подобраны праймеры для ПЦР-амплификации компонентов вектора, его сборки и секвенирования.
После разработки конструкции вектора получали необходимые для его сборки ПЦР-продукты. Элементы вектора из коммерческих плазмид получали путем ПЦР-амплификации, где векторы использовались в качестве матриц.
Далее сборка вектора осуществлялась посредством нескольких сшивок (рис. 3). Целью синтеза был вектор в линейной форме, который затем лигировали в клонирующий вектор pAL2-T для выявления правильно собранных клонов, не содержащих мутаций.
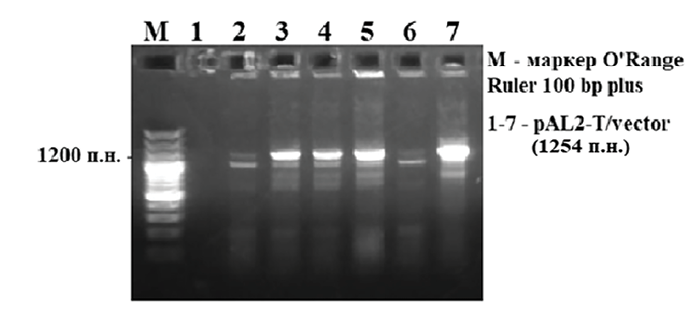
Рис. 4. Скрининг колоний, несущих вставку pAL2-T/vector Источник: составлено авторами

Рис. 5. Электрофорез продуктов рестрикции pAL2-T/vector Источник: составлено авторами
ПЦР-продукт размером 1254 п.н. далее был залигирован в клонирующий вектор pAL2-T (Евроген, Россия) с последующей трансформацией в клетки E. coli. Клеточная суспензия после трансформации втиралась в чашку с агаризованной средой LB, ампициллином (100 мкг/мл), S-Gal и индуктором IPTG. Чашки Петри инкубировали в термостате при 37 °С в течение 16 ч. Далее, для отбора клонов, несущих вставку нужного размера, проводили скрининг с праймерами T7 и Sp6 (рис. 4).
Последовательность вставки отобранных клонов была определена с помощью секвенирования по Сэнгеру, в котором также была использована пара праймеров T7 и Sp6. Вектор, несущий вставку без мутаций, был обработан рестриктазами по сайту рестрикции BamHI (рис. 5). Два одинаковых сайта рестрикции из полилинкера в линеаризированном векторе были расположены на его 5’- и 3’-концах таким образом, чтобы затем обработанный рестриктазами вектор можно было лигировать на него же самого.
После обработки рестриктазой и проведения электрофореза продукт рестрикции выделяли из геля. С ним проводили лигирование для образования кольцевой молекулы. Так как вектор не имеет никаких самостоятельных элементов для селекции, отобрать единичные колонии при высеве на чашку без антибиотиков было бы затруднительно. Рационально трансформировать его сразу в клетки с модифицированным геномом для тестирования разработанной системы и получения кольцевого варианта синтезированного вектора. Таким образом, при подготовке специализированных клеток тестирование данного вектора не представляет труда.
Заключение
Эффективность трансфекции генов значительно зависит от конструкции экспрессионного вектора. На этапе разработки плазмиды необходимо проводить тщательный анализ эукариотических последовательностей и оптимизировать расположение прокариотических элементов в векторе. Так как потенциально проблемные последовательности (например, нежелательные сайты рестрикции) возможно определить заранее, необходимым этапом является анализ последовательности для исключения функционально дестабилизирующих участков.
В контексте функциональности плазмид ключевым аспектом является минимизация последовательностей, включая сокращение или полное удаление селективных маркеров. Это существенно улучшает эффективность трансфекции. «Идеальный» вектор должен обладать небольшим размером, содержать лишь необходимые для репликации элементы и исключать последовательности, нарушающие экспрессию целевого гена.
Для повышения эффективности систем доставки ДНК в клетки необходимо решать множество различных задач, таких как разработка методов увеличения копийности плазмид без модификации их основной структуры и поиск стратегий селекции без использования антибиотиков.
Преимущества минималистичных бактериальных векторов должны стимулировать их внедрение в повсеместную практику, особенно из-за возможных регуляторных ограничений на применение генов антибиотикорезистентности в генно-терапевтических препаратах.


 science-review.ru
science-review.ru