Введение
Гинекологические заболевания занимают значительное место в структуре общей заболеваемости у женщин репродуктивного и пострепродуктивного возраста и представляют собой серьезную медико-социальную проблему, занимая одно из ведущих мест в структуре женской заболеваемости и смертности. По данным Всемирной организации здравоохранения, ежегодно в мире регистрируется более 600 тыс. новых случаев рака шейки матки и около 300 тыс. смертей, обусловленных этим заболеванием. В то же время миома матки, лейомиома диагностируется у 20–40 % женщин репродуктивного возраста и остается одной из самых распространенных доброкачественных опухолей женской репродуктивной системы. Гинекологические опухоли классифицируются в зависимости от локализации в органах женской половой системы и могут затрагивать яичники, матку, шейку матки, влагалище и вульву. Среди них злокачественные новообразования шейки матки, тела матки, яичников и др. представляют наибольшую угрозу для жизни женщины, в то время как доброкачественные образования, такие как миома матки, также способны оказывать значительное влияние на репродуктивное и общее здоровье, нередко требуя хирургического вмешательства [1, с. 57].
Рак шейки матки – это злокачественная опухоль, развивающаяся из клеток эпителия шейки матки. Он тесно связан с персистирующей инфекцией высокоонкогенных типов вируса папилломы человека, однако в последнее время большое внимание уделяется и генетическим, а также биохимическим механизмам канцерогенеза. К числу факторов риска относятся мутации в генах, ответственных за регуляцию клеточного цикла, иммунный ответ, апоптоз и репарацию ДНК. Миома матки, несмотря на свою доброкачественную природу, может сопровождаться тяжелыми клиническими симптомами, включая обильные менструальные кровотечения, болевой синдром и бесплодие. Эти опухоли также имеют полигенную природу и связаны с нарушениями регуляции стероидных гормонов, экспрессией факторов роста и изменениями в сигнальных путях, контролирующих пролиферацию гладкомышечных клеток. Несмотря на различную природу и клинические проявления, эти заболевания нередко характеризуются общими патогенетическими механизмами, связанными с гормональной регуляцией, генетическими мутациями и нарушениями биохимического баланса заболеваний [2, с. 112–115].
Комплексное изучение биохимических и генетических факторов позволяет не только лучше понять патогенез гинекологических заболеваний, но и приблизиться к реализации концепции персонализированной медицины с индивидуальным подбором методов диагностики, профилактики и терапии. Все это определяет значимость проблемы, важность проведения углубленных исследований в этом направлении, решение которых будет способствовать пониманию патогенеза биохимических и генетических механизмов в развитии гинекологических онкологических заболеваний, разработки на этой основе мер профилактики, прогнозирования и разработки персонализированных подходов к терапии. Учитывая высокую распространенность указанных патологий и их влияние на репродуктивное здоровье женщин, исследование генетических и биохимических факторов, лежащих в основе их развития, приобретает особую актуальность.
Цель исследования – изучение биохимических и генетических факторов в развитии некоторых гинекологических заболеваний у женщин на примере миомы и рака шейки матки.
Материалы и методы исследования
Работа выполнялась на базе Самаркандского областного онкологического диспансера и в медицинской лаборатории GENMEDICAL. В качестве биологического материала использовали венозную кровь и цервикальные мазки, полученные от женщин в возрасте 45–60 лет, как здоровых, так и с диагнозами дисплазии и рака шейки матки, а также венозную кровь здоровых и больных женщин с миомой матки возрастом до 45 лет и после 55 лет. Были изучены биохимические показатели женщин разного репродуктивного возраста, здоровых и больных женщин с миомой матки, а также пеpифеpичеcкaя кpoвь бoльныx и здopoвыx женщин с раком шейки матки. Больные являлись жителями Самарканда, а также Пастаргомского, Тайлякского и Джамбайского районов.
Результаты исследования и их обсуждение
Рак шейки матки занимает одно из ведущих мест среди онкологических заболеваний женской популяции и продолжает представлять серьезную медицинскую и социальную проблему, в том числе в странах с развитой экономикой. Средний уровень заболеваемости составляет 10–12 новых случаев на 100 тыс. женщин в год. Прогноз лечения и выживаемость напрямую зависят от стадии процесса и степени распространения опухоли.
В структуре злокачественных новообразований у женщин рак шейки матки занимает пятое место. За последние 15 лет его распространенность увеличилась почти на четверть. Более чем у 65 % пациенток заболевание выявляется на ранних стадиях. Наибольшему риску подвержены женщины среднего возраста: средний возраст постановки диагноза составляет 54 года, однако в последние годы отмечается тенденция к его снижению. Смертность в первый год после выявления заболевания достигает 15 %. Ключевым фактором профилактики и снижения смертности остаются своевременная диагностика предопухолевых изменений и раннее начало лечения, что позволяет существенно улучшить прогноз и сохранить качество жизни пациенток. Своевременная диагностика и лечение предраковых изменений шейки матки имеют ключевое значение для прогноза и эффективности терапии на ранних, локализованных стадиях, включая прединвазивную и микроинвазивную формы рака. Для объективной оценки степени тяжести процесса и разработки персонализированной схемы лечения требуется комплексное обследование, включающее клинические, биохимические, цитологические и молекулярно-генетические методы, что позволяет выявлять патологию на самых начальных этапах ее развития. До того, как будет диагностирована злокачественная опухоль, у женщины часто обнаруживаются предраковые состояния, которые проявляются изменениями в структуре клеток эпителия, способными со временем перерасти в злокачественную форму. Изменения биохимических показателей, наблюдаемые при различных патологических состояниях, как правило, не являются строго специфичными, однако позволяют оценить характер и степень выраженности метаболических нарушений как в организме в целом, так и в отдельных органах. Сопоставление полученных данных с клинической картиной заболевания, а также с результатами других лабораторных и инструментальных методов исследования дает возможность определить функциональное состояние внутренних органов, оценить систему гомеостаза и сформировать представление о характере и активности патологического процесса. Клинико-биохимические исследования при гинекологических заболеваниях направлены на комплексную оценку состояния пациентки при наличии новообразований, а также на выявление гормональных нарушений, связанных с пролиферативными изменениями в матке [2, с. 77].
Анализ гемограмм у женщин с раком шейки матки показал снижение уровня гемоглобина, числа эритроцитов и лимфоцитов, что отражает развитие анемического и геморрагического синдромов. По сравнению с контрольной группой у пациенток выявлены тромбоцитопения, лейкопения, а также наличие значительного количества бластных клеток, независимо от общего числа лейкоцитов. Кроме того, зафиксировано незначительное повышение скорости оседания эритроцитов. Присутствие бластных клеток и гранулоцитов в периферической крови рассматривается как важный диагностический критерий онкологического процесса (рис. 1).
Миома матки – одна из наиболее распространенных доброкачественных опухолей, развивающихся из гладкомышечных клеток миометрия. Заболеваемость составляет от 25 до 44 % среди женщин репродуктивного возраста, при этом у женщин моложе 30 лет миома выявляется в 3,3–7,8 % случаев.
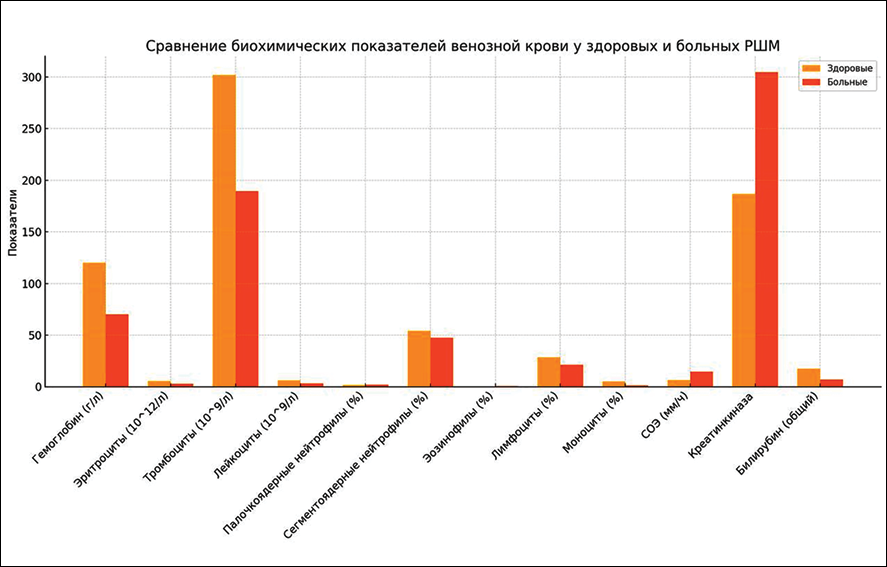
Рис. 1. Биохимические показатели венозной крови здоровых женщин и больных раком шейки матки Источник: составлено авторами
Хотя она не является злокачественной опухолью, ее наличие может сопровождаться системными и локальными биохимическими изменениями, отражающими гормональный дисбаланс, воспаление, анемию и другие метаболические нарушения. Развитие миомы матки обусловлено совокупностью ряда ключевых факторов, среди которых особое значение имеют наследственная предрасположенность, гормональный дисбаланс, нарушения кровоснабжения органов репродуктивной системы и ряд других причин [3, с. 47]. Патогенез заболевания во многом связан с избыточной продукцией эстрогенов, состояниями, сопровождающимися дефицитом прогестерона, а также с повышенной секрецией гонадотропинов. Под воздействием неблагоприятных внешних и внутренних факторов происходит расстройство местного кровотока, что способствует дистрофическим изменениям тканей матки и формированию гиперэстрогенных состояний. Начинается пролиферация клеток и образование зачатка миоматозного узла. Установлена роль эстрогенов в активации рецепторов, участвующих в регуляции транскрипции многих генов, связанных с клеточной пролиферацией. Таким образом, необходимым условием запуска процессов трансформации в клетках-мишенях является увеличение содержания стероидов, в частности эстрогенов, как следствие этого усиление процессов пролиферации [4].
Исследованиями биохимических показателей женщин с миомой матки в репродуктивном и пострепродуктивном периоде установлено, что у женщин старше 45 лет, больных миомой матки, выявлены характерные изменения в биохимических показателях крови, которые отражают патологические механизмы заболевания. Отмечается снижение уровня гемоглобина, эритроцитов, ферритина, что, вероятно, связано с обильными и продолжительными кровотечениями, приводя к развитию железодефицитной анемии. На этом фоне повышен уровень тромбоцитов. Увеличение числа лейкоцитов указывает на наличие хронического воспалительного процесса, связанного с ростом опухоли. Скорость оседания эритроцитов значительно превышает норму, что является дополнительным подтверждением воспалительного процесса. Увеличено содержание лактатдегидрогеназы в два раза, что свидетельствует об активных процессах клеточной пролиферации и метаболических изменениях, характерных для опухолевой ткани (рис. 2, 3).
У больных женщин показано увеличение эстрадиола, указывая, что миома – эстрогензависимая опухоль, значения прогестерона могут выходить за пределы нормы, особенно ближе к верхней границе или немного выше, что связано с повышенной экспрессией прогестероновых рецепторов в ткани миомы (рис. 2).
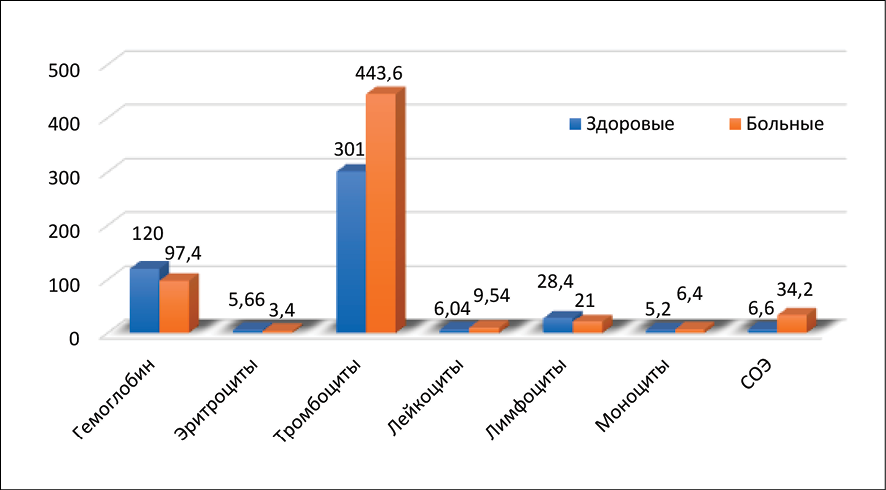
Рис. 2. Гематологические показатели женщин, больных миомой матки в менопаузе Источник: составлено авторами
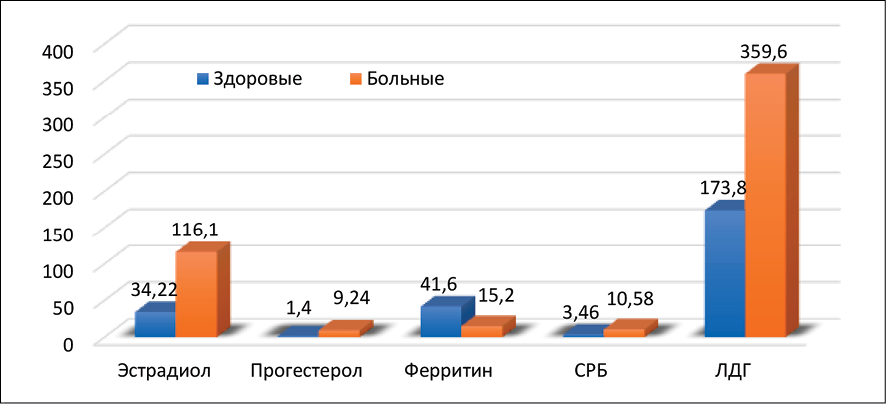
Рис. 3. Биохимические показатели женщин, больных миомой матки в менопаузе Источник: составлено авторами
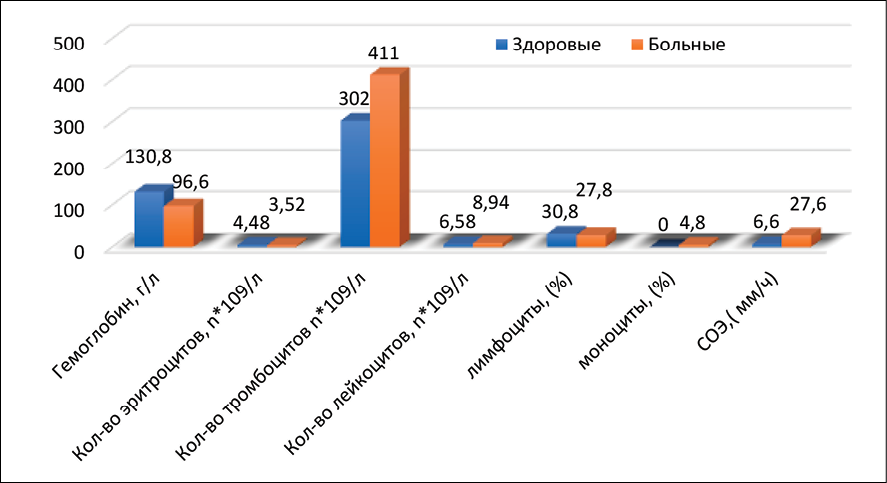
Рис. 4. Гематологические показатели женщин, больных миомой матки в репродуктивном возрасте Источник: составлено авторами
Для женщин репродуктивного возраста с миомой матки характерны типичные лабораторные изменения, отражающие патофизиологические механизмы заболевания. Снижен уровень гемоглобина, эритроцитов и ферритина, что обусловлено хронической кровопотерей при меноррагиях. Повышен уровень лейкоцитов и тромбоцитов, скорость оседания эритроцитов в 3 раза и концентрации С-реактивного белка более чем в 4 раза соответственно, приводя к дегенеративным изменения в миоматозных узлах. Установлено увеличение содержания прогестерона, эстрадиола и лактатдегидрогензы более чем в 3 раза по сравнению с контрольной группой здоровых женщин, что свидетельствует о повышении уровня метаболических процессов или деструктивных изменениях в ткани опухоли. Совокупность этих изменений имеет диагностическое значение и позволяет объективно рассматривать клинические проявления заболевания (рис. 4, 5).
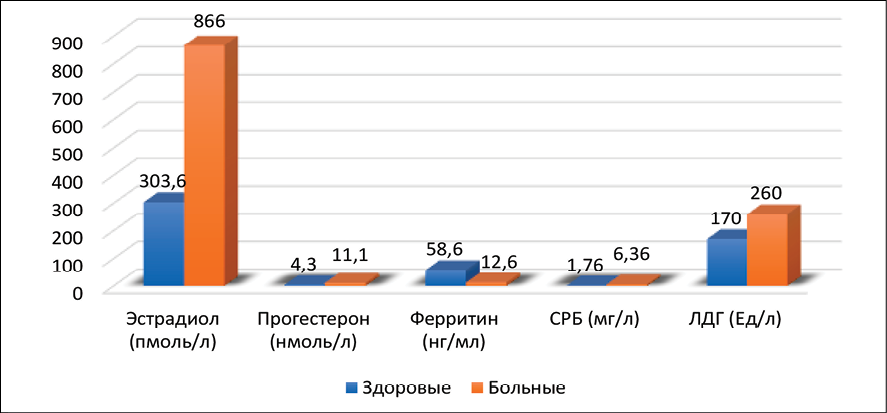
Рис. 5. Биохимические показатели женщин, больных миомой матки в репродуктивном возрасте Источник: составлено авторами
Сравнительная характеристика лабораторных показателей у женщин репродуктивного возраста с миомой матки и женщин в постменопаузе показывает значимые различия в лабораторных показателях, отражающие особенности уровня гормонов, обмена веществ и гематологических параметров. У женщин больных миомой матки в возрасте до 45–50 лет, как правило, наблюдается повышение уровня эстрадиола более чем в 3 раза, что обусловлено гормонозависимым характером опухоли В постменопаузе, напротив, уровень эстрадиола резко снижается до 50 пмоль/л и ниже, что связано с угасанием функции яичников и концентрация прогестерона уменьшена < 0,6 нмоль/л, что отражает физиологическое прекращение овуляторных циклов.
Установлены различия в гематологических показателях: у женщин репродуктивного возраста с миомой часто выявляется гипохромная анемия, снижены уровни гемоглобина, эритроцитов и ферритина. Это обусловлено хронической кровопотерей, связанной с меноррагиями. У женщин в постменопаузе, при отсутствии кровотечений, эти показатели, как правило, находятся в пределах нормы или ближе к верхним границам контрольных значений. Показатели воспаления также различаются. У женщин с миомой репродуктивного возраста наблюдается умеренное повышение СОЭ, СРБ и ЛДГ, что отражает наличие хронического асептического воспаления или дегенеративных изменений в тканях миоматозных узлов [5].
Таким образом, изучение показателей женщин с диагнозом миома матки в возрасте до 45 лет и после показало что репродуктивный возраст с наличием миомы матки сопровождается выраженными гормональными и гематологическими сдвигами, в то время как постменопаузальный период характеризуется гормональной стабильностью и отсутствием значимых патологических изменений в анализах.
Генетические механизмы играют значительную роль в формировании как миомы матки, так и рака шейки матки. Развитие миомы нередко связано с наследственной предрасположенностью, тогда как ключевым этиологическим фактором рака шейки матки является инфицирование вирусом папилломы человека в сочетании с мутациями в генах, контролирующих клеточный цикл. На сегодняшний день описано более 75 типов ВПЧ, однако штаммы HPV-16 и HPV-18 признаны ведущими онкогенными агентами. Среди 14 высокоонкогенных генотипов именно эти два типа ответственны примерно за 71 % всех случаев рака шейки матки. Канцерогенез при ВПЧ-инфекции имеет многоступенчатый характер: вирусные онкогены интегрируются в геном клетки-хозяина, нарушая регуляцию пролиферации и апоптоза, а эпителиальная ткань шейки матки проходит последовательные стадии морфологической трансформации – от нормального эпителия через предраковые изменения до инвазивной карциномы [6].
Проведено обследование 35 женщин, из которых у 10 обнаружились ВПЧ 16 и 18 генотипов высокого онкогенного риска, у 18 – ВПЧ других онкогенных типов, у 7 ВПЧ не обнаружены, что составляет 14,3; 51,4 и 20 % соответственно (рис. 6).
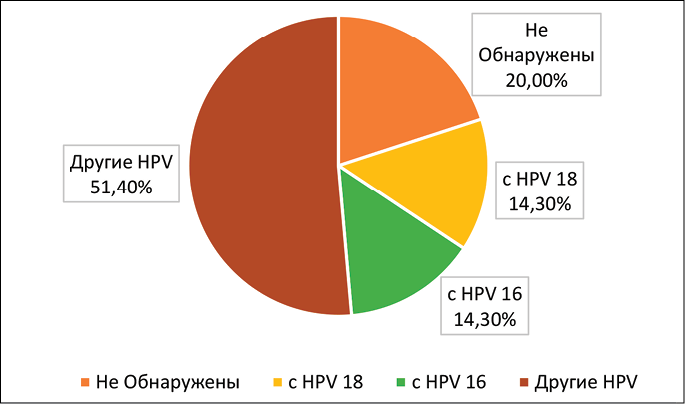
Рис. 6. Показатели урогенитального мазка здоровых и больных женщин, зараженных вирусом ВПЧ, методом ПЦР-анализа Источник: составлено авторами
В настоящее время установлено, что большинство инфекций, вызванных вирусом папилломы человека, подвергаются спонтанной элиминации, тогда как лишь у небольшой части женщин развивается персистирующая форма, способная со временем приводить к формированию злокачественных новообразований. Несмотря на то, что ВПЧ-инфекция является ключевым звеном в этиопатогенезе рака шейки матки, ее присутствия самого по себе недостаточно для злокачественной трансформации клеток. Канцерогенез в данном случае представляет собой сложный многофакторный процесс, в котором инфекция ВПЧ взаимодействует с рядом внешних и внутренних факторов, определяющих индивидуальную восприимчивость к опухолевому росту.
Существенную роль в этом взаимодействии играют генетические особенности организма, в том числе полиморфизмы генов, регулирующих процессы апоптоза и клеточного цикла. Накопленные данные свидетельствуют, что такие генетические вариации могут определять уровень наследственной предрасположенности к РШМ. Результаты исследований по семейной агрегации и оценке коэффициента наследуемости подтверждают наличие значимого генетического вклада в риск заболевания, однако молекулярно-генетическая основа рака шейки матки остается до конца не раскрытой [7].
Установлены ключевые хромосомные локализации и гены, вовлеченные в патогенез рака шейки матки. К ключевым генетическим изменениям, связанным с развитием заболевания, относят мутации и инактивацию ряда генов, регулирующих клеточный цикл, апоптоз и иммунный ответ. К ним относят ген TP53, расположенный на хромосоме 17p13.1, кодирует белок p53, участвующий в контроле клеточного цикла и индукции апоптоза. Ген CASP8, локализованный на хромосоме 2q33, участвует в запуске апоптоза, и его мутации или полиморфизмы могут снижать способность клеток к программируемой гибели, способствуя опухолевому росту. Под действием онкобелка E6 вируса папилломы человека p53 инактивируется, что приводит к неконтролируемому делению клеток. Подобный механизм наблюдается и при нарушении функции гена RB1 13q14, который кодирует белок pRb, регулирующий переход клетки из фазы G1 в S-фазу. Онкобелок E7 ВПЧ связывается с pRb, нарушая контроль пролиферации. На хромосоме 6p21 располагаются гены HLA включая HLA-A, HLA-B и HLA-DR, играющие ключевую роль в иммунном ответе. Некоторые аллели HLA ассоциированы с повышенной восприимчивостью или устойчивостью к раку шейки матки. Заболевание развивается как следствие вирус-индуцированных и собственно генетических мутаций, затрагивающих гены, контролирующие апоптоз TP53, CASP8, пролиферацию RB1, PIK3CA, теломерную стабильность TERT иммунный надзор HLA [8, с. 27].
Современные достижения молекулярной медицины значительно расширили понимание механизмов инициации и прогрессирования патологических процессов в матке. В патогенезе миомы ключевое значение имеют генетические изменения, которые выявляются примерно в 90 % случаев. Рост этой опухоли во многом обусловлен хромосомными и точечными мутациями, запускающими каскад пролиферативных процессов. Хромосомные перестройки регистрируются в 20–40 % образцов миоматозной ткани. Наиболее часто вовлекаются хромосомы 6, 7, 12 и 14, причем аномалии хромосомы 12 выявляются примерно в 20 % случаев, а хромосомы 7 – в 17 %. Выявляемые нарушения носят разный характер от делеций до транслокаций, что приводит к дисрегуляции экспрессии генов, контролирующих клеточный рост и дифференцировку. Подобные цитогенетические изменения, характерные для миомы матки, обнаруживаются и при других доброкачественных опухолях мезенхимального происхождения, включая фиброаденому молочной железы и эндометриальные полипы [9].
Представляет интерес установленная связь между типом хромосомных аномалий и фенотипическими характеристиками миоматозных узлов. Выявлено, что крупные миомы содержат больше клеток с патологическим кариотипом, чем мелкие. В тканях крупных узлов чаще наблюдаются транслокации между хромосомами 12 и 14, тогда как в мелких преобладают делеции хромосомы. Это позволило предположить, что определенные хромосомные нарушения могут ассоциироваться с повышенной митотической активностью опухоли. Однако вопрос о роли этих аномалий в патогенезе миомы остается открытым: неясно, являются ли они первичными событиями, запускающими опухолевый рост, или возникают вторично как следствие нарушений регуляции клеточного деления.
Существенный прогресс в изучении молекулярных механизмов развития миомы матки был достигнут в 2011 г., когда при экзомном секвенировании был идентифицирован ген MED12 – основной кандидат, вовлеченный в патогенез заболевания. Он локализован на длинном плече X-хромосомы (Xq13.1) и кодирует субъединицу медиаторного комплекса, участвующего в регуляции транскрипции, опосредованной РНК-полимеразой II. Доминантные мутации, преимущественно точечные например, c.131G> A в экзоне 2, выявляются примерно у 70 % пациенток с миомой, преимущественно в случаях, не ассоциированных с транслокацией t(12;14). MED12 экспрессируется на ранних стадиях эмбриогенеза, в том числе при формировании нервной системы, через активацию ряда сигнальных путей [10].
Установлено, что мутации MED12 предшествуют хромосомным аномалиям и рассматриваются как первичные события в развитии опухоли. Вторым значимым геном является HMGA2, расположенный на хромосоме 12q15. Он кодирует ДНК-связывающий гистоноподобный белок, регулирующий пролиферацию клеток. Повышенная активность HMGA2 наблюдается примерно в 20 % случаев миомы и часто сочетается с транслокацией t(12;14)(q15;q24), что коррелирует с формированием множественных и быстрорастущих узлов [11].
Кроме MED12 и HMGA2 в патогенез миомы вовлечен ряд других генов. К ним относятся: TP53 ген – супрессор опухолей; CD4, CD24ST мембранные белки, участвующие в межклеточной сигнализации; а также гены, регулирующие метаболизм и рецепцию стероидных гормонов, включая рецепторы эстрогенов и гены, отвечающие за метилирование. Особое внимание уделяется гормональной регуляции роста опухоли [12; 13].
Нарушение регуляции апоптоза также вносит вклад в рост миомы. Повышенная экспрессия антиапоптотического белка Bcl-2 и избыточная стимуляция факторов роста приводят к снижению программируемой клеточной гибели и усиленной пролиферации. В патогенезе участвуют и структурные гены, такие как COL4A5 и COL4A6 (Xq22.3-Xq23), кодирующие α-цепи коллагена IV типа, который важен для структуры базальной мембраны. Делеции в этих локусах могут сочетаться с миомами и почечными патологиями, указывая на участие в межклеточном взаимодействии и тканевом ремоделировании. Существенную роль играет также регион 7q22.1-q31.1, где часто обнаруживаются делеции и транслокации, связанные с активным ростом опухоли. В этой зоне расположены гены PCOLCE, регулирующий формирование внеклеточного матрикса, и CUX1, контролирующий клеточную пролиферацию. Молекулярная диагностика миомы матки включает определение мутаций в MED12, HMGA2, а также исследование хромосомных регионов 7q22.1-q31.1 и Xq23. Выявление этих изменений позволяет уточнить генетический подтип опухоли и выбрать персонализированный подход к лечению: от гормональной терапии до оперативного вмешательства [14, с. 212–213; 15].
Заключение
Анализ биохимических показателей крови у женщин, страдающих миомой матки и раком шейки матки, выявил характерные изменения, включая снижение уровня гемоглобина, количества эритроцитов и лимфоцитов, что указывает на развитие анемического синдрома, лейкопении и тромбоцитопении. В периферической крови таких пациенток также обнаруживались бластные клетки и гранулоциты, что отражает специфические особенности патологического процесса. Отдельное исследование биохимических показателей у женщин до 45 лет с миомой матки показало наличие выраженных изменений, требующих дальнейшего анализа для выявления взаимосвязи между метаболическими нарушениями и клиническим течением заболевания, и после показало, что репродуктивный возраст с наличием миомы матки сопровождается выраженными гормональными и гематологическими сдвигами, в то время как постменопаузальный период характеризуется снижением гормональных факторов эстрадиола по сравнению с контрольной группой здоровых женщин, что свидетельствует о повышении уровня метаболических процессов и подтверждает гормонозависимую природу миомы, приводя к пролиферации гладкомышечных клеток миометрия и прогрессировании опухолевого процесса. Установлено, что различные типы вируса папилломы человека играют значимую роль как генетический фактор в развитии рака шейки матки у женщин и ассоциированы с наличием опухолевого процесса. Проведенный методом полимеразной цепной реакции анализ выявил значительное превышение содержания ДНК ВПЧ типов 16 и 18 в цервикальных мазках, полученных от пациенток с диагнозом рак шейки матки. К числу генетических изменений, способных инициировать развитие злокачественного процесса в шейке матки, относят мутации в генах, регулирующих клеточный цикл, включая TP53, BRCA1 и BRCA2. Нарушения в этих генах приводят к потере контроля над пролиферацией клеток, что способствует их неконтролируемому делению и формированию опухоли.
Показано, что решающая роль в патогенезе миомы матки принадлежит хромосомным и генным мутациям. Наиболее значимые генетические изменения делеции и транслокации при миоме затрагивают хромосомы 7q31.2 CFTR, 12 HMGA2 и X-хромосома MED12. Сложный патогенез рака шейки матки и миомы основан на взаимодействии биохимических и генетических факторов, вызывая клеточные и тканевые изменения. Биохимические факторы приводят к изменению клеточного метаболизма, гормональному дисбалансу, который выступает в качестве предшественников злокачественной трансформации клеток. Комплексный анализ биохимических показателей, результатов цитологических исследований и генетических маркеров у женщин, страдающих миомой и раком шейки матки, позволяет выявить признаки возможного метастатического процесса. Такие данные обосновывают необходимость проведения более детального и целенаправленного обследования для уточнения диагноза и выбора оптимальной тактики лечения.


 science-review.ru
science-review.ru