Введение
В последние годы микропластик рассматривается как один из приоритетных и относительно устойчивых загрязнителей окружающей среды [1, 2]. Наряду с широким распространением микропластика в пищевых продуктах, питьевой воде и Мировом океане все больше данных свидетельствует о его способности оказывать негативное биологическое действие на живые системы, в том числе человека. В метаанализе, оценившем результаты 13 исследований с привлечением добровольцев, установлена связь между уровнем загрязнения микропластика, репродуктивным здоровьем женщин и исходом беременности, в том числе задержкой внутриутробного развития плода [3]. Интересно, что авторами установлено: даже употребление пищи из пластиковых контейнеров увеличивает вероятность «загрязнения» микропластиком беременных женщин [3]. Подтверждена роль микрочастиц пластика в заболеваниях гепатобилиарной системы – в частности, его наличие усугубляет течение неалкогольной жировой болезни печени, как было продемонстрировано в экспериментальном исследовании на мышах [4]. Все чаще появляются свидетельства о влиянии на желудочно-кишечный тракт путем нарушения баланса кишечной микрофлоры, что, в свою очередь, само по себе способно приводить к системным эффектам, в том числе на иммунную и нервную системы [5, 6]. Среди упомянутых эффектов особенно выделяется способность провоцировать воспалительные процессы в печени, основном органе детоксикации, сопровождающиеся апоптозом клеток [5], что, безусловно, косвенно способствует снижению адаптационного потенциала организма к потенциальному воздействию ксенобиотиков любого рода. Однако, несмотря на бурное изучение вредных свойств микрочастиц пластика, вопросы его распределения в организме, тканеспецифичной локализации и кинетики накопления остаются слабо изученными. Имеются лишь единичные сведения о том, что микрочастицы пластика благодаря своему небольшому размеру могут легко проникать в пищеварительный тракт и задерживаться там, впоследствии преодолевая биологические барьеры и перемещаясь в другие части организма, такие как кровь, печень, почки и мозг [7].
Вместе с тем большая часть доступной литературы сосредоточена преимущественно на оценке токсического действия микропластика, тогда как данные о его биораспределении, в том числе при системном поступлении, крайне ограничены. Между тем особенности распределения микрочастиц в организме могут напрямую определять как характер, так и выраженность их биологического действия. Это хорошо продемонстрировано в исследованиях, посвященных токсическим свойствам наночастиц, для которых токсичность определяется не только химическим составом, но и физико-химическими параметрами: размером, формой, зарядом поверхности, способностью образовывать белковую корону и агрегаты, адсорбировать на своей поверхности прочие вещества [8, 9]. Эти характеристики существенно влияют на проникновение частиц в ткани и их взаимодействие с клетками [9]. Кроме того, растет количество данных, указывающих на способность микропластика адсорбировать на своей поверхности другие загрязнители, включая органические соединения [10, 11], что потенциально может усиливать токсический эффект последних, способствовать их транспортировке вглубь биологических тканей вместе с самим микропластиком.
Следует отметить, что используемые в ряде исследований методы выявления микропластика в тканях часто предполагают сложные аналитические технологии, требующие дорогостоящего оборудования и высокой квалификации персонала. На этом фоне особую ценность приобретают простые и воспроизводимые подходы, такие как полуколичественные методы визуальной оценки, широко применяемые в различных отраслях науки. Подобные методы не требуют сложного оборудования или специализированной подготовки, обеспечивают быструю интерпретацию результатов и хорошо подходят для первичного скрининга. Несмотря на относительную субъективность, при правильно организованной системе ранжирования и двойной слепой оценке они могут давать стабильные и сопоставимые результаты, особенно в условиях, когда количественный анализ затруднен или экономически нецелесообразен.
Цель исследования – сравнительная полуколичественная оценка накопления микрочастиц полистирола размером 100 и 1000 нм в ткани легких крыс после однократного воздействия.
Материалы и методы исследования
Самки крыс линии Wistar возрастом около 3 месяцев и массой 180–200 г на начало экспериментального исследования были получены из питомника «Рапполово» и содержались в оборудованном виварии в соответствии с действующими нормами и стандартами Российской Федерации, а также положениями Директивы 2010/63/ЕС Европейского парламента о защите животных, используемых в научных целях. Содержание и уход за животными соответствовали требованиям ГОСТ 33215–2014. Этическое заключение на проведение исследования получено (протокол № 01-02 от 08.02.2024).
В исследование включено 12 интактных самок, которые были случайным образом распределены на 4 группы по 3 животных. Каждой крысе была нанесена индивидуальная метка, которая располагалась на хвосте. С учетом ограниченного количества животных в каждой группе, для повышения достоверности результатов от каждого органа отбиралось по 4 образца тканей из случайных областей, что в сумме обеспечивало 12 наблюдений на группу. Учет стадий эстрального цикла не проводился, однако, благодаря идентичным условиям содержания и случайному распределению животных по группам, влияние полового цикла на результаты считается минимальным.
Для изучения распределения микрочастиц пластика использовались меченные флуоресцентным красителем полистирольные частицы сферической формы диаметром 100 и 1000 нм (QiuHuan, Китай; максимум возбуждения – 488 нм, максимум эмиссии – 518 нм), приготовленные в виде 1 % суспензии в дистиллированной воде. Перед введением суспензия гомогенизировалась в ультразвуковой ванне (УЗО-«МЕДЭЛ») с использованием ротатора (BioSan) и контролировалась визуально с помощью фильтра EGFP на флуоресцентном имиджере Celena X (Logos Biosystems, Южная Корея). Контрольной субстанцией служил физиологический раствор.
Микрочастицы вводили в объеме 0,5 мл внутрисердечно с целью моделирования острого системного воздействия и изучения последующего распределения в легочной ткани. Такой способ введения обеспечивает прямой доступ микропластика в сосудистое русло и минимизирует возможные потери при прохождении желудочно-кишечного тракта или при ингаляции, что позволяет строго контролировать дозировку и условия распределения вещества [12]. При этом следует учитывать, что данный метод не отражает физиологические пути попадания микропластика в организм, а моделирует искусственное острое системное воздействие [13]. Через 5 ч после введения животных подвергали эвтаназии методом декапитации. Из легких немедленно отбирались образцы тканей для морфологического анализа. До криотомии фрагменты хранились при -70 °C в криогеле. Срезы толщиной 10 мкм изготавливались на микротоме-криостате Leica СМ 1520 (Leica BioSystems, Германия), после чего наносились на предметные стекла и документировались с использованием светофильтра EGFP при увеличении 200× (Celena X, Logos Biosystems).
Для полуколичественной оценки степени накопления микропластика в легочной ткани два независимых исследователя оценивали количество флуоресцирующих объектов и их конгломератов не менее чем в 30 случайно выбранных полях зрения на каждый образец. К флуоресцирующим объектам относили четко очерченные элементы сферической формы, а также конгломераты таких частиц. Для снижения субъективности оценка проводилась независимо двумя операторами, результаты усреднялись. Применялась ранговая шкала: 0 – отсутствие флуоресцирующих объектов или участков, 1 – единичные, 2 – умеренное количество, 3 – выраженное накопление.
Статистическая обработка данных полуколичественной оценки выполнялась с использованием метода Bootstrap с поправкой Холма – Бонферрони. С одной стороны, Bootstrap обеспечивает устойчивость анализа при небольшом объеме выборки и не требует строгих допущений о распределении данных, что особенно важно для ранговых шкал. С другой, для множественных сравнений между группами использовалась поправка Холма – Бонферрони, которая представляет собой усовершенствованную версию классической поправки Бонферрони. Этот метод позволяет эффективно контролировать общий уровень ошибок первого рода (ложноположительных результатов), возникающих при множественном тестировании, при этом сохраняя более высокую статистическую мощность по сравнению с консервативной классической процедурой. Сначала полученные p-значения упорядочиваются по возрастанию, после чего каждому из них присваивается индивидуальный уровень значимости, становящийся все более строгим по мере увеличения ранга. Проверка гипотез осуществляется последовательно: если первая (наименьшая) p-значимость оказывается статистически значимой, проверка продолжается; в противном случае весь набор признается недостоверным. Такой подход позволяет более надежно интерпретировать результаты множественных сравнений, минимизируя риск случайных находок при сохранении чувствительности анализа [14].
Результаты исследования и их обсуждение
На рисунке представлены микрофотографии фрагментов тканей легких животных контрольной группы и животных, подвергшихся воздействию МП размером 100 и 1000 нм, полученные во флуоресцентном режиме.
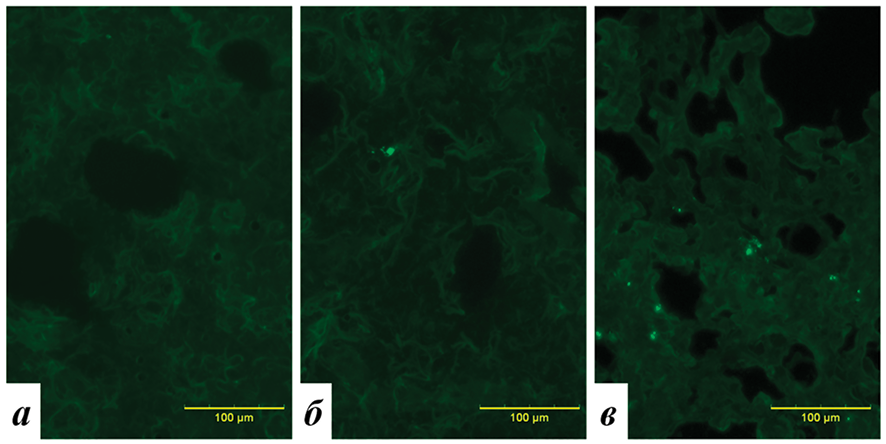
Микрофотографии фрагментов легких животных контрольной группы (а) и экспериментальных животных, подвергшихся воздействию МП размером 100 (б) и 1000 (в), увеличение х200
В контрольной группе визуализируется умеренное равномерное фоновое свечение ткани, обусловленное естественной аутофлуоресценцией. Это явление характерно для многих биологических структур, в том числе коллагена, эластина, липофусцина, и служит естественным «шумом», неминуемо сопровождающим флуоресцентную микроскопию. Важно отметить, что аутофлуоресценция не является артефактом, она отражает естественную метаболическую активность тканей.
Структура ткани животных, получавших микрочастицы пластика размером 100 или 1000 нм, сохранена и аналогична контролю. Вместе с тем встречаются яркие флуоресцирующие объекты разного размера – микрочастицы пластика либо их конгломераты.
Полуколичественная оценка накопления микропластика показала, что в контрольной группе среднее количество флуоресцирующих объектов и их конгломератов составило 0,12 ± 0,04 балла. Эти значения не свидетельствуют о наличии микропластика как такового, а скорее отражают уровень фоновой флуоресценции, характерный для данной ткани. Поскольку оценка проводилась вслепую двумя независимыми операторами, вероятно, отдельные участки фонового свечения могли быть ошибочно интерпретированы как частицы.
В группе, получившей микрочастицы диаметром 100 нм, это значение было статистически значимо выше и составило 0,54 ± 0,05 балла (p = 0,0001 по сравнению с контролем). В группе, получившей частицы диаметром 1000 нм, уровень накопления оказался еще выше – 1,31 ± 0,06 балла (p = 0,0001 по сравнению с контролем). Различия между двумя экспериментальными группами также оказались статистически значимыми (p = 0,0001), при этом показатель для группы 1000 нм почти в два раза превышал таковой для группы 100 нм.
Важно подчеркнуть, что задачей настоящего исследования не являлось моделирование реального (ингаляционного) пути поступления микропластика в организм. Целью работы было расширение научных представлений о распределении частиц в случае их попадания в системный кровоток, например, после преодоления желудочно-кишечного барьера. Предполагается, что различия в распределении микрочастиц после внутрисердечного введения обусловлены как физико-химическими свойствами самих частиц, так и особенностями системного и легочного кровообращения. При введении вещества в левый желудочек сердца оно поступает в большой круг кровообращения, однако дальнейшее поведение частиц зависит от их размера, как это известно и доказано, например, для частиц микро- и нанометрового диапазона [9, 15]. Частицы диаметром 100 нм, крайне близкие к нанометровому диапазону, обладая низким гидродинамическим сопротивлением, потенциально способны проходить через капиллярные барьеры и распространяться таким образом [16]. Напротив, микрочастицы 1000 нм, ввиду больших размеров, могут задерживаться на уровне микрососудов, особенно в условиях высокой вязкости среды и наличия клеточных фильтров в легочном русле.
Дополнительным фактором, влияющим на распределение микрочастиц пластика в живом организме, может быть фагоцитоз со стороны иммунных клеток. Как первичный фагоцит в легких, альвеолярный макрофаг отвечает за удаление чужеродных частиц и патогенов. И, хотя он может поглощать частицы в том числе до 1000 нм, частицы более 100 нм уже считаются достаточно крупными для фагоцитоза. Существует два независимых механизма эндоцитоза крупных частиц свыше 100 нм: фагоцитоз и макропиноцитоз. Обе формы эндоцитоза опосредованы рецепторами и требуют актин-зависимой перестройки цитоскелета; однако механика поглощения различна. Фагоцитоз включает механизм, подобный застежке-молнии, в котором псевдоподии плотно обхватывают цель, исключая окружающую жидкость. Для сравнения, макропиноцитоз использует складки клеточной мембраны, которые выступают вокруг цели, складываются обратно на мембрану и сливаются, образуя большие эндоцитарные макропиносомы [17]. Также стоит отметить, что частицы свыше 1000 нм и их конгломераты могут быть слишком крупными для эффективного захвата [17]. Таким образом, можно предположить, что частицы меньшего размера, поступив с током крови в легкие, частично покидают их и продолжают циркуляцию, в то время как более крупные микрочастицы остаются в легочной ткани. Следует отметить, что визуально фиксируемое скопление флуоресцирующих объектов не позволяет с уверенностью установить, наблюдаются ли индивидуальные частицы, их агрегаты или поглощенные макрофагами комплексы. Полученные данные подтверждают, что физические характеристики, такие как размер частиц, играют ключевую роль в их биологическом поведении. Эти параметры должны учитываться не только для наноматериалов, но и в отношении микропластика, влияние которого на организм остается недостаточно изученным. Вместе с тем необходимы дальнейшие исследования, включая иммуногистохимические и ультраструктурные методы, необходимы для прояснения механизмов клеточного захвата, накопления и элиминации микропластика при остром и особенно при длительном воздействии.
Заключение
В исследовании на белых крысах-самках показано, что уже через 5 ч после однократного системного воздействия (внутрисердечного введения) микрочастицы пластика диаметром 100 и 1000 нм накапливаются в легочной ткани крыс. Степень накопления при этом зависит от размера частиц: более крупные частицы выявлялись статистически значимо чаще, чем частицы меньшего диаметра. Вероятно, это связано как с особенностями легочной микроциркуляции, так и с ограничениями фагоцитарной активности макрофагов в отношении частиц определенного размера.
Наблюдаемая тенденция подчеркивает важность учета физико-химических свойств микропластика при оценке его биологического поведения. Визуально определяемые флуоресцирующие объекты могут представлять собой как отдельные частицы, так и их конгломераты или комплексы, поглощенные макрофагами, что требует уточнения с помощью дополнительных методов. Полученные результаты демонстрируют перспективность полуколичественного подхода к оценке накопления микропластика и подчеркивают необходимость дальнейшего изучения механизмов его распределения и элиминации, особенно в условиях длительного воздействия.


 science-review.ru
science-review.ru