Разработка основ биотехнологии любого ферментного препарата, помимо выбора наиболее высокопродуктивного штамма, включает изучение условий его биосинтеза, т.к. наличие гена, контролирующего образование фермента, еще не служит гарантией того, что данный фермент будет образовываться в значительном количестве [3]. В настоящее время исследователями проведен ряд экспериментов, подтверждающих влияние на биосинтез ферментов индукторов (специфических субстратов) и репрессоров (продуктов жизнедеятельности микроорганизма). Они воздействуют на участки молекул ДНК микроорганизмов, в которых заложены матрицы для биосинтеза ферментов. Присутствие индуктора биосинтеза пектиназ в качестве источника углерода в среде необходимо, в то время как репрессор по возможности должен быть удален [6]. Микроорганизмы способны утилизировать самые разнообразные углеродсодержащие соединения. Источниками углерода могут быть такие пектиновые вещества, как свекловичный жом, виноградные выжимки [3], стебли хлопчатника [5], тростниковая меласса, кофейный шрот и другие отходы переработки сельскохозяйственных продуктов [4].
Данная работа посвящена изучению продуцирования пектиназ культурой A. awamori 56-2-53-85-375 на различных источниках углеродного питания.
Материалы и методы исследований
Культура мицелиального гриба A. awamori 56-2-53-85-375 получена в результате многоступенчатой селекции и мутагенеза на кафедре биотехнологии Южно-Казахстанского государственного университета им. М. Ауэзова, она поддерживается на скошенном сусло-агаре при 4оС [7].
Активность пектолитического комплекса ферментов определяли по методике действующего ГОСТ Р 55298-2012. Мицелий, полученный в процессе культивирования A. awamori 56-2-53-85-375, отделяли от культуральной жидкости на фильтре и затем подвергали водной экстракции.
Культивирование проводили в конусообразных колбах Эрленмейера объемом 250 мл на термостатированной качалке (220 об/мин) при температуре 30o C с pH 3,2 в течение 84 ч на жидкой питательной среде следующего состава, масс. %: свекловичный жом – 3, солодовые ростки – 1, (NH4)2SO4 – 0,1, KH2PO4 – 0,1, MgSO4–0,1.
Результаты и их обсуждение
Биосинтез пектолитических ферментов индуцируется пектиновыми веществами. Для определения зависимости биосинтеза пектиназ от различных источников углерода культурой A. аwamori 56-2-53-85-375 определяли количество биомассы и пектолитическую активность через 5 суток роста, заменяя в ней источник углерода в концентрации 3% (табл. 1). В качестве источников углерода использовали среды, содержащие в основе молекулы полигалактуроновую кислоту (гидролизат свекловичного жома, цитрусовый пектин, хлопковые створки, арбузные и виноградные выжимки) и легко метаболизируемые сахара (лактоза, фруктоза, глюкоза).
Как видно из данных табл. 1, биосинтез пектолитических ферментов с наибольшей активностью (1,77 ед/мл) происходит на среде, содержащей свекловичный жом, прошедший глубокий ферментативный гидролиз. Это обусловлено тем, что с прогидролизованным сырьем в ферментационную среду вносятся легко усвояемые низкомолекулярные вещества углеводной природы. Несмотря на высокие показатели общей пектолитической активности на среде, содержащей гидролизат свекловичного жома, использование данного источника углерода является нерентабельным из-за его дороговизны. Хорошая активность наблюдается на виноградных выжимках (1,74 ед/мл) и на хлопковых створках (1,73 ед/мл), т.к. синтез пектолитических ферментов эффективно индуцируется молекулами полигалактуроновой кислоты, которые в них содержатся. Хлопковые створки и виноградные выжимки представляют собой вторичное сырье перерабатывающих отраслей пищевой промышленности, которые ежегодно образуются десятками тысяч тонн в Южно-Казахстанской области.
Таблица 1
Влияние источников углерода на биосинтез пектолитических ферментов
|
Источник углерода |
Биомасса, г/л |
ПкС, ед/мл |
|
Свекловичный жом (исходный вариант) |
2,2 |
1,65 |
|
Гидролизат свекловичного жома |
1,7 |
1,77 |
|
Лактоза |
3,5 |
1,68 |
|
Фруктоза |
5,1 |
1,48 |
|
Глюкоза |
4,8 |
1,53 |
|
Арбузные выжимки |
2,0 |
1,32 |
|
Хлопковые створки |
1,6 |
1,73 |
|
Виноградные выжимки |
2,5 |
1,74 |
|
Цитрусовый пектин |
3,2 |
0,88 |
Т.к. среда для роста микроорганизмов должна не только обеспечивать физиологические потребности продуцента и максимальное образование ферментов, но и быть дешевой и доступной, то использование различных пищевых отходов, как компонентов питательной среды, позволяет улучшить технико-экономический показатель производства. Исходя из этого следует, что из всех испытанных источников углерода самыми оптимальными для биосинтеза пектиназ являются хлопковые створки и виноградные выжимки.
Лактоза также оказывает стимулирующее действие на синтез пектиназ штамма A. аwamori 56-2-53-85-375. При использовании фруктозы отмечен наибольший рост культуры, но при этом наблюдается слабая общая пектолитическая активность.
С целью повышения пектолитической активности проверено совместное влияние различных источников углерода из числа описанных в таблице 1 на рост, развитие и ферментативную активность штамма А. аwamori 56-2-53-85-375. Для этого производим частичную замену свекловичного жома на другие источники углерода – отходы сельскохозяйственного производства Республики Казахстан с низкой себестоимостью (табл. 2).
Таблица 2
Совместное влияние различных источников углерода на биосинтез пектолитических ферментов штаммом А. awamori 56-2-53-85-375
|
Компоненты питательной среды и их концентрация, % |
ПкС, ед/мл |
Биомасса, г/л |
Цикл роста, сут |
|||
|
Свекловичный жом |
Виноградные выжимки |
Хлопковые створки |
Лактоза |
|||
|
3 |
- |
- |
- |
1,65 |
2,2 |
5 |
|
2 |
1 |
- |
- |
1,69 |
2,8 |
5 |
|
1 |
2 |
- |
- |
1,60 |
2,1 |
6 |
|
1 |
- |
1 |
- |
1,68 |
2,4 |
5 |
|
1 |
- |
2 |
- |
1,66 |
2,2 |
5 |
|
2,5 |
- |
- |
0,50 |
1,58 |
2,7 |
6 |
|
2 |
1 |
- |
0,10 |
1,76 |
3,1 |
5 |
|
2 |
- |
1 |
0,10 |
1,75 |
2,9 |
5 |
|
1 |
1 |
1 |
0,10 |
1,77 |
3,3 |
4 |
|
1 |
1 |
1 |
0,05 |
1,71 |
3,0 |
5 |
|
1 |
1 |
1 |
0,15 |
1,79 |
3,5 |
4 |
|
1 |
1 |
1 |
0,20 |
1,70 |
2,6 |
5 |
Наиболее активный синтез пектиназ (1,79 ед/мл) наблюдается на среде, содержащей свекловичный жом, виноградные выжимки и хлопковые створки в равных соотношениях в концентрации 1%, а также лактозу в концентрации 0,15%.
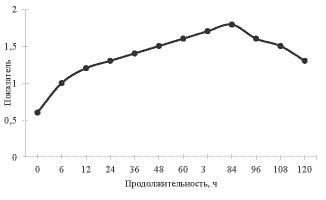
Рис. 1. Влияние длительности культивирования штамма А. awamori 56-2-53-85-375 на синтез пектиназ*
Синтез пектолитических ферментов зависит от стадии роста культуры: скорость стадии возрастает в конце экспотенциального роста – начале стационарной фазы [3]. Максимальное образование пектиназы достигается через 60-70 часов и штамм сохраняет продуктивность в течение 100 часов культивирования (рис.1). При этом прирост биомассы происходит по логарифмическому закону и максимум приходится на 5 сутки. Таким образом, оптимальное время культивирования для получения ферментного препарата составляет 82-84 часа.
Заключение
На основании полученных результатов можно сделать вывод, что пектолитическая активность штамма A. awamori 56-2-53-85-375 (1,79 ед/мл) увеличивается при использовании сред со смешанными источниками углеродного питания. Синтезируемые пектиназы являются индуцибельными ферментами, активный биосинтез которых осуществляется на средах с пектиновыми веществами. Наиболее эффективными индукторами являются свекловичный жом, виноградные выжимки и хлопковые створки в концентрации 1%, а также лактоза в концентрации 0,15%.
Библиографическая ссылка
Джакашева М.А., Кедельбаев Б.Ш., Есимова А.М., Балхибеков Р.М. ВЛИЯНИЕ ИСТОЧНИКОВ УГЛЕРОДА НА НАКОПЛЕНИЕ ПЕКТИНАЗ КУЛЬТУРОЙ ASPERGILLUS AWAMORI 56-2-53-85-375 // Научное обозрение. Биологические науки. 2017. № 1. С. 84-86;URL: https://science-biology.ru/ru/article/view?id=1036 (дата обращения: 02.03.2026).


 science-review.ru
science-review.ru