Печень, являясь железой внешней секреции человека и позвоночных животных, выполняет большое количество различных жизненно важных физиологических функций. В печени происходит обезвреживание различных токсических и аллергических веществ, которые превращаются в значительно более легко удаляемые из организма вещества. Кроме того, функциональная роль печени заключается в удалении избытков гормонов, витаминов, промежуточных и конечных продуктов обмена ряда веществ. Кроме выполнения барьерной функции клетки печени синтезируют белки, мочевину, желчные кислоты, триглицериды. Важную роль печень играет в процессах глюкогенеза. В печени образуется множество различных веществ, неоьходимых для энергетического и пластического обмена организма. К ним относятся аминокислоты, моносахариды, жирные кислоты, а также многие другие химические соединения. Печень участвует в сохранении равновесия жидкостей в организме, обеспечивает поступление в кровь фосфатидов и белков, а также оказывает влияние на поддержание постоянной концентрации питательных веществ в крови. Печень выделяет с желчью чужеродные вещества, продукты порфиринового обмена, желчные кислоты и холестерин. Таким образом, печень выполняет много жизненно важных функций, и любые патологии, приводящие к их нарушениям, будут оказывать пагубное влияние на организм в целом.
Одной из актуальных проблем современной медицины и биологии является проблема профилактики и лечения патологических состояний печени. В течение всей жизни человек оказывает очень высокие нагрузки на печень, заставляя её работать в режиме перегрузки. На состоянии печени неизбежно сказываются неправильное питание, стрессы, алкоголь, курение, а также лекарства, которые человек за свою жизнь принимает в избытке. Многие заболевания других органов и тканей также отрицательно сказываются на состоянии печени. Согласно данным Всемирной организации здравоохранения, во всем мире наблюдается отчетливая тенденции к росту заболеваний печени в последние 20 лет. Продолжительное воздействие перегрузок на печень приводит к разрушению клеточных мембран и органелл, что способствует проявлению нарушений жизнедеятельности клеток.
В организме функцию регуляции роста и развития клеток, а также процессов их пролиферации, дифференцировки и апоптоза выполняет ряд биорегуляторов. В настоящее время исследование различных цитокинов и биорегуляторных пептидов создают основу для разработки новых препаратов для профилактики и лечения ряда заболеваний печени. В ряде работ [1–3] установлена перспективность использования олигопептидов в качестве потенциальных лекарственных средств, увеличивающих регенерационный потенциал тканей организма.
Для тестирования биологической активности различных веществ одним из наиболее адекватных методов является их апробация в органотипической культуре ткани [4–6]. Данный метод удобен отсутствием в культуре гуморальных и нервных влияний, которые действуют на клетки в целостном организме. Ткань находится в стандартных, контролируемых условиях, причем возможно строгое дозирование вводимого в культуру ткани вещества.
Цель работы: исследование влияния синтезированных трипептида и тетрапептида на пролиферацию клеток в органотипической культуре ткани печени молодых половозрелых крыс.
Материалы и методы исследования
Работу проводили на крысах линии Вистар из биоколлекции «Коллекция лабораторных млекопитающих разной таксономической принадлежности» Института физиологии им. И.П. Павлова РАН, поддержанной программой биоресурсных коллекций ФАНО России. В экспериментах использовано 850 эксплантатов печени половозрелых крыс массой 200-250 г.
Исследованы разработанные в Санкт-Петербургском Институте биорегуляции и геронтологии олигопептид Т-1 (состоит из 3-х аминокислот: глутаминовая кислота, аспарагиновая кислота, лейцин) и олигопептид Т-2 (состоит из 4-х аминокислот: лизин, глутаминовая кислота, аспарагиновая кислота, аланин).
Фрагменты печени величиной около 1 мм3 помещают в чашки Петри. Наличие полилизинового покрытия на дне чашки способствует лучшему прикреплению эксплантатов. Вся работа проводится в стерильном ламинаре при наличии потока стерильного воздуха. Для жизнедеятельности клеток необходимо наличие питательной среды (состав: 35 % среды Игла, 35 % раствора Хенкса, 5 % фетальной сыворотки быка, 0,6 % глюкозы, 100 ед/мл гентамицина). Олигопептиды были добавлены в чашки Петри в концентрациях от 0,01 нг/мл до 10 нг/мл. Трое суток чашки Петри с эксплантатами находились в термостате с подачей 5 % СО2 при температуре 37оС. В первые сутки культивирования происходили пролиферация и мигрирование гепатоцитов, образующих периферическую зону роста эксплантатов. Через трое суток с исплользованием фазово-контрастного микроскопа морфометрическим методом оценивали влияние олигопептидов на развитие эксплантатов печени. Рассчитывали индекс площади (ИП) эксплантатов (отношение площади всего эксплантата, совместно с периферической зоной роста (A2), к площади центральной зоны эксплантата (A1) по формуле D % = ((A2 – A1)/A1) x 100 %. Контрольное значение ИП принимали за 100 %, все остальные ИП выражали в процентах к контролю. Достоверность различий ИП в контроле и эксперименте оценивали с помощью t-критерия Стьюдента. Статистическую обработку полученных данных производили с использованием пакета программ «Microsoft Excel».
Результаты исследования и их обсуждение
При исследовании трипептида Т-1 в концентрациях от 0,01 до 10 нг/мл выявлялась его эффективная концентрация.
Как показано на рис. 1, препарат оказывает статистически достоверное стимулирующее влияние на Индекс площади эксплантатов ткани печени молодых крыс в концентрации 0,05 нг/мл (ИП выше на 33,0 % (p < 0,05) по сравнению с контролем), в концентрации 0,1 нг/мл (ИП выше на 30,1 % (p < 0,05) по сравнению с контролем), в концентрации 1 нг/мл (ИП выше на 20,1 % (p < 0,05) по сравнению с контролем) и в концентрации 10 нг/мл (ИП выше на 24,3 % (p < 0,05) по сравнению с контролем). В концентрации 0,01 нг\мл препарат достоверно стимулирующего или угнетающего действия не оказывал.
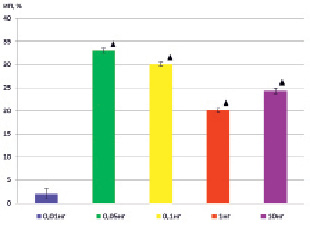
Рис. 1. ИП ( %) эксплантатов ткани печени, в питательную среду которых был добавлен трипептид Т-1, по сравнению с контрольными эксплантатами. Примечание: контроль – нулевая линия.
? р < 0,05 по сравнению с контролем
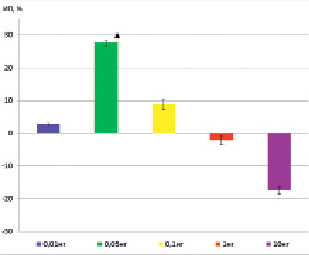
Рис. 2. ИП ( %) эксплантатов ткани печени, в питательную среду которых был добавлен тетрапептид Т-2, по сравнению с контрольными эксплантатами. Примечание: контроль – нулевая линия.
? р < 0,05 по сравнению с контролем
При раститровке тетрапептида Т-2 в концентрациях от 0,01 до 10 нг/мл выявлялась его эффективная концентрация.
Как показано на рис. 2, препарат Т-2 в концентрации 0,05 нг/мл оказывает статистически достоверное стимулирующее влияние на ИП эксплантатов ткани печени молодых крыс (ИП выше на 27,7 % (p < 0,05) по сравнению с контролем). В концентрациях 0,01 нг\мл, 0,1 нг/мл, 1 нг/мл и 10 нг/мл препарат статистически достоверного стимулирующего или угнетающего действия не оказывал.
Таким образом, в результате эксперимента было выявлено, что исследованные олигопептиды оказывают стимулирующее клеточную регенерацию влияние на ткань печени крыс. Более широкий диапазон стимулирующих пролиферацию концентраций был у трипептида Т-1, по сравнению с тетрапептидом Т-2.
Использованные в наших экспериментах олигопептиды состоят из ряда аминокислот, у которых, как показано в ряде исследований [7–9], наблюдаются либо стимулирующий, либо угнетающий клеточную пролиферацию тканей эффекты. Так стимулирующим статистически достоверным влиянием на ИП эксплантатов ткани печени крыс обладала глутаминовая кислота (ИП повышался на 26 %, по сравнению с контролем), а угнетающее действие на ИП эксплантатов ткани печени было выявлено у аспарагиновой кислоты, лизина и лейцина. Совместное действие в составе олигопептидов стимулирующей и угнетающей аминокислот создает баланс, необходимый для поддержания основных клеточных функций – пролиферации и апоптоза, что в свою очередь способствует запуску регенерационных процессов в ткани печени.
В настоящее время складывается концепция, что на клеточном уровне регуляция поддержания функциональной активности организма осуществляется сигнальными молекулами, в том числе пептидами, способствующими сохранению сложного равновесия между такими физиологическими клеточными процессами, как пролиферация, дифференцировка и апоптоз [10–13]. Регуляцию межклеточных сигналов на аутокринном и паракринном уровнях выполняют специальные сигнальные молекулы – цитомедины и цитокины. Постоянный процесс обмена веществ, а также воспроизведения генетической информации происходит в живых организмах именно с помощью различных регуляторных факторов. Изучение и выявление таких факторов в многоклеточных системах позволяет выявить генез развития организмов, а также процессы клеточной дифференцировки. В настоящее время формируется концепция о том, что подобные регуляторные механизмы возникли в эволюции в результате не только стимулирующих, но и угнетающих биохимических реакций. Как показывают результаты, полученные в данной работе, именно сочетание в олигопептидах стимулирующих аминокислот с ингибирующими приводит к эффективному воздействию таких олигопептидов на регенерационные процессы в ткани печени. Подобные сочетания выполняют роль регуляторных механизмов, координирующих соотношение гепатоцитов, фибробластов и, в результате, контролируют пролиферационные процессы в ткани печени.
Таким образом, можно сделать вывод, что олигопептиды образуют систему сигнальных молекул, обеспечивающую регуляцию функций организма на различных уровнях (молекулярно-генетическом, клеточном, субклеточном и тканевом). Выявлено, что исследованные в данной работе олигопептиды регулируют экспрессию генов и синтез белков [1, 3], а также стимулируют пролиферацию клеток ткани печени. Это чрезвычайно важно для восстановления функций исследуемого органа при наличии у него различных патологий. Поэтому на основе данных пептидов возможно создание базы для новых подходов к профилактике и лечению заболеваний печени.
Известно, что для лечения заболеваний печени, а также нарушений функций печени, связанных со старением организма, в настоящее время используют также препараты полипептидных комплексов (ППК). Данные пептидные препараты показали статистически значимый клинический эффект и начали применяться в клинической практике [13]. Однако олигопептиды, в производстве которых используется химический синтез, позволяют отказаться от трудоемкого и дорогого экстрагирования ППК из тканей крупного рогатого скота. Препараты на основе коротких аминокислотных цепочек являются инновационным подходом к лечению и профилактике различных нарушений печени. При их создании необходимо учитывть ранговое количество аминокислот, входящих в ППК, и влияние отдельных аминокислот на данную ткань. Эти условия были соблюдены при синтезе трипептида Т-1 и тетрапептида Т-2, в состав которых входят аминокислоты как стимулирующие пролиферацию клеток ткани печени, так и ингибирующие клеточную пролиферацию.
Следует отметить, что эффективные концентрации исследованных олигопептидов находились в диапазоне ультрамалых концентраций (10-10 – 10-12М). В последние десятилетия уделяется значительное внимание проблеме чувствительности животных и человека к ультрамалым концентрациям биологически активных веществ. Такая чувствительность получила обозначение нано- или пикограммовой чувствительности (10-12М и ниже), что составляет 0,01–0,05 нг/мл. Влияние ультрамалых доз уже продемонстрировано на биологических моделях разного рода – изолированных ферментах, клетках, тканях, лабораторных животных, и даже в клинических исследованиях [12–14]. Причем эффект ультрамалых доз развивается даже несмотря на присутствие эндогенных веществ в превышающих концентрациях в тестируемой биологической системе, что свидетельствует о важности не столько количества самого вещества, но о происходящем концентрационном сдвиге. В связи с этим можно полагать, что олигопептиды, эффективные в ультрамалых дозах, создают базу для разработки на их основе таких лекарственных препаратов, у которых, по сравнению с другими препаратами, будет значительно уменьшена выраженность побочных эффектов. Синтезированные олигопептиды, при введении их в состав лекарственных препаратов, будут способствовать развитию регенерационных процессов в ткани печени, что является существенным фактором при профилактике и лечении заболеваний печени.
Заключение
Полученные результаты исследования олигопептидов Т-1 и Т-2 открывают широкие перспективы для дальнейшего их изучения на организменном уровне с целью разработки в будущем лекарственных препаратов для лечения и профилактики различных патологий печени.
Библиографическая ссылка
Чалисова Н.И., Заломаева Е.С. ОЛИГОПЕПТИДЫ СТИМУЛИРУЮТ КЛЕТОЧНУЮ ПРОЛИФЕРАЦИЮ В КУЛЬТУРЕ ТКАНИ ПЕЧЕНИ КРЫС // Научное обозрение. Биологические науки. 2018. № 4. С. 33-37;URL: https://science-biology.ru/ru/article/view?id=1110 (дата обращения: 12.03.2026).


 science-review.ru
science-review.ru