Флора Узбекистана богата лекарственными растениями, в настоящее время изучены и описаны более 400 видов [1], из них 112 видов зарегистрированы для применения в научной медицине, из которых 70 видов растений активно используются в фармацевтической промышленности [2]. Известно, что терапевтический эффект лекарственных растений зависит от содержания в них биологически активных соединений: алкалоидов, гликозидов, лактонов, дубильных веществ, проантоцианидинов и др. [1]. Целебные свойства лекарственных растений на протяжении столетий подвергаются всестороннему изучению как в условиях естественного ареала их обитания, так и на экспериментальных базах и промышленных плантациях. Отметим, что природные ареалы лекарственных растений сокращаются из-за изменения климата и в связи с интенсивным освоением природных территорий, в то же время потребность в лекарственном сырье растёт. В связи с этим изучение влияния условий среды на физиологические характеристики и лекарственные свойства растений приобретает особую актуальность.
Дефицит влаги, засоленность почв, экстремально высокие температуры, недостаток или избыток света негативно сказываются на росте и развитии растений, создавая стрессовые условия. Одной из первых реакций на стресс является продукция активных форм кислорода (АФК). Обладая высокой реакционной способностью АФК вступают во взаимодействие со структурными элементами клеток и биологически активными веществами. В результате нарушается целостность и функциональность клетки. В процессе эволюции в растениях сформировалась антиоксидантная система (АОС) защиты для обезвреживания свободных радикалов. Антиоксидантная система растений состоит из ферментов (супероксиддисмутазы, каталазы, пероксидазы и др.) и низкомолекулярных антиоксидантов, таких как аскорбиновая кислота, токоферол, глутатион. Супероксиддисмутаза катализирует превращение супероксидных радикалов в перекись водорода, каталаза и пероксидаза утилизируют перекись водорода и тем самым являются ключевой линией защиты от токсического действия АФК. Ферменты уменьшают содержание свободных радикалов в клетке и не позволяют образоваться гидроксильному аниону [3]. Малоновый диальдегид (МДА) является конечным продуктом перекисного окисления липидов (ПОЛ) и характеризует процесс окисления липидов в клетке.
В ряде исследований отмечается активация ферментов АОС, в том числе каталазы, СОД и ПОД в ответ на увеличение АФК у Potentilla saundersiana, Kobersia pygmaea, Withania somnifera и Phyllantus amarus [4]. Засоление приводит к значительному возрастанию общей активности СОД, ПОД, КАТ в листьях и корнях Hyssopus officinalis [5]. Также отмечена индукция окислительного стресса и рост активности ферментов антиоксидантной системы (СОД, ПОД, КАТ) при засухе [6].
Вместе с тем реакции лекарственных растений ферментов АОС и общие закономерности ответа на комплекс факторов местообитания изучены недостаточно. Цель данного исследования – определение содержания МДА и изучение зависимости изменения активности СОД и ПОД у дикорастущих и произрастающих в условиях городской среды лекарственных растений (Artemisia annua, Matricaria chamomilla, Tanacetum vulgare).
Материалы и методы исследования
Объектами исследования являлись лекарственные растения трех видов – Artemisia annua, Matricaria chamomilla и Tanacetum vulgare.
Полынь однолетняя (Artemisia annua) – травянистое растение семейства Asteraceae. Встречается повсеместно плотно сформированными группами в зонах умеренного и субтропического климата, относится к ксеромезогалофитам, гелиосциофитам, предпочитает нейтральные почвы [7].
Ромашка аптечная (Matricaria chamomilla) – однолетнее травянистое растение семейства Asteraceae. Мезофит, гелиофит. Ромашка аптечная относится к светолюбивым растениям умеренного климата, широко распространена в Южной и Восточной Европе, Северной и Западной Азии [8].
Пижма обыкновенная (Tanacetum vulgare) – многолетнее травянистое растение семейства Asteraceae с характерным камфорным запахом. Ксерофит, гелиофит. Пижма отличается высокой степенью адаптивности, хорошо приживается на легких землях с большим количеством песка, предпочитает дренированные песчаные и супесчаные почвы. Встречается повсеместно небольшими группами [9].
Образцы растений отбирались в период вегетации 2018–2019 гг. в г. Ташкенте и в естественных местообитаниях горных районов Ташкентской области. Естественные условия произрастания исследуемых растений отличаются высокой инсоляцией, низкой водообеспеченностью и повышенной влажностью воздуха. Ташкент расположен на высоте 400–500 м над уровнем моря, природные сообщества ромашки были примерно на той же высоте, а полынь и пижма произрастали в горных районах на высоте 1100–1500 над уровнем моря.
Сбор образцов растений осуществлялся в утренние часы. Эксперименты проводились на свежесобранных растениях.
Активность супероксиддисмутазы определяли по ингибированию супероксидрадикала в реакции аутоокисления адреналина в щелочной среде in vitro при длине волны 347 нм с некоторыми модификациями [10]. Для этого к 2 мл 0,2 М бикарбонатного буфера, рН = 10,65, добавляли 0,1 мл 0,1 % (5,46 мМ) аптечного раствора адреналина гидрохлорида, тщательно и быстро перемешивали, помещали в спектрофотометр Cary UV 60 и определяли оптическую плотность через 30 с в течение 5 мин при длине волны 347 нм в кварцевой кювете толщиной 10 мм. Далее к 2 мл буфера (рН = 10,65) добавляли 0,1 мл источника фермента (растительный гомогенат), и 0,1 мл 0,1 % адреналина гидрохлорида, перемешивали и измеряли оптическую плотность, как описано выше (D2).
Гомогенат для определения СОД получали следующим образом: 100 мг листьев растений растирали в фарфоровой ступке с 1 мл 10 мМ трис HCl (pH 7,8). Центрифугировали при 7000 g при температуре +2, +4 °C в течение 15 мин. Полученный супернатант использовали как источник фермента.
Для исключения влияния собственной окраски экстрактов в качестве контрольной пробы использовали буферированный раствор экстракта, без адреналина.
Активность пероксидазы определяли по [11]. При приготовлении растительного материала навеску свежих листьев 200 мг растирали в ступке в ацетатном буфере рН 4,7 и переносили в мерную колбу на 50 мл. После 10 мин настаивания с периодическим помешиванием, в результате чего пероксидаза переходила в раствор, вытяжку центрифугируют при 4000–5000 об/мин. Надосадочную жидкость использовали для определения активности фермента.
В две кюветы вносят по 2,0 мл ферментного раствора, раствор бензидина в ацетатном буфере и воду. Измерения проводили на спектофотометре при 700 нм, принимая начальное значение оптической плотности опытной пробы за нуль. После добавления 0,03 % перекиси водорода момент достижения экстинкции Е = 0,125 или 0,250, фиксировали данные.
Определение малонового диальдегида осуществляли по модифицированному протоколу [12]: 100 мг растительного материала гомогенизировали в 2 мл 20 % трихлоруксусной кислоты (ТХУК). Полученный гомогенат центрифугировали 15 мин при 10000g, t = 4 °C. К 0,5 мл супернатанта добавляли 1,5 мл 0,5 % тиобарбитуровой кислоты (ТБК), растворенной в 20 % ТХУК. Образцы опытных проб инкубировали на водяной бане при 95 °C в течение 30 мин. Для исключения влияния собственной окраски экстрактов нами был поставлен контроль без ТБК, к 0,5 мл супернатанта добавляли 1,5 мл 20 % ТХУК.
После инкубации пробы охлаждали на ледяной бане и проводили измерения контрольных и опытных проб при длинах волн 532 нм и 600 нм на комбинированном ридере для микропланшет Synergy НТ.
Статистическая обработка данных проводилась в программе Origin 8.6 (Microcal Software Inc., Northampton MA). При оценке достоверности различий показателей использовали t-критерий Стьюдента. Различия считались достоверными при p < 0,05.
Результаты исследования и их обсуждение
Результаты измерений показали, что у растений, произрастающих в условиях городской среды, наблюдалось повышение активности ферментов АОС по сравнению с растениями из естественных местообитаний. У полыни однолетней, произрастающей в городских условиях, активность СОД в 1,3 раза выше по сравнению с горными образцами, 0,57 ± 0,005 и 0,45 ± 0,006 мМ адреналина/мин соответственно. Активность пероксидазы в условиях города была выше в 1,8 раз (0,034 ± 0,004 у.е.) относительно горных растений (0,019 ± 0,003 у.е.). Не выявлено статистически достоверных отличий в количестве МДА у полыни однолетней в условиях городской среды и в естественных местообитаниях (рис. 1).
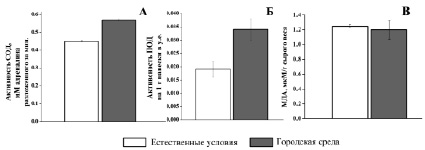
Рис. 1. А. Активность СОД (мМ адреналина разложенного за минуту). Б. Активность ПОД (на 1 г навески в у.е.). В. Содержание МДА (мкМ/г сырого веса) в листьях городской и дикорастущей Artemisia annua. n = 8, p < 0,05
Скорость окисления адреналина в образцах листьев дикорастущей ромашки аптечной составила 0,65 ± 0,007 мМ адреналина/мин, в то время как у городских растений активность СОД снижалась на 10 % и составила 0,59 ± 0,005 мМ адреналина/мин. Активность пероксидазы у Matricaria chamomilla, выращенной в черте города составила 0,007 ± 0,0003 у.е., а у дикорастущих растений этот показатель был 0,002 ± 0,0002. Количество МДА в растениях в условиях городской среды было в 1,6 раз выше по сравнению с горными образцами (рис. 2).
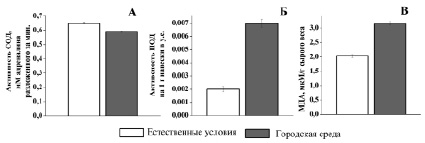
Рис. 2. А. Активность СОД (мМ адреналина разложенного за минуту). Б. Активность ПОД (на 1 г навески в у.е.). В. Содержание МДА (мкМ/г сырого веса) в листьях городской и дикорастущей Matricaria chamomilla. n = 8, p < 0,05
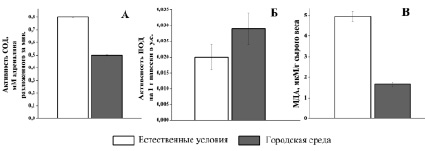
Рис. 3. А. Содержание МДА (мкМ/г сырого веса) в листьях городской и дикорастущей Tanacetum vulgare. Б. Активность СОД (мМ адреналина разложенного за минуту). В. Активность ПОД (на 1 г навески в у.е.); n = 8, p < 0,05
Эксперименты по определению супероксиддисмутазной активности в листьях пижмы обыкновенной показали, что в условиях естественного произрастания активность СОД была выше в 1,5 раза по сравнению с растениями, собранными в условиях городской среды, и составила 0,5 ± 0,004 и 0,8 ± 0,003 мМ адреналина/мин соответственно. Активность пероксидазы для растений, произрастающих в черте города, составила 0,029 ± 0,005 у.е., а для дикорастущих – 0,02 ± 0,004 у.е. Выявлено, что содержание МДА в листьях дикорастущей пижмы было в 3 раза больше по сравнению с растениями, произрастающими в городской среде (рис. 3).
Известно, что под действием стресса в ответ на генерацию АФК происходит активация антиоксидантной системы организма, при этом информация об активности отдельных ферментов весьма противоречива. Так, активность СОД при действии неблагоприятных факторов меняется разнонаправленно; в одних случаях отмечено ее увеличение, в других – снижение, что зависит от напряженности действия стрессового фактора (интенсивности и длительности воздействия), от восприимчивости организма, стадии развития растений и др. [13].
Наблюдаемое повышение активности СОД и ПОД в листьях Artemisia annua в условиях городской среды, вероятно, указывает на развитие стрессовой реакции в ответ на воздействие загрязнения, сухости воздушной среды и высоких температур в городе. Подобная реакция отмечается во многих исследованиях. Так, в неблагоприятных условиях, например при повышенном содержании солей в среде [5], отсутствии регулярного полива [6], при высоких температурах [14] происходит повышение активности СОД. При этом, эффективная работа супероксиддисмутазы и пероксидазы привела к тому, что уровень ПОЛ у городских растений сохранялся на том же уровне, как и у растений в естественных местообитаниях.
В экспериментах по определению активности СОД у Matricaria chamomilla не было зафиксировано статистически достоверных отличий в условиях природного ареала и города. Вместе с тем активность ПОД была выше у растений в городе, что обуславливается действием неблагоприятных факторов, характерных для г. Ташкента. Так, в условиях антропогенной нагрузки было выявлено, что клетки Matricaria chamomilla подвергаются более сильному повреждению наряду с другими растениями, что проявляется увеличением количества оснований Шиффа и диеновых конъюгатов на 40–60 % по сравнению с контролем [15]. На активность ферментов АОС также влияет устойчивость растений: так в условиях недостатка влаги у засухоустойчивого сорта пшеницы активность СОД вдвое превышала контрольные значения, в то время как у неустойчивого была в 2 раза ниже, чем в контроле [16]. Высокий уровень МДА у городской ромашки коррелирует с данными активности СОД.
Активность СОД у Tanacetum vulgare, произрастающей в условиях города, была снижена по сравнению с горными растениями, а активность пероксидазы была повышена у городских растений. В условиях стресса активность СОД может не только повышаться, но и снижаться, например при длительном и интенсивном воздействии солевого стресса, теплового стресса, при водном дефиците и др. [13]. На фоне несогласованной работы ферментов АОС в растениях, собранных в естественном ареале, наблюдалось увеличение количества МДА. Полученные результаты позволяют предположить, что низкий уровень МДА в городских растениях относительно горных поддерживается за счет работы ПОД, а также других систем АОС.
Таким образом, можно заключить, что антиоксидантная система исследованных лекарственных растений по-разному реагирует на условия окружающей среды. Показатели уровней активности ферментов АОС могут быть использованы в практических целях в качестве маркеров устойчивости в конкретных условиях обитания или культивирования.
Библиографическая ссылка
Рахматуллина Н.Ш., Акиншина Н.Г., Азизов А.А., Раджабова Г.Г. ПОКАЗАТЕЛИ АНТИОКСИДАНТНОЙ СИСТЕМЫ ARTEMISIA ANNUA L., MATRICARIA CHAMOMILLA L. И TANACETUM VULGARE L. В ЕСТЕСТВЕННЫХ УСЛОВИЯХ ПРОИЗРАСТАНИЯ И В ГОРОДСКОЙ СРЕДЕ // Научное обозрение. Биологические науки. 2020. № 4. С. 28-32;URL: https://science-biology.ru/ru/article/view?id=1210 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/srbs.1210


 science-review.ru
science-review.ru