В последнее время в нашей стране много внимания уделяется развитию цветоводства и получению качественной цветочной продукции. Ведущее место среди растений, которые выращиваются в открытом грунте, принадлежит гладиолусу, так как это одна из наиболее декоративных цветочных культур [1]. Микроклональное размножение является одним из современных методов, который позволяет получать значительное количество материала из небольших фрагментов ткани в течение относительно короткого промежутка времени [2].
Гладиолус гибридный среди клубнелуковичных растений относится к одной из наиболее подверженных различным заболеваниям цветочных культур. Особое внимание в работах по клональному размножению уделяется разработке метода, который позволит повысить коэффициент размножения свободных от инфекции и генетически стабильных растений, в селекционных работах – для создания новых и улучшения существующих сортов [3, 4].
Цель исследования: оценить возможность использования клубнелуковиц (верхушечных и пазушных почек) в качестве первичного экспланта при клональном микроразмножении сортов гладиолуса селекции Учебного ботанического сада Пермского государственного национального исследовательского университета.
Материалы и методы исследования
Исследования были проведены в 2018 г. в лаборатории микроклонального размножения кафедры ботаники и генетики растений Пермского государственного национального исследовательского университета. Объектами исследования были выбраны 4 сорта Gladiolus×hybridus hort. (рис. 1).

а б в г
Рис. 1. Изученные сорта гладиолуса: а – «Селенит»; б – «Уралочка»; в – «Седой Урал»; г – «Пермский сувенир»
Сорт «Селенит» (413-С-18 Черткова, Шумихин) получен в результате скрещивания сортов «Golden Wave» (416-С-89) и «Долгожданный дебют» (543-С-84). Высота растения в период массового цветения достигает 155–165 см, а длина соцветия – 55–65 см. Соцветие двурядное, плотное, имеет 16–19 цветков, из которых одновременно раскрыты 6–7. Цветки имеют нежно-желтый цвет и карминно-малиновое пятно на нижних долях околоцветника. Характерна плотная фактура листочков. Растение имеет средний срок цветения. Оценка декоративных признаков составляет 97 баллов, хозяйственно ценных признаков – 38 баллов [5].
Сорт «Уралочка» (201-ОР-18 Черткова, Шумихин) получен в результате скрещивания сортов «Abbie» (399-СР-79) и «Ленгвинис» (475-С-91). В период массового цветения высота растений достигает 110–125 см, длина соцветия – 54–57 см. Соцветие очередное, плотное, имеет 14–16 цветков, из которых одновременно раскрыты 6–8. Цветки бледно-пурпурно-розовые, имеют пурпурно-желтое пятно на нижних долях околоцветника, гофрированные с плотной фактурой листочков. Сорт имеет очень ранний срок цветения. Оценка декоративных признаков составляет 98 баллов, хозяйственно ценных качеств ― 41 балл [6].
Сорт «Седой Урал» (300-С-18 Черткова, Шумихин) получен в результате скрещивания сортов «Si Foam» (500-РС-80) и «Медовый Спас» (327-С-97). В период массового цветения высота растений достигает 105–120 см, длина соцветия – 55–60 см. Соцветие двурядное, плотное, имеет 13–16 цветков, из которых одновременно раскрыты 6–9. Цветки белого цвета, имеют пурпурно-красные полосы на нижних долях околоцветника, гофрированные, с плотной фактурой листочков. Растение имеет средний срок цветения. Оценка декоративных признаков составляет 96 баллов, хозяйственно ценных качеств – 37 баллов [7].
Сорт «Пермский сувенир» (365-ОР-18 Черткова, Шумихин) получен в результате скрещивания сортов «Si Foam» (500-РС-80) и «Медовый Спас» (327-С-97). В период массового цветения высота растений составляет 105–120 см, длина соцветия – 58–61 см. Цветки светло-сиреневые, имеют яркое желто-малиновое пятно на нижних долях околоцветника, край ровный, с небольшими защипами. Соцветие очередное плотное, содержит 14–17 цветков, из которых одновременно раскрыты 7–8. Оценка декоративных признаков составляет 97 баллов, оценка хозяйственно ценных качеств – 44 балла [8].
В качестве эксплантов использовались апикальные или пазушные почки клубнелуковиц. Всего было высажено 327 эксплантов. Для стерилизации материала применяли 3 режима, отличающиеся по времени нахождения в нейтральном детергенте и стерилизующем агенте и времени вычленения почек.
Экспланты высаживали в пробирки на твердую питательную среду, наиболее часто используемую для культуры растительных тканей, имеющую минеральную основу по Т. Murashige и F. Skoog (MS) [9]. В среду добавлялись 2 % (у первого варианта среды) или 3 % сахароза и 0,7 % агар. Также в среду вносились витамины по Р.Г. Бутенко [10] и регуляторы роста: β-индолилуксусная кислота (ИУК) в концентрации 0,1 и 0,5 мг/л; α-нафтилуксусная кислота (НУК) в концентрации 1 и 10 мг/л; 6-бензиламинопурин (6-БАП) в концентрациях 0,5 и 2 мг/л. В исследовании использовались 5 вариантов среды, отличающихся соотношением витаминов и фитогормонов (табл. 1).
Таблица 1
Варианты питательной среды Мурасиге и Скуга для микроклонального размножения гладиолуса
|
Вариант среды |
Витамины, мг/л |
Фитогормоны |
|
|
Ауксины, мг/л |
Цитокинины, мг/л |
||
|
1 |
+ |
ИУК – 0,5 |
– |
|
2 |
+ |
ИУК – 0,1 |
– |
|
3 |
+ |
НУК – 1 |
6-БАП – 2 |
|
4 |
+ |
– |
– |
|
5 |
+ |
НУК – 10 |
6-БАП – 0.5 |
Примечание. + витамины по Р.Г. Бутенко 0,1 мг/л тиамин, 0,5 мг/л пиридоксин, 0,5 мг/л никотиновая кислота; прочерк означает отсутствие витаминов и/или регуляторов роста.
Стерилизацию питательной среды проводили в автоклаве под давлением 1,1 атм и при температуре +120 °С в течение 15 мин. Стерилизацию инструментов, культуральных сосудов и оборудования осуществляли согласно общепринятой методике [10]. Посадка эксплантов на питательную среду проводилась в ламинар-боксе при соблюдении правил работы со стерильным материалом. Пробирки с эксплантами помещались в климатическую камеру марки «Binder KBF LQC 240», в которой был установлен режим с фотопериодом 14/10 и температурой – +20 ± 2 °С.
Материал, который имел признаки инфицирования, выбраковывался через 7–21 день. Проводилось определение отношения числа стерильных эксплантов к общему числу объектов, подвергнутых стерилизации. Для оценки жизнеспособности эксплантов рассчитывалось в процентах число стерильных объектов, имеющих признаки регенерации, к общему количеству стерильного материала. Статистическая обработка данных проводилась с использованием стандартного пакета анализа Microsoft Office Exсel. Различия по критерию Фишера считали статистически значимыми при p < 0,05.
Результаты исследования и их обсуждение
Основными стерилизующими агентами выбраны 7 % раствор гипохлорита натрия с экспозицией 15–25 мин и 96 % этиловый спирт с экспозицией 30–60 с. Режимы стерилизации эксплантов представлены в табл. 2.
Таблица 2
Режимы стерилизации эксплантов гладиолуса
|
Режим стерилизации |
Этапы |
||
|
Престерилизация |
Стерилизация |
Постстерилизация |
|
|
I |
Раствор нейтрального детергента (стиральный порошок «Капель») 40 мин; промывка проточной водой 10 мин |
7 % раствор гипохлорита натрия («Белизна») 15 мин, 96 % этанол 30 с |
Стерилизованная дистиллированная вода, три смены по 5 мин в каждой |
|
II |
Раствор нейтрального детергента (стиральный порошок «Капель») 50 мин; промывка проточной водой 15 мин |
7 % раствор гипохлорита натрия («Белизна») 20 мин, 96 % этанол 60 с |
|
|
III |
Раствор нейтрального детергента (стиральный порошок «Капель») 60 мин; промывка проточной водой 15 мин |
7 % раствор гипохлорита натрия («Белизна») 25 мин, 96 % этанол 60 с |
|
Фрагменты клубнелуковиц, имеющие 1 верхушечную или 1–2 пазушные почки, высаживались на питательную среду MS с 21 мая по 7 июня 2018 г. Использовались следующие режимы стерилизации: I (разделение на фрагменты после стерилизации) – для 1 и 2 варианта среды, II (разделение на фрагменты после стерилизации) – для 3 варианта, II (разделение на фрагменты до стерилизации) – для 4 варианта, III (разделение на фрагменты до стерилизации) – для 5 варианта. Выход стерильной культуры представлен на рис. 2.
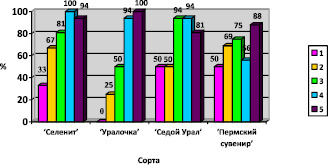
Рис. 2. Процент выхода стерильной культуры клубнелуковиц гладиолуса. Примечание. 1 – MS с добавлением ИУК 0,5 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 2 – MS с добавлением ИУК 0,5 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 3 – MS с добавлением 6-БАП 2 мг/л, НУК 1 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 4 – MS с добавлением тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 5 – MS с добавлением 6-БАП 0,5 мг/л, НУК 1 мг/л, никотиновой кислоты 0,5 мг/л
Исходя из данных, представленных на рис. 2, можно сделать заключение, что все экспланты были стерильными у сорта «Селенит» на четвертом варианте среды MS без добавления регуляторов роста и у сорта «Уралочка» на пятом варианте среды MS с добавлением 6-БАП в концентрации 0,5 мг/л и НУК в концентрации 1 мг/л. Наиболее высокий процент выхода стерильной культуры у сорта «Пермский сувенир» наблюдался на пятом варианте среды MS и составил 94. Для сорта «Седой Урал» высокий процент выхода стерильной культуры отмечается на третьем (с добавлением 6-БАП в концентрации 2 мг/л и НУК в концентрации 1 мг/л) и четвертом вариантах среды – 94. Для получения стерильной культуры у сортов «Селенит» и «Уралочка» могут быть использованы 4 (p = 0,00, p < 0,05) и 5 (p = 0,01, p < 0,05) варианты среды. Для сорта «Пермский сувенир» могут быть использованы все варианты среды, так как между ними нет достоверных различий (p = 0,41, p < 0,05). Для сорта «Седой Урал» подходит 3 (p = 0,00, p < 0,05) и 4 (p = 0,00, p < 0,05) варианты среды.
При использовании I режима стерилизации выход стерильной культуры был достоверно ниже (p = 0,72, p < 0,05) у трёх изученных сортов – «Селенит», «Уралочка», «Седой Урал». Он не превышал 50 %, за исключением сорта «Селенит», у которого на 2 варианте среды MS с добавлением витаминов и ИУК в концентрации 0,5 мг/л этот показатель составил 67 %. В работе Т.Д. Чемаровой [11] при использовании для микроклонального размножения этих трех сортов в качестве экспланта клубнепочек и применении аналогичного режима стерилизации выход стерильной культуры составил более 65,5 %.
Прорастание клубнелуковиц у сорта «Пермский сувенир» начинается через 7 дней после посадки на питательную среду MS, у остальных изученных сортов – через 14 дней после посадки (рис. 3).




а б в г
Рис. 3. Клубнелуковицы гладиолуса: а – до посадки; б – на момент посадки; в – через 14 дней после посадки; г – через 21 день после посадки
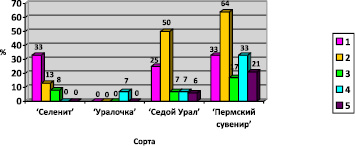
Рис. 4. Процент выхода жизнеспособных клубнелуковиц. Примечание. 1 – MS с добавлением ИУК 0,5 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 2 – MS с добавлением ИУК 0,5 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 3 – MS с добавлением 6-БАП 2 мг/л, НУК 1 мг/л, тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 4 – MS с добавлением тиамина 0,1 мг/л, пиридоксина 0,5 мг/л, никотиновой кислоты 0,5 мг/л; 5 – MS с добавлением 6-БАП 0,5 мг/л, НУК 1 мг/л, никотиновой кислоты 0,5 мг/л
Жизнеспособность клубнелуковиц у всех сортов оказалась низкой. Она варьирует от 0 до 50 %. Только для сорта «Пермский сувенир» этот показатель составил 64 % на первом варианте среды с добавлением ИУК в концентрации 0,5 мг/л (p = 0,00, p < 0,05) (рис. 4).
М.П. Лапинская [12] в своих исследованиях использует варианты среды MS с различными регуляторами роста: α-нафтилуксусную кислоту (НУК), тиадиазурон (ТДг), ИУК, индолилмаслянную кислоту (ИМК), 6-БАП, зеатин, кинетин, 2-изопентиладенин (2-1Р). Применение 6-БАП оказалось эффективным для большинства исследованных ею сортов. Экспланты гладиолуса показали хорошие результаты при добавлении в питательную среду данного фитогормона в диапазоне концентраций от 0,5 до 3 мг/л. Зеатин, кинетин и тидиазурон оказались по сравнению с 6-БАП менее эффективными. В результате наших исследований не выявлено высокой эффективности применения 6-БАП для данных сортов гладиолуса.
Заключение
Для стерилизации клубнелуковиц у всех изученных сортов гладиолуса можно использовать: раствор нейтрального детергента в течение 50–60 мин и промывку проточной водой в течение 15 мин – на этапе престерилизации; 7 % раствор гипохлорита натрия («Белизна») в течение 20–25 мин и 96 % этиловый спирт в течение 60 с – на этапе стерилизации. Выделение апикальной и пазушной почек необходимо проводить до стерилизации. Максимальный выход стерильной культуры варьирует от 88 до 100 % в зависимости от сорта. При использовании в качестве экспланта клубнелуковицы на всех вариантах среды MS отмечается низкий выход жизнеспособных эксплантов, не более 64 %.
Библиографическая ссылка
Шибанова Н.Л., Чемарова Т.Д. ИСПОЛЬЗОВАНИЕ КЛУБНЕЛУКОВИЦ ПРИ МИКРОКЛОНАЛЬНОМ РАЗМНОЖЕНИИ СОРТОВ ГЛАДИОЛУСА (GLADIOLUS Х HYBRIDUS HORT.) СЕЛЕКЦИИ УЧЕБНОГО БОТАНИЧЕСКОГО САДА ПГНИУ // Научное обозрение. Биологические науки. 2020. № 4. С. 43-48;URL: https://science-biology.ru/ru/article/view?id=1213 (дата обращения: 07.03.2026).


 science-review.ru
science-review.ru