Животноводство является основным фактором, способствующим развитию национального благосостояния различных стран мира. Так, по данным ФАО, животноводство поставляет половину сельскохозяйственной продукции и обеспечивает население продовольственными и непродовольственными товарами (шерстью, кожей, шкурами), которые составляют около 20 % сельскохозяйственного ВВП [1]. Основным сдерживающим фактором развития животноводства многих странах мира является недостаточность кормовой базы [2]. Получение полноценных и дешевых кормов возможно путем развития кормопроизводства с использованием кормобобовых культур, которые дают большой урожай зеленой массы с высоким содержанием протеина [3]. Основными кормобобовыми культурами являются люцерна и донник [4]. Люцерна, одна из наиболее ценных кормобобовых культур, отличается долголетием, многоукосностью и дает высокий урожай зеленой массы. Корма из люцерны богаты растительным белком, который содержит необходимые аминокислоты, каротин, кальций, витамин и другие важные элементы питания [5]. Другой не менее важной культурой является донник, который недостаточно используется в кормопроизводстве. Донник обладает комплексом ценных хозяйственных и эколого-биологических особенностей: нетребователен к почвам, обладает зимостойкостью, дает высокий урожай раннего корма в засушливых условиях и является солеустойчивой культурой [6]. Помимо высокой кормовой ценности, эти культуры способствуют накоплению биологического азота и гумуса в почве. Однако при выращивании донника и люцерны существует проблема низкой всхожести семян, связанная с тем, что семена этих культур имеют очень плотную и твердую оболочку, препятствующую их прорастанию (твердокаменность семян) [7].
Для решения проблемы низкой всхожести семян применяются различные способы. Наиболее часто используют скарификацию – механическое разрушение оболочки семян с использованием специальных машин – скарификаторов [8]. Однако при применении этого способа очень часто происходит повреждение эндосперма и зародыша семян, что приводит к их поражению фитопатогенами, вызывает плесневение и загнивание проростков и, как следствие, приводит к гибели большей части посевного материала. Также скарификация – это дорогостоящий процесс, требующий специального оборудования, значительных материальных и энергетических затрат. Одним из наиболее перспективных решений этой проблемы является применение биологических препаратов на основе целлюлолитических бактерий для повышения всхожести семян. Эти бактерии синтезируют особые ферменты – целлюлазы, которые способны частично нарушать целостность твердой оболочки семян и тем самым повышать их всхожесть. Для разработки биопрепаратов такого действия необходимо выделить целлюлолитические бактерии из природных субстратов и получить новые штаммы с высокой целлюлазной активностью.
Целями настоящего исследования были выделение из природных источников целлюлолитических бактерий, получение чистых культур, изучение их основных культуральных и биохимических свойств и отбор наиболее активных штаммов, перспективных для создания биоудобрения под кормобобовые культуры донник и люцерну.
Материалы и методы исследования
Объектами исследования служили целлюлолитические бактерии, выделенные из образцов почв и целлюлозосодержащих растительных остатков (разложившихся стеблей, листьев, корешков растений), собранных на полях донника и люцерны в Алматинской области Казахстана.
Полевой сбор почв проводили в соответствии с ГОСТ [9]. Точечные пробы (в количестве 5 штук) отбирали на пробной площадке из одного почвенного горизонта (8–10 см) методом конверта. Объединенную пробу составляли путем смешивания пяти точечных проб массой от 200 до 250 г каждая, отобранных на одной пробной площадке. Образцы почв для выделения микроорганизмов отбирали с соблюдением правил асептики. Сбор целлюлозосодержащих разложившихся растительных остатков из ризосферы растений проводили стерильным пинцетом и помещали в стерильную тару.
Целлюлолитические бактерии выделяли на элективной среде Гетчинсона с фильтровальной бумагой, взятой в качестве единственного источника углерода и энергии. Для выделения бактерий 15 г почвы разводили в 90 мл дистиллированной стерильной воды и перемешивали в шейкере при 180 об/мин в течение 2 ч. Далее проводили серию разведений, переносив 1 мл полученной суспензии в пробирку, содержащую 9 мл стерильной воды, и так до разведения 10-8. Посев микроорганизмов проводили из разведений 10-4, 10-5, 10-6, 10-7 и 10-8 в чашки Петри с агаризованной средой Гетчинсона, на поверхность которой помещали стерильную фильтровальную бумагу. Объем посевного материала составлял 1 мл почвенной суспензии. При выделении бактерий из разложившихся природных субстратов на фильтровальную бумагу помещали кусочки величиной 1–2 мм. Затем фильтровальную бумагу и кусочки субстратов увлажняли жидкой средой Гетчинсона [10]. Каждое разведение высевали в пятикратной повторности. Засеянные чашки инкубировали в термостате при 28 °С в течение 10 дней [11].
Чистые культуры бактерий получали путем ряда последовательных пересевов на среду Гетчинсона с полоской фильтровальной бумаги (1×10 см) и на агаризованную среду с водорастворимой целлюлозой – Na-карбоксиметилцеллюлозой (Na-КМЦ).
Культивирование целлюлолитических бактерий проводили на жидкой элективной среде Гетчинсона в шейкере при 180 об/мин и на твердых питательных средах (среде Гетчинсона, МПА) при температуре 28 °С.
Учет численности целлюлолитических бактерий в почве проводили методом предельных разведений. Культивирование целлюлолитических бактерий осуществляли в шейкере-инкубаторе при 28 °С и 180 об/мин.
Чистоту культур микроорганизмов проверяли визуально и под микроскопом. Микроскопический контроль осуществляли с препаратами живых и фиксированных окрашенных клеток при помощи светового микроскопа с выходом на монитор компьютера.
Культуральные и физиолого-биохимические свойства для идентификации целлюлолитических бактерий исследовали по стандартным методикам [12].
Статистическая обработка результатов проводилась с использованием пакета программ «STATISTICA 10.0» [13].
Результаты исследования и их обсуждение
Для выделения целлюлолитических бактерий был проведен сбор образцов почв и целлюлозосодержащих растительных остатков (разложившихся стеблей, листьев, корней растений) на полях Алматинской области Казахстана. В общей сложности было собрано 84 образца природных субстратов, из них 46 образцов почвы и 38 целлюлозосодержащих растительных остатков. Образцы отбирали с соблюдением правил асептики.
Отбор почв и растительных остатков проводили на полях крестьянских хозяйств с высоким уровнем агротехники выращивания донника и люцерны. Из собранных образцов в лабораторных условиях на элективной среде Гетчинсона с фильтровальной бумагой осуществляли выделение целлюлолитических бактерий.
Установлено, что численность целлюлолитических бактерий в почвенных образцах была высокой и колебалась пределах от 104 до 105 КОЕ г/почвы (табл. 1).
Таблица 1
Численность целлюлолитических бактерий в почвах на полях с донником и люцерной в (Алматинская область, Казахстан, 2020 г.)
|
Почва |
Численность микроорганизмов, КОЕ г/почвы |
|
|
ОМЧ* |
ЦЛБ** |
|
|
Енбекшиказахский район |
2,7 ± 0,2×108 |
3,3 ± 0,2×105 |
|
Карасайский район |
3,9 ± 0,3×107 |
4,1 ± 0,1×104 |
|
Талгарский район |
4,6 ± 0,32×108 |
2,8 ± 0,2×105 |
Примечание: уровень доверительной вероятности р ≤ 0,05; * – общее микробное число; ** – целлюлолитические бактерии.
Высокая численность целлюлолитических бактерий в почве является одной из ее положительных характеристик, так как известно, что именно представителям этой группы микроорганизмов принадлежит основная роль в круговороте углерода в природе и они отвечают за поддержание плодородия почвы. Также высокое содержание целлюлолитических бактерий в почве свидетельствует о высокой агротехнике ведения сельского хозяйства. Кроме того, целлюлолитические бактерии, находясь в почве, обогащают ее легкодоступными элементами питания, делают почву плодородной и поставляют растениям продукты своей жизнедеятельности, такие как ферменты, витамины, аминокислоты и иные, что положительно влияет на урожайность агрокультур [14, 15].
В лабораторных условиях из собранных образцов почвы и растительных остатков было проведено выделение целлюлолитических бактерий. Получение чистых культур бактерий осуществляли путем последовательных пересевов на среду Гетчинсона с полоской фильтровальной бумаги и длительным пассированием на твердой агаризованной среде Гетчинсона с Na-КМЦ до образования отдельно стоящих колоний, из которых выделяли чистые культуры бактерий.
Чистоту выделенных бактерий проверяли визуально и под микроскопом. В результате проведенной работы было выделено 54 чистые культуры целлюлолитических бактерий. Далее были изучены их основные культурально-морфологические и биохимические признаки.
Установлено, что выделенные культуры бактерий имели существенные отличия в культурально-морфологических свойствах. Колонии бактерий, в основном, были круглые с выпуклым профилем и ровным краем, от 1,1 до 2,7 мм в диаметре с мелкозернистой структурой. Цвет колоний был преимущественно молочный, кремовый, консистенция колоний различалась.
Исследование морфологии клеток показало, что целлюлолитические бактерии были как спорообразующими бактериями, так и неспорообразующими. Однако спорообразующие бактерии встречались значительно чаще. Форма клеток бактерий была, в основном, палочковидная, у некоторых штаммов с возрастом клетки приобретали кокковидную форму. Бактерии были преимущественно грамположительными подвижными палочками, реже встречались грамотрицательные культуры (рисунок).
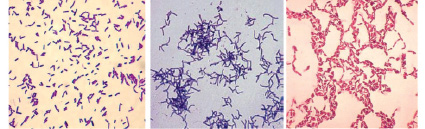
Формы клеток целлюлолитических бактерий (ув. х 1800)
Исследование биохимических признаков бактерий показало, что все исследуемые культуры были каталазоположительными, аэробными или факультативными анаэробными бактериями. Установлено, что штаммы бактерий характеризовались различной способностью использовать соединения углерода для своего конструктивного и энергетического метаболизма.
На основе изучения культурально-морфологических и биохимических признаков выделенные культуры целлюлолитических бактерий были идентифицированы и отнесены к родам Bacillus, Pseudomonas, Bacterium и Cellulomonas.
Далее был проведен первичный скрининг бактерий по признаку активности целлюлитических ферментов. В работе использовали метод, основанный на гидролизе водорастворимой целлюлозы целлюлолитическими бактериями.
Первичный скрининг целлюлолитических бактерий показал, что из 54 чистых культур только 20 штаммов обладают повышенной активностью целлюлаз. Результаты целлюлазной (КМЦ-аза) активности наиболее перспективных штаммов представлены в табл. 2.
Из данных табл. 2 следует, что из 20 штаммов бактерий 10 культур характеризовались средним уровнем активности целлюлаз (3,1–3,5 ед/мл), 6 штаммов обладали активностью выше средней (3,6–4,4 ед/мл) и 4 штамма (С-21E, С-21N2, С-21(8)N, С-22TN) характеризовались высокой активностью целлюлаз (4,5–4,6 ед/мл). Для дальнейшей работы были отобраны 10 штаммов бактерий, у которых активность целлюлаз была выше средней и высокой.
Таблица 2
Изучение целлюлазной активности штаммов бактерий
|
Штаммы бактерий |
КМЦ-азная активность, ед/мл |
|
С- 02E |
3,1 ± 0,01 |
|
С-08K |
3,3 ± 0,03 |
|
С-08N |
3,4 ± 0,02 |
|
С-09K |
3,0 ± 0,01 |
|
С-14Т |
3,5 ± 0,02 |
|
С-18T |
3,7 ± 0,02 |
|
С-20/2K |
3,1 ± 0,01 |
|
С-20/3K |
3,6 ± 0,02 |
|
С-20T |
4,2 ± 0,03 |
|
С-21E |
4,5 ± 0,02 |
|
С-21N2 |
4,6 ± 0,01 |
|
С-21(8)N |
4,5 ± 0,03 |
|
С-21(1)N |
3,8 ± 0,02 |
|
С-22T |
3,4 ± 0,01 |
|
С-22TN |
4,6 ± 0,02 |
|
С-33K |
3,3 ± 0,01 |
|
С-34N |
4,0 ± 0,01 |
|
С-36E |
4,1 ± 0,02 |
|
С-46K |
4,1 ± 0,02 |
|
С-54T |
4,2 ± 0,02 |
Примечание: уровень достоверной вероятности р ≤ 0,01.
Заключение
Таким образом, проведен сбор образцов почв и целлюлозосодержащих растительных остатков на полях Алматинской области Казахстана. В общей сложности было собрано 84 образца, из них 46 образцов почв и 38 образцов целлюлозосодержащих растительных остатков. В лабораторных условиях из собранных образцов провели выделение целлюлолитических бактерий на элективной среде Гетчинсона. В результате проведенной работы было выделено 54 чистые культуры целлюлолитических бактерий. Провели изучение их основных культурально-морфологических и биохимических признаков, которое позволило определить таксономическую принадлежность целлюлолитических бактерий. Установлено, что выделенные культуры целлюлолитических бактерий относятся к родам Bacillus, Pseudomonas, Bacterium и Cellulomonas. Проведен первичный скрининг бактерий по признаку целлюлазной активности. Установлено, что из 54 культур только 20 штаммов бактерий обладали повышенной активностью целлюлаз. В результате скрининга отобрано 10 штаммов бактерий, обладающих средней и высокой степенью целлюлазной активности. Отобранные для дальнейших исследований штаммы целлюлолитических бактерий будут использованы для создания биопрепаратов, повышающих всхожесть семян донника и люцерны.
Исследование выполнено при финансовой поддержке Министерства образования и науки Республики Казахстан в рамках грантового проекта AP08855656.
Библиографическая ссылка
Смирнова И.Э., Саданов А.К. ЦЕЛЛЮЛОЛИТИЧЕСКИЕ БАКТЕРИИ, ПЕРСПЕКТИВНЫЕ ДЛЯ СОЗДАНИЯ БИОУДОБРЕНИЯ ПОД КОРМОБОБОВЫЕ КУЛЬТУРЫ // Научное обозрение. Биологические науки. 2021. № 1. С. 22-26;URL: https://science-biology.ru/ru/article/view?id=1220 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/srbs.1220


 science-review.ru
science-review.ru