В 1991 г. в коре головного мозга крыс был обнаружен белок, названный авторами «серотонин-модулируемый антиконсолидационный белок» (СМАБ), обладающий способностью негативно влиять на процессы обучения и формирование долговременной памяти у животных (консолидацию следов памяти). В частности, при ежедневном введении белка в желудочек мозга за 40 мин до сеанса обучения у крыс нарушалось формирование следов памяти в многоразовой модели челночной камеры с электроболевым подкреплением [1], а также в условно-рефлекторной модели чередования побежек с пищевым подкреплением [2]. Было показано также негативное влияние белка на формирование долговременной памяти у костистых рыб (карпа Cyprinus carpio и серебряного карася Carassius auratus): его введение в 4-й желудочек мозга снижало способность рыб к обучению и нарушало формирование пространственной памяти у рыб в лабиринте с пищевым подкреплением [3].
Позднéе применение электрофореза в денатурирующих условиях с последующей масс-спектрометрией MALDI-TOF позволило идентифицировать несколько белковых фракций, входящих в состав СМАБ. Поскольку все изученные фракции, кроме одной, оказались структурными белками, было предположено, что негативный эффект СМАБ на формирование памяти у животных вызывает фракция, идентифицированная как дигидропиримидиназа-подобный белок-2 (dihydropyrimidinase-related protein 2, DPYL2, или CRMP2) [3]. Это внутриклеточный нейроспецифичный белок массой 62 кДа относится к небольшому семейству цитозольных белков, известных как медиаторы Sema3A сигналинга и нейрональной дифференциации. Биологическая функция DPYL2 – участие в развитии и поляризации нейронов, регуляции роста аксонов и клеточной миграции [4].
В опытах по обучению рыб условному рефлексу с пищевым подкреплением нами было визуально отмечено, что карпы опытной группы, которым вводили нативный DPYL2, несколько снижали пищевую активность по сравнению с особями из группы активного контроля, инъецированными инактивированным белком. В случае если бы такое влияние имело место, модели обучения рыб с пищевым подкреплением не могли бы рассматриваться как адекватные для исследования эффектов DPYL2 на формирование памяти либо должны применяться осмотрительно, с поправками на его побочные, неспецифические эффекты. Однако экспериментов, поставленных специально с целью изучения влияния DPYL2 на пищевую мотивацию у рыб, до настоящего времени поставлено не было.
Цель исследования: установить, оказывает ли DPYL2 влияние на пищевую активность молоди серебряного карася, в двух различных схемах экспериментов, моделирующих: 1) поиск и потребление корма отдельными особями в лабиринте и 2) поиск и потребление корма, расположенного в виде «кормовых пятен» в грунте, группой особей.
Материалы и методы исследования
Эксперимент 1 проводили в мае 2013 г. на молоди (0+) серебряного карася Carassius auratus массой 7,8–9,7 г. Эксперимент 2 проводили в феврале – марте 2020 г. на молоди (0+) серебряного карася Carassius auratus массой 7,1–10,6 г. Молодь рыб была получена из прудов экспериментальной прудовой базы ИБВВ РАН «Сунога» (п. Борок, Ярославская обл., Россия). Отловленные в сентябре особи содержались в течение осенне-зимнего периода в условиях аквариальной вплоть до начала экспериментов: в аквариуме объёмом 200 л с проточной водой, при естественном освещении, с кормлением один раз в сутки искусственным желированным кормом ad libitum. Перед началом первого эксперимента формировали 3 группы рыб: интактную, опытную и группу активного контроля, по 8 особей в каждой. Рыб помещали в индивидуальные контейнеры ёмкостью 4 л, с аэрируемой водой. Температура воды 18–19 °С, освещение искусственное (10 ч «свет»: 14 ч «темнота»). Рыб в течение 7 сут акклимировали к данным условиям, кормили раз в сутки личинками Chironomus sp. ad libitum, после чего особей двух групп (опытной и контрольной) подвергали инъекции препаратов.
Инъекцию белка в 4-й желудочек головного мозга проводили микрошприцем Гамильтона под наркозом (раствор метансульфоната трикаина (MS-222), 130 мг/л воды). Рыбам опытной группы вводили нативный белок (3 и 2,7 мкг в первом и втором опытах соответственно), рыбам контрольной группы – то же количество белка, инактивированного нагреванием при 55 °С в течение 40 мин. Карасям из интактной группы СМАБ не вводили. Обучение рыб в лабиринте (первый опыт) и исследование пищевого поведения рыб (второй опыт) начинали через 24 ч после инъекции.
Эксперимент 1
Схема лабиринта представлена на рис. 1. Корм (20 личинок хирономид) размещали в конце левого коридора. Рыбу помещали в стартовую камеру, затем открывали заслонку, преграждающую выход из камеры, и включали аналоговую видеокамеру Quadro-Hamy HOME (Китай), расположенную над аквариумом. Поведение особи регистрировали в течение 10 мин после открытия заслонки в стартовой камере, после чего видеорегистрацию заканчивали, особь изымали из установки, остатки корма подсчитывали, помещали следующую и т.д. В сутки проводили один сеанс обучения, всего провели 7 последовательных сеансов. Рассчитывали среднее значение рациона для каждого временного интервала (n = 8) и всего периода наблюдения после инъекции (n = 56).
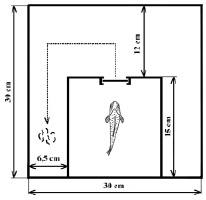
Рис. 1. Схема экспериментальной установки (вид сверху)
Эксперимент 2
Для второго эксперимента были сформированы две группы рыб, по три особи. Группы помещали в два одинаковых аквариума экспериментальной установки для адаптации к условиям эксперимента. Экспериментальная установка представляла собой два непроточных аквариума размером 116×43×23 см, с укреплёнными над ними зеркалами. Около левой стороны аквариума размещалась стартовая камера размером 13×13×16 см, изготовленная из дели, натянутой на каркас. На дне аквариумов грунт – речной песок слоем 2–3 см. Освещение обеспечивалось лампами дневного света. Режим освещения: 12 час «свет» – 12 час «темнота». Температура воды +21…+23 °С.
После адаптации в течение двух недель рыбам обеих групп делали инъекцию препаратов по схеме, описанной выше. Через 1 ч после инъекции начинали эксперимент. Корм (40 личинок хирономид) размещали на пяти ситечках (8 см в диаметре), по 8 экз. на каждом. Перед началом эксперимента «кормовые пятна» закапывали в грунт. После окончания эксперимента подсчитывали количество несъеденных личинок хирономид на ситечках. Последующие опыты проводили через 24, 48, 72 и 96 ч после инъекции. Через неделю после первой инъекции делали повторную инъекцию и проводили опыт по той же схеме и т.д. в течение пяти недель. Число наблюдений для каждого временнóго интервала суммировалось и составило таким образом 5 значений. Рассчитывали среднее значение рациона для каждого временного интервала (n = 5) и всего периода наблюдения (n = 10 до инъекции и n = 25 после инъекции).
Данные обрабатывали статистически с использованием приложения Excel программы MS Office 2016 и Statistica 10.0 (StatSoft Inc., США). Статистическую значимость различий рационов рыб интактной, контрольной и опытной групп оценивали в первом эксперименте с помощью одно- и двухфакторного дисперсионного анализа ANOVA; контрольной и опытной групп во втором эксперименте – с помощью непараметрического критерия Манна – Уитни, при уровне значимости 0,05 (р ≤ 0,05).
Результаты исследования и их обсуждение
Результаты первого эксперимента показывают, что на количество съеденного карасями корма в лабиринте инъекция DPYL2 не влияет. Так, средний рацион особи карася за 7 дней наблюдения составил 4,6± 0,5, 4,6± 0,7 и 4,3± 0,7 экз. хирономид у интактных, контрольных и опытных рыб соответственно (F = 0,12, df = 2, p = 0,89). Авторы проанализировали также с помощью двухфакторного дисперсионного анализа средние рационы у рыб трёх групп по дням. Было установлено, что инъекция белка не оказывает значимого эффекта на показатель: F = 0,09, df = 2, p = 0,91. Однако наблюдается достоверная связь количества съеденного корма с интервалом наблюдения: F = 2,74, df = 6, p = 0,015. У рыб всех трёх групп наблюдается постепенное возрастание рационов (рис. 2).
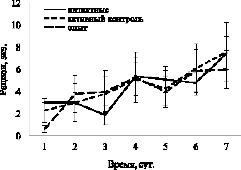
Рис. 2. Динамика изменения рационов у карасей различных групп в первом эксперименте
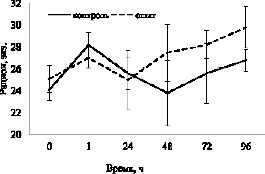
Рис. 3. Динамика изменения рационов у карасей различных групп во втором эксперименте
Результаты второго эксперимента также свидетельствуют о том, что DPYL2 не влияет на пищевую мотивацию рыб. Значения средних рационов у рыб интактных групп достоверно не различались: 24,1± 1,0 и 25,1± 1,2 экз. у первой и второй групп соответственно (p > 0,05). В то же время средний рацион рыб за весь период наблюдения составил 26,0± 0,9 и 27,4± 0,9 экз. в контроле и опыте соответственно (p > 0,05). Наименьшее значение показателя наблюдается через сутки после инъекции в опыте и через двое – в контроле: 25,0± 2,7 и 23,8± 3,0 экз. соответственно (p > 0,05) (рис. 3).
Таким образом, авторы проанализировали эффект инъекции DPYL2 на пищевую мотивацию рыб в двух экспериментах с различными схемами и в обоих получили отрицательные результаты.
Влияние DPYL2 на формирование пространственной памяти у молоди серебряного карася было описано нами ранее. Было продемонстрировано, что на динамику выработки пространственного навыка у рыб – нахождение корма в определённом месте лабиринта, – инъекция белка оказывает выраженное негативное воздействие. Так, если среднее за всё время обучения число рыб, находивших корм в лабиринте, составило 53 % и 42 % в интактной и контрольной группах соответственно, то в опытной – только 16 % [3]. Исходя из этого, авторы предположили, что в первом эксперименте способность рыб к обучению и запоминанию маршрута к корму могла повлиять на количество съеденного карасями корма. Тем не менее динамика прироста среднего рациона у рыб контрольной и опытной групп в лабиринте по мере обучения свидетельствует о том, что существенных различий по этому показателю у особей двух групп нет. Возможно, некоторое снижение потребления пищи у рыб, визуально наблюдаемое в экспериментах по влиянию DPYL2 на обучение и долговременную память, было связано с самой процедурой инъекции, что авторы и проверили во втором эксперименте: у рыб опытной группы незначительное снижение рациона происходило на первые сутки, а у рыб контрольной группы – на вторые сутки, и это снижение было статистически недостоверным в обоих случаях.
В регуляции энергетического гомеостаза и потребления пищи у животных задействованы несколько популяций нейронов, локализованных преимущественно в структурах гипоталамуса. Существуют ориксигенные, возбуждающие аппетит, и анориксигенные, снижающие потребление пищи и вес тела, нейропептиды. К первой группе относится агути-родственный пептид, AgRP, нейроны которого локализованы в аркуатном ядре гипоталамуса [5, 6]. Этими же нейронами синтезируется другой пептид, нейропептид Y (NPY), оказывающий стимулирующее действие на потребление пищи животным с помощью другого, отличного от AgRP механизма. Активность AgRP- и NPY-нейронов ингибируется гормонами лептином, инсулином и PYY3–36 и стимулируется гормоном грелином [6]. Рядом с этими клетками находятся нейроны, которые экспрессируют проопиомеланокортин (POMC), предшественник полипептида, из которого синтезируются меланокортины, такие как α-меланоцит стимулирующий гормон (α-MSH). Активация меланокортиновых рецепторов приводит к ингибированию потребления пищи [7]. Список биологически активных веществ, участвующих в регуляции пищевого поведения животных, в последние десятилетия постоянно расширяется. Несмотря на эволюционную консервативность механизмов, регулирующих потребление пищи животными, нейроэндокринные регуляторные механизмы рыб имеют свою специфику [8]. К настоящему времени опубликовано уже достаточно много обзоров, в которых авторы обобщают сведения, касающиеся регуляции пищевого поведения и энергетического гомеостаза у костистых рыб [8–10]; в то же время экспериментальная работа по получению новых сведений продолжается.
В доступной им литературе авторы не нашли свидетельств того, что DPYL2 может прямо или косвенно влиять на пищевые реакции рыб. В опытах на крысах в условно-рефлекторной модели чередования побежек с пищевым подкреплением, в эксперименте с регистрацией количества съеденных пищевых шариков также не было выявлено влияния DPYL2 на уровень пищевой мотивации [2]. Таким образом, корм как подкрепляющий стимул может быть использован без ограничений в опытах по исследованию влияния DPYL2 на обучение и формирование памяти у рыб. Использование различных подходов и схем поведенческих экспериментов на разных видах животных позволит получить более полные сведения относительно роли этого белка в механизмах формирования долговременной памяти.
Заключение
1. Введение белка DPYL2 в желудочек мозга серебряным карасям в дозе, вызывающей выраженное негативное воздействие на долговременную память, не влияет на их пищевую мотивацию.
2 Полученные результаты позволяют обоснованно использовать корм как стимул обучения для рыб в опытах по исследованию белка на формирование памяти.
Авторы выражают благодарность за техническую помощь в работе канд. биол. наук А.К. Смирнову.
Работа выполнена за счёт средств федерального бюджета на выполнение госзадания № АААА-А19-119102890013-3.
Библиографическая ссылка
Гарина Д.В., Смирнова Е.С., Мехтиев А.А. ВЛИЯНИЕ НЕЙРОСПЕЦИФИЧНОГО ДИГИДРОПИРИМИДИНАЗА-ПОДОБНОГО БЕЛКА-2 (DPYL2) НА ПИЩЕВУЮ МОТИВАЦИЮ МОЛОДИ СЕРЕБРЯНОГО КАРАСЯ СARASSIUS AURATUS // Научное обозрение. Биологические науки. 2021. № 4. С. 18-22;URL: https://science-biology.ru/ru/article/view?id=1238 (дата обращения: 24.12.2025).
DOI: https://doi.org/10.17513/srbs.1238


 science-review.ru
science-review.ru