Более 10 лет назад Всемирной организацией здравоохранения была собрана, проанализирована и опубликована статистика, представляющая средние показатели распространённости артериальной гипертонии среди населения различных стран по всему миру. Так, было зарегистрировано более 1 млрд (40 %) случаев обращений в клиники, связанных с патологией сердечно-сосудистой системы, приводящей к повышенному артериальному давлению.
На фоне ретинопатии чаще возникают окклюзии сосудов сетчатки, что требует экстренной помощи для сохранения зрения. Отсутствие своевременного фармакологического вмешательства приводит к полной или частичной потере зрения и инвалидности.
При артериальном давлении выше 130 мм рт. ст. в нашем организме одним из распространенных органов-мишеней являются глаза, а именно сетчатка. При развитии гипертонической болезни специфические изменения в сетчатке появляются примерно в 66 % случаев. Гипертоническая нейроретинопатия опасна тем, что повреждения сосудов сетчатки провоцируют развитие их окклюзии, что требует скорого лечения. При отсутствии медикаментозной терапии ретинопатия нередко вытекает в полную потерю зрения, что может быть обусловлено как дистрофией сетчатки, так и атрофией зрительного нерва.
Все патологии, затрагивающие целостность и нормальное физиологическое состояние микроциркуляторной сосудистой системы глаза, включены в список основных причин возникновения слепоты, что показывает их важную роль в ухудшении зрения вплоть до его потери. Лечение гипертонической нейроретинопатии не имеет направленной терапии на сетчатку и основано только на лечении основной патологии. Несмотря на это, последствия развития гипертонической нейроретинопатии требуют создания препаратов, имеющих строгий вектор направленности, подразумевающий фармакологическое воздействие не только на сетчатку, но и сосуды.
В исследованиях [1, 2] была показана статистика диагностированных ретинопатий: примерно в половине случаев обращений, связанных с заболеванием сетчатки и зрительного нерва, были выявлены ретинопатии, этиологией которых являлось нарушение микроциркуляторной системы глаза. Первостепенными задачами фармакологии в области офтальмотерапии предстают поиск и исследование фармакологически активных веществ, способных предупреждать развитие локальных ишемических патологических явлений [3, 4], направленных на коррекцию микрососудистого давления в области глазного яблока [5, 6], а также в иных органах и системах организма [7, 8].
На данный момент химическое соединение с лабораторным шифром DMAE 7–16, полное химическое название которого – 2-диметиламиноэтанол L-2-аминопентандиовоат, представляет собой многообещающее решение в качестве основного медикаментозного компонента в лечении заболеваний, связанных с патологией микроциркуляторного русла глазного яблока. Данное вещество способно улучшить исследуемые критерии, состояние микроциркуляторного русла, электрофизиологическое состояние сетчатки, морфологическую картину [9]. А.А. Пересыпкиной с соавт. было проведено исследование на модели нейроретинопатии с повышенным артериальным давлением, демонстрирующее многообещающую эффективность вещества DMAE 7–16 [9]. Нейро- и ангиопротективное действие показано наиболее эффективно при применении дозы 25 мг/кг в сутки. Это лучше результатов использования DMAE 7–16 дозировкой 12,5 мг/кг в сутки. Основными критериями оценки эффективности терапии данным соединением явились предотвращение развития нейрональных и сосудистых повреждений в сетчатке в модельной группе по сравнению с контрольной группой, положительное влияние на динамику коэффициента b/a в группах терапии развивающейся патологии – это выражалось восстановлением волны b на ЭРГ [9].
Определение токсических свойств новых соединений является важным компонентом их изучения и анализа возможностей внедрения в терапию определённых патологических состояний. Рост числа осложнений при артериальной гипертензии, атеросклерозе, сахарном диабете требует расширения сегмента глазных лекарственных форм, направленных на лечение не только болезней сосудистой оболочки глаза, но и нейронов сетчатки, гибель которых индуцирована преимущественно ишемическим компонентом данных заболеваний [10].
Цель исследования заключалась в определении субхронической токсичности и местнораздражающего действия субстанции DMAE 7–16.
Материалы и методы исследования
При исследовании субхронической токсичности исследуемую субстанцию под лабораторным шифром DMAE 7–16 вводили в дозах, которые при пересчете с человека на животного составляли однократную и четырехкратную терапевтические дозы. Для пересчета доз с человека на животного использовали коэффициент пересчета доз, указанный в «Руководстве по экспериментальному (доклиническому) изучению новых фармакологических веществ». Введение препарата осуществляли внутрижелудочно один раз в сутки в течение 14 дней.
Исследование субхронической четырнадцатидневной токсичности проводили на самцах и самках белых лабораторных крыс линии Wistar. Рандомизацию осуществляли после двухнедельного периода карантина и адаптации. Животных содержали по шесть в клетке, в комнатах содержания животных соблюдался режим день/ночь длительностью 12 ч, при стандартных температуре и влажности рекомендованных для вивариев. На всем протяжении исследования использовали гранулированный лабораторный корм (сертификат № РОСС RU/ПО81.ВОО.365 ГОСТ 50258-92).
Этические принципы обращения с лабораторными животными соблюдались в соответствии с «European Convention for the Protection of Vertebrate Animals used for Experimental and other Scientific Purposes. CETS No. 170». Все материалы исследования задокументированы как первичные данные исследования и находятся в общей папке по исследованию.
В соответствии с указаниями, разработанными Федеральным государственным бюджетным учреждением «Научный центр экспертизы средств медицинского применения» «Руководством по проведению доклинических исследований лекарственных средств», при исследовании были использованы такие методы, как визуальный, инструментальный и лабораторный методы контроля состояния животных, для оценки действия препаратов [11].
Экспериментальные животные были разделены на три группы (по 12 животных в каждой), в соответствии с тремя сериями опытов по изучению субхронической 14-дневной токсичности:
1 группа животных – контрольная (ежедневное внутрижелудочное введение 1 % крахмального клейстера);
2 группа животных – DMAE 7–16 в дозе 0,01 г/кг/сут;
3 группа животных – DMAE 7–16 в дозе 0,04 г/кг/сут.
Было проведено определение основных характеристик у животных по окончании карантина, длящегося 14 дней, и их адаптации к новым условиям. Рассматривались масса тела, ритмичность дыхания, двигательная активность, тестировались поведенческие реакции, оценивалось потребление воды и пищи, проводился визуальный осмотр состояния слизистых, кожного покрова, волосяного покрова, рассматривалась реакция на внешние раздражители. Исследование длилось 28 дней: первый этап включал применение субстанции в течение первых двух недель, после которого оставшиеся две недели животные находились под наблюдением без применения препаратов.
При этом еженедельно контролировали основные показатели для оценки общего состояния животных.
Все манипуляции с животными проводились с применением наркоза. На 15-й и 29-й день эксперимента у животных проводился забор проб крови для проведения гематологических и биохимических исследований. Сразу после эвтаназии животных осуществлялась некропсия с последующим гравиметрическим анализом органов, а также забор органов и тканей для последующего морфологического исследования.
Биохимическое исследование крови проводили на анализаторе Olympus AU 640, выявлялись биохимические параметры, отвечающие за повреждение внутренних органов. Забор проб крови проводили после введения препарата в течение 14 дней, и после 14-дневного периода отмены препаратов. С помощью гематологического анализатора CELL-DYN 3700 проводили анализ крови на содержание гемоглобина, эритроцитов, тромбоцитов и лейкоцитов, определяли лейкоцитарную формулу.
Полученные данные были выборочно обработаны с помощью компьютерных программ Microsoft Excel 2019 и Statistica 10 (StatSoft, США). Были применены основные описательные статистики: среднее, стандартная ошибка средней. Для сравнений средних количественных показателей между группами использовали t-аспект Стьюдента для независящих групп или критерий Манна – Уитни (U-тест) в зависимости от типа распределения показателей (нормальное / ненормальное). Достоверные различия принимались при p < 0,05.
Результаты исследования и их обсуждение
После 14-дневного внутрижелудочного введения соединения DMAE 7–16 в исследуемых дозах не было выявлено влияние соединения на содержание гемоглобина в крови. Также во всех группах было обнаружено нормальное содержание эритроцитов с отсутствием статистически значимых отличий от его уровня в крови животных из контрольной группы, принимавших плацебо. Вместе с тем не наблюдалось изменений в числе лейкоцитов и тромбоцитов. Введение соединения DMAE 7–16 в дозах 0,01 г/кг в сутки и 0,04 г/кг в сутки (что соответствует однократной и четырёхкратной дозам) не оказывало значимого влияния на лейкограмму, которая статистически не отличалась от лейкограммы животных с плацебо. В результате обработки данных сделан вывод об отсутствии субхронической токсичности субстанции DMAE 7–16 в отношении крови в исследуемых дозах.
Содержание общего белка у животных экспериментальной группы, которым вводили субстанцию DMAE 7–16 в дозах 0,01 г/кг в сутки и 0,04 г/кг в сутки, было сравнимо с уровнем белка у животных контрольной группы, получавшим 1 % крахмальный клейстер. По окончании времени, в течение которого препарат полностью выводится из организма, также измеряли уровень общего белка. Содержание находилось в рамках нормальных значений и статистически не отличалось между всеми группами.
Под влиянием препарата DMAE 7–16 в однократной дозе и четырехкратной дозе содержание глюкозы в крови находилось в пределах физиологической нормы как в первой части эксперимента во время введения препарата, так и после его отмены. Это позволяет сделать заключение о том, что субстанция не оказывает негативного влияния на углеводный обмен.
Концентрация мочевины в крови животных во время применения препарата и после его отмены находилась в диапазонах нормы во всех исследуемых группах, что говорит об отсутствии значимого влияния на фильтрационную функцию почек у субстанции DMAE 7–16.
Во всех исследуемых группах показатели концентрации креатинина соответствовали норме, что говорит об отсутствии негативного влияния исследуемой субстанции DMAE 7–16 в однократной (0,01 г/кг в сутки) и четырехкратной (0,04 г/кг в сутки) дозах на функции почек.
Проведение анализов, выявляющих активность АСТ и АЛТ, показало отсутствие влияния соединения DMAE 7–16 на нормальную функциональность печени.
В течение всех 28 суток, на протяжении которых длился эксперимент, не было зафиксировано ни одной смерти как в экспериментальных группах с введением DMAE 7–16 в однократной и четырёхкратной доз, так и в контрольных группах с введением плацебо. По этой причине все экспериментальные животные были подвержены вскрытию с целью направить на морфологическое исследование следующие внутренние органы: печень, почки, селезёнка, гонады, мочевой пузырь, тимус, лёгкие, сердце и головной мозг.
Микроскопическое исследование органов животных всех групп показало, что субстанция DMAE 7–16 в исследуемых дозах не оказывает токсического влияния, приводящего к патологическим изменениям.
Гистологическая картина извлечённых внутренних органов у животных экспериментальной группы, которым вводили соединение DMAE 7–16 в дозах 0,01 г/кг в сутки и 0,04 г/кг в сутки, была аналогична гистологической картине животных из контрольной группы, принимавших 1 % крахмальный клейстер.
Общая структура стенки желудка обычная. Толщина железистой слизистой оболочки составляет 410–490 мкм. Желудочные ямки имеют равномерное распределение, ровные контуры, их глубина составляет 80–120 мкм. На поверхности находится среднее количество слизи. Фундальные железы равномерно и плотно распределены в толще слизистой оболочки желудка, имеют хорошо различимую дифференцировку: поверхностная часть имеет протяжённость 160–190 мкм, образованная слизистыми и париетальными клетками, и нижняя часть длиной примерно 175 мкм, состоящая из главных клеток. Париетальные клетки ацидофильны, содержат гомогенную оксифильную цитоплазму. Главные клетки содержат базофильную цитоплазму со средней степенью гранулированности. Ядерные изменения не обнаружены. Собственная пластинка слизистой оболочки с тонкими прослойками между собственными железами, лейкоцитарной инфильтрации в значительной мере не наблюдается. Остальные оболочки стенки желудка без изменений. Все оболочки имеют равномерное кровенаполнение. Ни у одной из экспериментальных групп не выявлено ульцерогенных признаков.
Подтверждением отсутствия местнораздражающего эффекта у исследуемого соединения служит здоровое состояние желудка и тонкого кишечника без атрофических и иных изменений (рисунок).
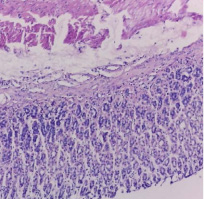
Морфологическая картина слизистой оболочки желудка крысы из группы с четырехкратной дозой субстанции DMAE 7–16
Заключение
При изучении субхронической (четырнадцатидневной) токсичности на самцах и самках крыс линии Wistar установлено, что субстанция DMAE 7–16 в однократной (0,01 г/кг в сутки) и четырехкратной (0,04 г/кг в сутки) дозах не оказывает выраженного общетоксического действия на организм лабораторных животных и не обладает местнораздражающим действием.
Результаты биохимического и гематологического исследования крови, показатели гравиметрического исследования, анализ макроскопического и микроскопического исследования внутренних органов крыс, получавших субстанцию DMAE 7–16 в однократной (0,01 г/кг в сут) и четырехкратной (0,04 г/кг в сут) дозах, показали, что данная субстанция не вызывает дистрофических, воспалительных и иных патологических изменений внутренних органов, а также не оказывает местнораздражающего действия в исследуемых дозах.
Исследование выполнено при поддержке программы «УМНИК», договор 15674ГУ/2020.
Библиографическая ссылка
Соловьев Н.В., Щуровская К.В., Жунусов Н.С., Сазонова В.Е., Черняева С.С., Ефименко С.В. ИССЛЕДОВАНИЕ СУБХРОНИЧЕСКОЙ ТОКСИЧНОСТИ С ОЦЕНКОЙ МЕСТНОРАЗДРАЖАЮЩЕГО ДЕЙСТВИЯ СУБСТАНЦИИ DMAE 7–16 // Научное обозрение. Биологические науки. 2022. № 1. С. 28-32;URL: https://science-biology.ru/ru/article/view?id=1256 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/srbs.1256


 science-review.ru
science-review.ru