Одной из основных проблем аграрного сектора многих стран является дефицит белка в питании людей и недостаточность кормовой базы для животноводства. Для решения этих проблем необходимо увеличение производства высокобелковых зернобобовых культур и, прежде всего, сои [1]. В мировом масштабе соя по важности сопоставима с пшеницей, рисом и кукурузой. Высокое содержание в зерне сои полноценного белка (до 45–48 %) и высококачественного масла (до 25 %) определяют её широкое применение [2]. Из сои производятся многие продукты питания. Мука из зерна сои используется в хлебопечении, кондитерской промышленности, в качестве наполнителя при производстве колбас и других мясных изделий. Соевое масло, соевое молоко, тофу употребляются в пищу как непосредственно, так и для приготовления большого количества продуктов и блюд [3]. Зерно сои имеет большое значение для кормопроизводства. Ценность белка соевого шрота составляет 43 единицы, в то время как ценность белка пшеницы и кукурузы только 5 условных единиц [4]. Однако урожайность сои в России и Казахстане по сравнению с другими странами низкая. Так, если средняя урожайность сои в Бразилии и США составляет 3,3 т/га, в Канаде – 2,6 т/га, то в России – 1,4–1,6 т/г, а в Казахстане – не превышает 1,1–1,2 т/га [5]. При этом зерно сои характеризуется низкими показателями качества. Исходя из этого, поиск путей повышения урожайности этой культуры является весьма актуальным.
Для повышения урожайности сои применяются минеральные и биологические удобрения, но упор делается на биоудобрения. В состав биологических удобрений, как правило, входят ризобии, или симбиотические азотфиксирующие бактерии. Эти бактерии обитают в клубеньках на корнях сои, способны извлекать азот из воздуха и преобразуют его в форму, которую могут использовать растения.
Одной из проблем низкой урожайности сои в Казахстане является то, что для повышения урожайности сои применяют в основном биопрепараты импортного происхождения, которые часто оказываются малоэффективными. Это обусловлено их низкой приживаемостью на корнях сои и неприспособленностью к почвенным и климатическим условиям.
Целью данного исследования было выделение ризобий, получение чистых культур, изучение их основных культурально-морфологических и физиолого-биохимических свойств, отбор наиболее эффективных штаммов для создания биоудобрения для культуры сои и их идентификация молекулярно-генетическим методом.
Материалы и методы исследования
Объектами исследования служили бактерии, выделенные и клубеньков на корнях растений сои (Glycine max (L.) Merr.), собранных в Алматинской области Казахстана – основном регионе выращивания сои. Для выделения ризобий были отобраны здоровые и мощные растения сои с хорошо развитой корневой системой и многочисленными клубеньками на корнях. От корня пинцетом отделяли крупные розовые клубеньки и переносили в чашку Петри, где их разрезали скальпелем на части. Для выделения клубеньковых бактерий использовали питательную среду Мазе, следующего состава, г/л: К2НPO4 – 1,0; MgSO4 – 0,3; сахароза – 10,0; отвар из 100 г гороха, pH 6,8–7,0. Небольшое количество содержимого клубенька переносили в 100 мкл стерильной воды, затем на поверхность агаризованной среды Мазе в чашке Петри, размазывали шпателем и инкубировали при 25 °С.
Для изучения способности образовывать клубеньки на корнях сои (нодуляции) ризобии выращивали на жидкой среде Мазе при 180 об/мин, 28 °С в течение 5 суток. В опытах использовали сою сорта «Эврика». Семена сои стерилизовали гипохлоритом натрия [6]. Перед посевом семена инокулировали суспензией бактерий с титром клеток 1×108 кл/мл в течение двух часов при комнатной температуре. Затем высевали в вегетационные сосуды объемом 500 мл (три растения на сосуд). В качестве субстрата для роста растений использовали стерильный вермикулит, для питания проростков применяли стерильный раствор Кноппа, следующего состава, г/л: Ca(NO3)2×4H2O – 1,0, MgSO4×7H2O – 0,25, KH2PO4 – 0,25, KCl – 0,12, FeCl3×6 H2O – 0,004, вода – 1000 мл. Все эксперименты были выполнены в пяти повторностях. Подсчет количества и средней массы клубеньков проводили после 30 дней выращивания.
Нитрогеназную активность ризобий определяли ацетиленовым методом [7]. Для этого исследуемые бактерии выращивали на среде Эшби в условиях аэрации до концентрации 108 кл/мл. Ацетилен вводили в сосуды с культурами до концентрации 10 % (по объему). После инкубации культур в течение 1,5 ч в атмосфере ацетилена пробы газа отбирали шприцем по 1 мл из сосуда и определяли наличие этилена на газовом хроматографе “Agilent Technology 7890 B” (США) с пламенно-ионизационным детектором [8].
Культурально-морфологические и физиолого-биохимические свойства ризобий изучали по стандартным методикам [9].
Идентификацию ризобий проводили методом секвенирования 16S rRNA гена с универсальными праймерами [10]. Геномную ДНК выделяли из суточной культуры бактерий с помощью набора PureLink® Genomic DNA Kits (Invitrogen, США). Реакционная смесь для амплификации состояла из 12,5 мкл Q5® Hot Start High-Fidelity 2X Master Mix, 1,25 мкл каждого праймера (10 мкМ), 1,5 мкл ДНК и 8,5 мкл стерильной воды для молекулярных исследований. ПЦР-амплификацию проводили в термоциклере Eppendorf ProS (Eppendorf, Гамбург, Германия, 2012) в режиме: 98 °С – 30 с; 55 °С – 1 мин; 72 °С – 40 с – всего 30 циклов; 72 °С – 10 мин. Результаты амплификации анализировали в 1,2 % агарозном геле. Капиллярный форез проводили на автоматическом секвенаторе 3500 DNA Analyzer (Applide Biosystems, США) с использованием набора Big Dye Terminator v3.1 Cycle Sequencing Kit (Applide Biosystems, США) согласно протоколу. Поиск гомологичных нуклеотидных последовательностей осуществляли в программе BLAST (Basic Local Alignment Search Tool) Международной базы данных Gene Bank NCBI, США [11]. Филогенетический анализ проводили с использованием программного обеспечения MEGA6. Для построения филогенетических деревьев использовали метод «объединения соседей» NJ (Neiighbor-Joining).
Статистическая обработка результатов проводилась с использованием пакета программ «STATISTICA 10.0» [12].
Результаты исследования и их обсуждение
Выделение ризобий проводили из клубеньков на корнях сои, собранных на полях Алматинской области Казахстана. Для выделения ризобий были отобраны здоровые и мощные растения с хорошо развитой корневой системой и большим числом клубеньков на корнях. В общей сложности было собрано 67 растений сои. В лабораторных условиях из клубеньков на корнях сои было проведено выделение ризобий на питательной агаризованной среде Мазе. Засеянные чашки Петри инкубировали в термостате при 25 °С. Появление колоний на 1–2-е сутки свидетельствовало о загрязнении культуры. Быстрорастущие ризобии появлялись на 3–4, медленнорастущие – на 7–9 сутки (рис. 1).
Чистоту культур клубеньковых бактерий проверяли визуально и под микроскопом. Микроскопический контроль проводился с препаратами живых и фиксированных окрашенных клеток с помощью светового микроскопа. В результате проведенной работы было выделено 24 чистые культуры клубеньковых бактерий.
Исследование культурально-морфологических свойств бактерий показало, что при росте на среде Мазе бактерии образовывали бесцветные или молочно-белые слизистые колонии. Исследование морфологии ризобий показало, что все выделенные культуры были грамотрицательные, не образовывали спор и имели палочковидную форму клеток. При просмотре под микроскопом препаратов живых клеток бактерий отмечали их высокую подвижность. Установлено, что клетки бактерий были мелкими, полиморфными и с течением времени клетки принимали округлую форму. На фиксированных окрашенных препаратах четко просматривалась зернистость внутреннего содержания клеток клубеньковых бактерий.
Исследование основных физиолого-биохимических свойств бактерий показало, что выделенные бактерии относятся к аэробам, не растут на мясопептонных средах и других белковых субстратах животного происхождения, рост на безазотистой среде Эшби слабый. Установлено, что штаммы бактерий слабо утилизируют сахара, желатину не разжижают и крахмал не разлагают. По основным культурально-морфологическим и биохимическим свойствам бактерии были отнесены к двум родам – Bradyrhizobium и Rhizobium.
Известно, что не все клубеньковые бактерии способны образовывать клубеньки на корнях растений сои. В этой связи было проведено изучение способности выделенных бактерий к нодуляции и фиксации азота воздуха. Наличие этих свойств у бактерий является основанием для их дальнейшего использования при разработке биоудобрения для культуры сои. В таблице представлены результаты семи штаммов, показавших наиболее высокие результаты.
Рис. 1. Колонии ризобий на агаризованной среде Мазе
Нодулирующая способность и нитрогеназная активность штаммов ризобий
|
Штаммы |
Количество клубеньков на растение, шт. |
Сухой вес клубеньков, мг/растение |
Нитрогеназная активность, µмоль С2H4/мл/ч |
|
Контроль |
0 |
0 |
– |
|
MA-1 |
12,8±0,1 |
128,3±1,3 |
3,87±0,02 |
|
H-2 |
14,6±0,2 |
130,2±1,2 |
2,32±0,01 |
|
H-3 |
12,1±0,1 |
142,2±1,0 |
5,25±0,02 |
|
H-4 |
17,8±0,2 |
147,5±1,2 |
6,65±0,01 |
|
H-6 |
18,2±0,2 |
153,2±2,2 |
6,71±0,01 |
|
H-7 |
18,4±0,1 |
158,5±2,1 |
6,74±0,01 |
|
H-8 |
17,3±0,1 |
148,4±2,0 |
6,34±0,02 |
Примечание. p < 0,01
Из данных таблицы следует, что штаммы ризобий активно образовывали клубеньки на корнях сои и фиксировали азот воздуха. Отмечено, что во всех вариантах опыта клубеньки были розовыми, что свидетельствует об активной фиксации азота атмосферы, так как розовый цвет клубеньков свидетельствует о присутствии леггемоглобина, который контролирует поток кислорода к бактериям. Также показано, что по истечении 30 суток роста сои, в вариантах со штаммами МА-1, H-2, H-3 количество клубеньков на одно растение составляло 12–14 штук, а в вариантах со штаммами H-4, H-6, H-7, H-8 оно было большим и в среднем составляло 17–18 штук на растение. Отмечено, что в этих вариантах клубеньки были более крупными и темно-розовыми, и появление клубеньков в этих вариантах было на 12,5 % раньше, чем в вариантах со штаммами МА-1, H-2, H-3. Также установлено, что азотфиксирующая активность менялась в зависимости от штамма бактерий. Показано, что азотфиксирующая активность штаммов H-4, H-6, H-7, H-8 была выше, чем у штаммов МА-1, H-2, H-3 (таблица).
Идентификацию ризобий проводили молекулярно-генетическим методом Сенгера, путем секвенирования 16S rRNA гена. Геномную ДНК выделяли из суточной культуры бактерий и на основе изучения последовательности участка гена 16S rRNA с универсальными праймерами осуществляли идентификацию бактерий. Для ризобий был проведен филогенетический анализ путем сравнения нуклеотидной последовательности штамма с последовательностями 16S rRNA штаммов родственных бактерий из базы данных NCBI. В программе МЕГА 6.0 были построены филогенетические деревья с использованием Neiighbor-Joining кластерного метода расчета генетических расстояний.
На рис. 2 представлены дендрограммы штаммов ризобий H-4, H-6, H-7 и H-8.
Из рис. 2 следует, что в филогенетическом отношении штаммы H-4, H-6, H-7 наиболее близки со штаммом NR 044869.2 Rhizobium lupini strain DSM 30140, а штамм H-8 находится на одной ветви с референсным штаммом из базы данных NCBI NR 036865.1 Bradyrhizobium japonicum strain 3I1b6.
Сравнение нуклеотидных последовательностей гена 16S rRNA со штаммами из базы данных NCBI показало степень гомологии на 99–100 %.
Заключение
В этом исследовании проведено выделение ризобий из клубеньков растений сои, собранных на полях Алматинской области Казахстана. Для выделения ризобий было отобрано 67 здоровых и мощных растений сои с хорошо развитой корневой системой и большим числом клубеньков на корнях. В лабораторных условиях из клубеньков сои на среде Мазе были выделены бактерии, проведена их очистка и получены 24 чистые культуры ризобий. Изучены их основные культурально-морфологические и биохимические свойства и показано, что бактерии относятся к двум родам Bradyrhizobium и Rhizobium. Проведено исследование способности штаммов ризобий образовывать клубеньки на корнях сои и изучена их азотфиксирующая активность. По результатам исследований отобрано четыре наиболее активных штамма бактерий (H-4, H-6, H-7 и H-8). Установлено, что в вариантах опытов с этими штаммами, клубеньки на корнях сои были более крупными и темно-розовыми, что свидетельствует о высоком содержании леггемоглобина, который контролирует приток кислорода к бактериям.
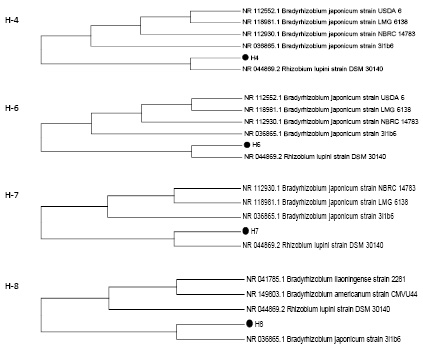
Рис. 2. Филогенетические деревья ризобий (штаммы H-4, H-6, H-7 и H-8)
Также отмечено, что появление клубеньков на корнях сои в этих вариантах было на 12,5 % раньше, чем в других вариантах. Проведена идентификация отобранных штаммов молекулярно-генетическим методом. Идентификацию ризобий проводили методом Сенгера, путем секвенирования 16S rRNA гена. Установлено, что штаммы относятся к двум родам Rhizobium и Bradyrhizobium, к видам Rhizobium lupini (H-4, H-6, H-7) и Bradyrhizobium japonicum (H-8). Таким образом, отобраны четыре высокоэффективных штамма ризобий, перспективных для создания биоудобрения для культуры сои и установлено их таксономическое положение.
Применение биоудобрения, созданного на основе этих штаммов, будет весьма перспективным, так как штаммы, входящие в состав биоудобрения, адаптированы к почвенным и климатическим условиям юго-восточного региона Казахстана, и их использование позволит избежать конкуренции с почвенной микрофлорой. Также отобранные штаммы обладают высокой приживаемостью на корнях местных сортов сои. Использование биоудобрения на практике будет соответствовать требованиям охраны окружающей среды, поскольку ризобии являются естественными представителями почвенной микрофлоры, что обеспечит получение экологически чистой продукции и позволит увеличивать прибыль сельхозпредприятий за счет повышения урожайности сои.
Исследование выполнено при финансовой поддержке Министерства образования и науки Республики Казахстан в рамках грантового проекта АР09259080.
Библиографическая ссылка
Смирнова И.Э., Баймаханова Г.Б., Файзулина Э.Р., Даугалиева С.Т., Татаркина Л.Г. ВЫДЕЛЕНИЕ И ИДЕНТИФИКАЦИЯ РИЗОБИЙ, ПЕРСПЕКТИВНЫХ ДЛЯ СОЗДАНИЯ БИОУДОБРЕНИЯ ДЛЯ КУЛЬТУРЫ СОИ (GLYCINE MAX (L.) MERR.) // Научное обозрение. Биологические науки. 2022. № 1. С. 38-43;URL: https://science-biology.ru/ru/article/view?id=1258 (дата обращения: 02.02.2026).
DOI: https://doi.org/10.17513/srbs.1258


 science-review.ru
science-review.ru