Засоление является одним из самых губительных стрессов абиотической природы, влияющих на рост и развитие растений. В настоящее время около 20 % орошаемых земель в мире подвержены засолению [1]. Растения, выращенные в условиях повышенного солесодержания, испытывают разнообразные морфо-физиологические и биохимические изменения из-за гиперионного и осмотического стресса, что в свою очередь приводит к повреждению мембран, дисбалансу питательных веществ, падению эффективности фотосинтеза, инактивации ферментов, нарушению продукции первичных и вторичных метаболитов [2].
Известно, что солевой стресс вызывает повреждения растений за счет изменения структуры клеточных органелл, таких как хлоропласты и митохондрии [3]. Высокая концентрация солей в почве приводит к набуханию и деградации оболочки тилакоидов и хлоропластов, что приводит к увеличению размера и количества пластоглобул [4, 5]. Повреждения в тилакоидах вызываются прежде всего активными формами кислорода (АФК), продуцируемыми в листьях в результате засоления.
Минерализация среды влияет на физиологическую динамику фотосинтеза за счет снижения ассимиляции углерода, поскольку диффузия CO2 в хлоропласты ограничена. Это происходит потому, что гиперосмотический стресс ведет к закрытию устьиц, чтобы поддержать тургорное давление воды в листе [6]. Чтобы смягчить стресс и ионный дисбаланс, вырабатываются АФК, что в дальнейшем приводит к закрытию устьиц [7]. Фотосистема I (ФСI) и Фотосистема II (ФСII), присутствующие в белковом комплексе реакционного центра, образуют большую часть АФК в хлоропласте при стрессе [8]. Активные формы кислорода до определенного уровня концентраций действуют как важные сигнальные молекулы, но если содержание превышает максимальный порог, то это вызывает окислительное повреждение белков, нуклеиновых кислот и липидов [9]. Установлено, что под действием засоления также снижается устьичная проводимость, содержание каротиноидов и хлорофилла в фасоли, хлопке [10], рисе [11], Arabidopsis [12, 13], табаке [14], ячмене [15], что приводит к снижению эффективности фотосинтеза.
В настоящей статье обобщены данные о влиянии солевого стресса на биоэнергетические процессы фотосинтеза.
Организация и функции фотосинтетического аппарата
Первичная реакция фотосинтеза начинается с фотохимической реакции, в ходе которой свет поглощается антеннами молекул пигментов (светособирающими комплексами), за которой следует перенос энергии электрона. Данная первичная реакция протекает в единицах фотосистем, расположенных в мембране тилакоидов хлоропласта. Ориентация антенн молекул хлорофилла a, b, β-каротиноидов, зеаксантина позволяет поглощать максимальное количество фотонов в данный момент времени. Освещение антенн молекул приводит к ее возбуждению, после чего происходит перенос электрона на хорошо упорядоченный белково-пигментный молекулярный комплекс, известный как фотохимический реакционный центр (ФРЦ) [16].
Пигменты хлорофилла играют ключевую роль в аккумуляции световой энергии. Было идентифицировано пять различных форм хлорофилла: Хл a, b, c, d и f [17]. Наличие различных форм хлорофилла позволяет организмам поглощать свет с различной длиной волны. Хлорофилл состоит из гетероциклического хлоринового кольца, полученного из пиррола, с небольшими вариациями их боковой цепи. Любое изменение в боковой цепи путем замены или добавления может привести к изменению светопоглощения. В составе хлорофилла также содержится тетрапиррол магния, который улавливает свет, передает энергию возбуждения в реакционные центры, что дополнительно стимулирует реакцию разделения зарядов в реакционных центрах [18].
Фотосинтетические реакции традиционно делят на две фазы. Первая светозависимая фаза протекает в тилакоидной мембране хлоропласта. Когда световая энергия достигает реакционного центра через светособирающий комплекс, она возбуждает электрон, присутствующий в пигменте хлорофилла (P700) ФСII. Окисленный P700 восстанавливается и высвобождает электрон, который далее подвергается процессу, называемому цепной реакцией переноса электронов. Перенос электрона в электрон-транспортной цепи протекает по Z-образной схеме, поэтому он также широко известен как Z-модель транспорта электронов [19, 20]. Подсчитано, что в Z-модель цепной реакции переноса электронов вовлечено примерно двадцать промежуточных молекул [21]. Каждый этап в цепи переноса электронов снижает энергию возбужденного электрона, который превращается в другую форму энергии, то есть в АТФ и НАДФН. Между тем электроны, потерянные пигментом хлорофилла (P700) ФСII, генерируются обратно путем расщепления молекул воды на атом кислорода, электрон и протон в ФСII. Образующийся кислород выделяется из устьиц листа [22, 23].
Вторая светонезависимая фаза протекает в строме хлоропласта. Именно в этом процессе CO2 фиксируется растениями для синтеза органических молекул. Некоторые побочные продукты и ферменты, такие как рибулозо-1,5-бисфосфат (РуБФ), 3-фосфоглицерат (3ФГА), глицеральдегид-3-фосфат (Г3Ф), 1,3-бисфосфоглицерат, карбоксилаза/оксигеназа РуБФ (Рубиско), транскетолаза, и эпимераза, являются вовлеченными в этот процесс. Реакция представляет собой циклический процесс, состоящий из 11 стадий, в которых РуБФ претерпевает серию окислительно-восстановительных изменений, которые позже снова регенерируются для продолжения цикла. Этот процесс в целом делится на три основных этапа; первый этап – фиксации углерода, представляет собой процесс, в котором РуБФ (молекула из пяти атомов углерода) ассимилирует CO2 с помощью фермента Рубиско. При добавлении СО2 к РуБФ образуются две стабильные молекулы с тремя атомами углерода, т.е. 3ФГА. Кроме того, 3ФГА фосфорилируется и восстанавливается до Г3Ф (этап восстановления), который является предшественником углеводов. Эти первые две стадии, этапы фиксации и восстановления углерода, управляются АТФ и НАДФН, образующимися во время световой реакции фазы фотосинтеза в электрон-транспортной цепи. На заключительном этапе регенерации G3P преобразуется обратно в РуБФ [24]. Этот цикл реакции также известен как цикл Кальвина – Бенсона – Бэсшема.
Под действием повышенной солености у растений изменяется энергетический обмен. Закрытие устьиц, инициируемое снижением доступности CO2, приводит к снижению скорости протекания некоторых процессов, главным образом фотосинтеза.
Влияние солевого стресса на фотосинтез
Несколько исследований, посвященных фотосинтезу и засолению, привели к пониманию того, что растения обычно реагируют на засоление, снижая скорость фотосинтеза [13, 25, 26]. Это происходит из-за нескольких молекулярных изменений, которые инициируются на физиологическом уровне и отражаются морфологически.
Хорошо известно, что солевой стресс вызывает ультраструктурные повреждения, изменяя структуру клеточных органелл, таких как хлоропласты и митохондрии [3]. Повышенная концентрация соли вызывает набухание и деградацию оболочки тилакоидов и хлоропластов, а также дополнительно увеличивает размер и количество пластоглобул. Это в конечном счете вызывает разрушение скопления гран [27]. Выраженность засоления можно наблюдать, анализируя уровни организации тилакоидов, набухание зернистых компартментов внутри хлоропласта. Повреждение тилакоида вызывается в первую очередь АФК, образующимися в листьях при засолении. Высокая соленость у риса приводит к некоторым искажениям структуры хлоропластов, а также вызывает скручивание ламеллярной системы, накопление липидных капель и отчетливых «нитей Гехта» между плазмалеммой и клеточной стенкой. Соленость также вызывает полное изменение структуры белка тилакоидной мембраны. Было показано, что около 40 % белка D1 (белок тилакоидной мембраны) теряется при засолении, что приводит к ингибированию активности ФСII [28].
В условиях солевого стресса в высших растениях содержание хлорофилла снижается у восприимчивых к соли растений, таких как картофель [29], горох [30], Malus halliana и Malus robusta [31]. Однако у солеустойчивых растений, таких как горчица [32] и пшеница [33], содержание хлорофилла было повышено.
В экспериментах на Lemna gibba было показано, что высокие концентрации соли (400 мМ NaCl) подавляли активность ФСI и ФСII и приводили к нарушению электрон-транспортной цепи [8]. Задержка переноса электронов между комплексом марганца и пластохиноном через молекулы QA и QB (хиноны, принимающие электроны от хлорофиллов в фотосистеме II) приводит к образованию АФК, известному также как окислительный взрыв. Это вызывает дальнейшее повреждение ФС II и препятствует фотосинтезу [34, 8]. В ответ на 300 мМ NaCl культивируемый ячмень Hordeum vulgare показал активацию белков, связанных с повреждением тканей, тогда как галофитный дикий ячмень Hordeum marinum демонстрировал сверхэкспрессию белков, связанных с активной акклиматизацией: белков, участвующих в метаболизме АТФ, фотосинтезе, окислительно-восстановительных реакциях и ферментах, удаляющих АФК [35]. Точно так же транскрипты генов, кодирующих белки, участвующие в фотосинтетическом переносе электронов, метаболизме углерода и биосинтезе хлорофилла, активировались 100 мМ NaCl в Atriplex canescens [36], что указывает на ключевую роль этих белков в устойчивости к соли. Более того, протеомный профиль двух сортов риса, контрастирующих по солеустойчивости, показал, что белки, связанные с фотосинтезом и энергетическим обменом, в изобилии экспрессировались только у солеустойчивого сорта в условиях солевого стресса [37]. Соответственно, белки комплекса цитохрома b6f, реакционного центра ФСI и АТФ-синтаз хлоропластов изменяются в ответ на солевой стресс, что указывает на то, что эти изменения в большом количестве могут модулировать эффективность переноса электронов и трансмембранные электрохимические протонные градиенты, тем самым влияя на образование НАДФН, синтез АТФ и тепловыделение при стрессе [38–40].
Большинство растений в стрессовых условиях увеличивают клеточную концентрацию осмотически активных соединений. Они смягчают ингибирующее действие высоких концентраций ионов на активность ферментов. Аминокислоты и некоторые производные аминокислот, сахара, ациклические и циклические полиолы, фруктаны и четвертичные амино-, эктоиновые и сульфониевые соединения действуют как совместимые растворенные вещества [41]. Совместимые растворенные вещества играют осморегуляторную функцию, которая накапливается в ответ на осмотический стресс, в то время как некоторые растворенные вещества, такие как трегалоза, не реагируют на осмотический стресс, но защищают даже при низких концентрациях и могут действовать как осмопротекторы [42]. Низкая концентрация маннита в хлоропластах помогает уменьшить повреждение за счет образования гидроксильных радикалов, а другие совместимые растворенные вещества в высоких концентрациях снижают ингибирующее действие ионов на активность ферментов. Стабилизация белков, белковых комплексов или мембран и удаление кислородных радикалов являются основной функцией совместимых растворенных веществ. Засоление почвы или воды является одним из основных факторов стресса и может серьезно ограничить урожайность, особенно в засушливых и полузасушливых регионах. На рисунке представлены физиологические, биохимические и генетические реакции растений на солевой стресс.
Накопление пролина является обычной адаптивной реакцией на различные абиотические стрессы [44]. В ряде исследований показано, что метаболизм пролина оказывает комплексное влияние на развитие, реакцию на стресс, и накопление пролина важно для устойчивости к определенным неблагоприятным условиям окружающей среды [45, 46]. Пролин концентрируется в цитозоле, хлоропластах, цитоплазме и вакуолях. Он играет важную функцию, такую как осмотическая регуляция, детоксикация активных форм кислорода, действует как антиоксидант, стабилизатор белков и белковых комплексов. В работе [47] отмечено значительно более высокое содержание пролина и глицина-бетаина в растениях, подвергшихся солевому стрессу (EC 16–20 dS/м), по сравнению с контролем. Пролин и глицин-бетаин обнаружены в солечувствительных сортах ячменя, внося существенный вклад в осмолярность клеток, компенсируя снижение цитозольного K+ [48]. Помимо своей роли в устойчивости к соли, пролин действует как сигнальная или регуляторная молекула для поддержания пулов метаболитов и окислительно-восстановительного баланса, а также контролирует экспрессию генов [45]. Глицин-бетаин, обнаруженный в хлоропластах, также играет важную роль в осмотической регуляции, защите тилакоидной мембраны, защите хлоропластов и системы фотосинтеза II (ФСII) в условиях стресса [49].
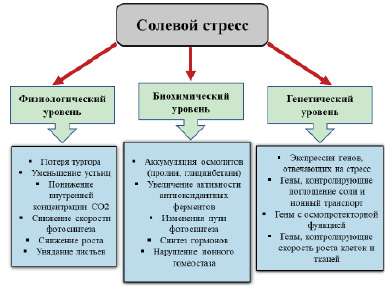
Формирование солеустойчивости на физиологическом, биохимическом и генетическом уровнях [43]
Солевой стресс отрицательно влияет на рост и развитие растений, в то время как растения развили регуляторные механизмы, которые позволяют им адаптироваться к этим неблагоприятным условиям. Так, подавление роста растений под действием солевого стресса происходит из-за снижения фотосинтеза. В свою очередь, замедление скорости роста в ответ на солевой стресс приводит к увеличению выживаемости растений. Формирование устойчивости к засолению является сложным процессом, реализующимся за счет физиологических, биохимических и молекулярных механизмов. Ключевую роль в этом процессе играют осмотическая адаптация, Na+ обмен, индукция активности антиоксидантных ферментов и регуляторов роста растений. Клетки растений претерпевают большие изменения, чтобы реагировать и защищаться от солевого стресса. Растительные клетки активируют переносчики ионов и каналы для восстановления ионного баланса. В процессе переноса ионов удаление Na+, приток K+, Ca2+ помпа и обмен Na+/H+ важны для солеустойчивости растений. Кроме того, стратегии снижения осмотического и окислительного стресса также используются для растений в условиях засоления.
Приведенные выше исследования показывают, что солевой стресс проявляет различное тормозящее влияние на биоэнергетические процессы фотосинтеза, подавляя раскрытие устьиц, препятствуя ассимиляции СО2, блокируя электрон-транспортную цепь, внося изменения в экспрессию генов, связанных со стрессом. Фотосинтез напрямую влияет на развитие и урожайность растений, в связи с чем особую актуальность представляет изучение механизмов адаптации (способность противостоять фотоокислительному повреждению, специализированные системы для защиты фотосинтетического аппарата) к стрессу у солеустойчивых сортов.
Библиографическая ссылка
Рахматуллина Н.Ш., Насриддинова П.М., Акиншина Н.Г., Азизов А.А., Мирходжаев У.З. АДАПТАЦИЯ ФОТОСИНТЕТИЧЕСКОГО АППАРАТА РАСТЕНИЙ К СОЛЕВОМУ СТРЕССУ // Научное обозрение. Биологические науки. 2022. № 1. С. 56-61;URL: https://science-biology.ru/ru/article/view?id=1261 (дата обращения: 02.02.2026).


 science-review.ru
science-review.ru