В настоящее время существует ряд перспективных экологически безопасных средств защиты растений. Одними из них являются индукторы устойчивости к болезням, т.е. элиситоры – вещества биотической и абиотической природы, которые распознаются растениями как сигнал, в ответ активируются защитные механизмы растений, снижающие действие биотических и абиотических стрессов [1]. Элиситоры распознаются растениями, они активируют сигнальные системы, которые приводят к экспрессии генов, связанных с защитой и, таким образом, повышают устойчивость растений. Эти вещества нетоксичны и не оказывают вредного воздействия на окружающую среду [2].
Во многих литературных источниках отмечается, что помимо элиситоров растительного происхождения доказано применение элиситоров на основе бактерий, которые положительно влияют при снижении патогенных инфекций у растений [3].
Элиситоры на основе экссудатов PGPR (ризобактерии, способствующие росту и развитию растений) являются мощными агентами в борьбе с фитопатогенами [4], а также фильтраты этих бактериальных культур, таких как Bacillus subtilis, также могут оказывать защитное действие на урожай [5, 6].
В современном микробиологическом производстве каждый из различных биопрепаратов разрабатывается на основе специальных технологий. Однако микроорганизмы, используемые во всех производственных процессах, проходят практически одни и те же этапы жизни. С учетом этого были приняты модельные схемы технологических процессов, пригодные для микробиологического синтеза [7, 8].
Целью исследования было получение элиситора на основе местных штаммов ризобактерий и разработка технологии его производства в промышленных условиях для выращивания лекарственного растения артишока (Cynara scolymus L.).
Материалы и методы исследования
Материалами исследования служили биопрепарат Замин-М на основе местных штаммов бактерий Bacillus subtilis СКБ-309, Bacillus megaterium СКБ-310 и Pseudomonas stutzeri СКБ-308 и его автолизат – «Элиситор», растения артишока колючего (Cynara scolymus L.).
Выращивание ризобактерий на питательной среде
Ризобактерии выращивали на модифицированной питательной среде следующего состава (г/л): пептон (H. Media) –10; MgSO4x7H2O – 0,3 г/л; глюкоза – 20; К2НРО4 – 0,4; NaCl – 3,0; СаСО3 – 3,0; рН – 6,8; 1000 мл дистиллированной воды. Среду стерилизовали в автоклаве Systec (D-35440 Linden, Германия) при 120 °С в течение 20 мин при 120 °С. В качестве посадочного материала использовали культуры микроорганизмов. Пересев проводили в ламинарном боксе (BSC 120A, EU). Посевной материал выращивали в термостате (ТС 1/80-ЦПУ, Россия) при температуре 28 °С в течение 72 ч. Изготовление посадочного материала для производства осуществляяли в лаборатории агробиотехнологии Ташкентского государственного аграрного университета.
Культуры инкубировали при 28 °С в течение 48 ч в пептонной среде (10 %), затем добавляли 100 мл ферментационной среды (пептон, глюкоза, кукурузная мука, дрожжевой экстракт, NaCl, CaCO3, pH – 6,8) в течение 1 сут проводили в колбах Эрленмейера объемом 500 мл.
Способ получения экстракта элизатора и выделения
Для получения элиситорного экстракта ассоциацию ризобактерий, выращенную в течение 3 сут в термостате, автоклавировали в автоклаве для микроорганизмов (D-35440 Linden, Германия) в течение 20 мин при 1 атм 120 °С, автолизат получали фильтрованием.
Хранение посевного материала
Коллекционные материалы хранились в пробирках, со средой Сабуро (г/л): глюкоза – 20,0, пептон – 10,0, агар – 18,0, вода водопроводная – 1000,0, рН 6,5±1.
Аппаратура
Для получения элиситора использован ферментер с барбатерным аэратором (рис. 1). Питательная среда и бактериальная культура подавались в емкость через подтрубки и затем по трубам. Воздух выпускается через капельный отделитель жидкости, установленный на крышке ферментера. Смесь переносили из большого и малого ферментеров в экстрактор.

Рис. 1. Проект технологии извлечения элиситора: 1. Культура. 2–3. Прибор для приготовления питательной среды и стерилизации. 4. Ферментер для выращивания исходного инокулята. 5. Основной ферментер для культивирования микроорганизмов. 6. Резервуар. 7. Экстрактор. 8. Контейнер для хранения биомассы. 9. Фильтр. 10. Дозатор. 11. Упаковочное оборудование. 12. Хранилище для остаточной жидкости
Экстрактор состоит из загрузочной колонны, горизонтального шнека и вертикальной экстракционной колонки.
На выходах шнековых валов из крышек экстракторных колонок установлены уплотнения, препятствующие утечке биоматериала. Экстрагент переносится в верхнюю часть экстракционной колонны и движется по ней вниз. Экстрагент пропускают через горизонтальный шнек и загрузочную колонну вместе с извлекаемыми веществами через различные участки экстракта.
Для нахождения производительности (кг/ч) непрерывно работающей шнековой колонны по обрабатываемому материалу используется следующая формула:
Q = 60Ky (πD2/4) S n ρ,
где Ку – 0,7–0,6 – нагрузочный коэффициент сжатия нагрузочной колонны сжатия;
D – диаметр шнека, м;
S – загрузочная колонна приемника первой ступени, м;
n – частота вращения шнека, мин-1;
ρ – плотность извлекаемого материала, кг/м3.
Одним из основных показателей, характеризующих работу экстракторов, является мощность экстрактора – Q. Исходя из этого, Q определяется по формуле
Q = 60fзап · fкуз · π · r12 · h · ω · ρ,
где r1 – радиус винта, м,
h – шаг винта, м,
ω – частота вращения, мин-1,
ρ – скорость извлечения материала, кг/м3.
Результаты исследования и их обсуждение
Уникальные свойства, термолабильность и стерильность микробиологического препарата накладывают дополнительные ограничения на конструктивное производство. По этой причине реагенты, которые обычно используются для химических производств, во многом не подходят для биотехнологических процессов [http://www.biotechnolog.ru/prombt/prombt5_2.htm].
Цикл ферментации начинали с внесения микроорганизмов в готовую к употреблению среду, включающую в себя все компоненты. В наших экспериментах микроорганизмы добавляли в стерилизованную среду при температуре 28±20 °С. Инактивация источников углерода перед инокуляцией или на разных стадиях ферментации может быть достигнута за счет поддержания определенной оптимальной концентрации инокулюма, которую можно изменять соответственно конкретному микроорганизму. Создание заданного значения рН или полная стерилизация всех питательных веществ и самого биореактора является важным этапом, и в ходе исследования было использовано значение рН на уровне 6,8–7,0.
Процесс фильтрования для стерилизации газов (прежде всего воздуха) осуществлялся на специальных фильтрах. Фильтрующий материал периодически стерилизовали подачей пара в заданное время.
Этапы культивирования посевного материала производили по следующей схеме:
1. Получение необходимых культур микроорганизмов из лабораторной коллекции.
2. Культивирование посадочного маточного материала в инокуляторе (емкостью 5 л).
3. Выращивание ризобактерий в большом ферментере (оборудовании емкостью 50 л).
4. Накопление культур ризобактерий в малой емкости (5 м3) для получения автолизата (обработка паром в течение 20 мин при 1 атм, 120 °С).
5. Охлаждение.
6. Экстракция.
7. Помещение биомассы в резервуар для хранения.
8. Перенос в мерный дозатор.
9. Упаковка.
10. Нейтрализация остаточной жидкости и слив жидкости в качестве субстрата для биоудобрения.
На первом этапе посадочный материал выращивали в микробиологической лаборатории. Первоначально культивирование проводили на стерильной (1) агарозной питательной среде, на среде питательной среды, при значении рН 6,8–7,0; температура 28±2 °С, в течение 72 ч).
Предварительно выращенные культуры на косяках с агаризованной средой (1) отбирали с промыванием стерильной водой и переносили в колбах Эрленмейера объемом 250 мл со стерильной модифицированной жидкой средой Сабуро по 50–100 мл. Культуры инкубировали (1) при температуре 28±20 °С и в течение 72 ч. Колбы устанавливали на качалку с регулируемой температурой (28 °С). Средняя скорость вращения качалки составляла 240 об/мин.
На втором этапе культивирования приготовленную стерильную среду до оптимальной для роста микроорганизмов температуры 28±2 °С, 5–8 % культурального материала в колбе переносили в инокулятор (3) с рН 6,8–7,0; температура 28±2 °С, в течение 72 ч. Оборудование включало барбатер аэрирования, датчики для измерения температуры, рН, пенообразования. Количество питательной среды в оборудовании не превышало 60 % от общей вместимости оборудования.
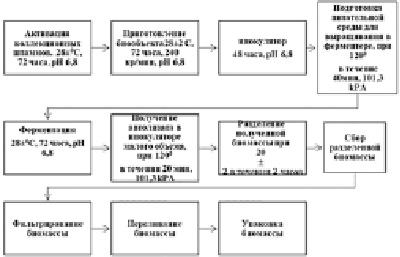
Рис. 2. Технологическая схема получения элиситора из штаммов микроорганизмов Bacillus subtilis СКБ-309, Bacillus megaterium СКБ-310 и Pseudomonas stutzeri СКБ-308
Поддержание стабильного режима роста при подготовке посадочного материала в оборудовании является ключевым фактором. Мониторинг этого требует взятия проб и их исследования для микробиологического и биохимического анализа. Культивирование продолжали до содержания ризобактерий в корме 1,5 %/биомассы/л (в пересчете на сухую массу). Продолжительность данного процесса занимала 72 ч.
Третий этап – перенос посадочного материала на инокулятор 50 м3. Для этого всю культуральную жидкость переносили из небольшого инокулятора (4) на предварительно стерилизованную среду в объеме инокулята 50 м3 (5). При этом каждый микроорганизм имел равное соотношение количества в зависимости от его особенностей. Исходя из того, что этот процесс осуществлялся в фазе экспоненциального роста культуры, в посевную технику засевали 10 % от маточного материала из количества питательной среды. Культивирование заняло 48 ч.
На четвертом этапе процесса были продолжены на оборудовании (6) объемом 5 м3. Культивирование начинали путем смешивания культур в питательной среде в условиях умеренного рН – 6,8, температуры 28 °С и непрерывной аэрации. Накопление ризобактериальной биомассы продолжалось в течение 12 ч. Суспензию в ферментере переносили в экстрактор (7) и получали экстракт обработкой при 120 °С в течение 20 мин. Экстракт фильтровали и переносили резервуар для хранения биомассы (8) удалением фильтрата. Фильтрат подавался в дозатор (10) и расфасовывался по 1 л (11). Остаток утилизировали сбором в специальный контейнер (12) с целью получения жидкого удобрения для растетний (рис. 2).
Заключение
Таким образом, в результате исследований разработана технология получения элиситора на основе местных бактериальных штаммов Bacillus subtilis СКБ-309, Bacillus megaterium СКБ-310 и Pseudomonas stutzeri СКБ-308 и модифицирован технологический процесс.
Элиситор получен на основе несколько этапных манипуляций, таких как получение необходимых культур микроорганизмов из лабораторной коллекции; культивирование посадочного маточного материала в инокуляторе; выращивание ризобактерий в большом ферментере; накопление культур ризобактерий в малом приборе для получения автолизата; охлаждение; экстракция; помещение биомассы в резервуар для хранения; перенос в мерный дозатор; упаковка; нейтрализация остаточной жидкости и слив жидкости в качестве субстрата для биоудобрения.
Библиографическая ссылка
Собирова М.Б., Муродова С.С. ТЕХНОЛОГИЯ ПОЛУЧЕНИЯ ЭЛИСИТОРА, ЭФФЕКТИВНО ВЛИЯЮЩЕГО НА БИОЛОГИЧЕСКИЕ СВОЙСТВА CYNARA SCOLYMUS L. // Научное обозрение. Биологические науки. 2022. № 1. С. 68-72;URL: https://science-biology.ru/ru/article/view?id=1263 (дата обращения: 07.03.2026).
DOI: https://doi.org/10.17513/srbs.1263


 science-review.ru
science-review.ru