Переработка, обезвреживание и утилизация всех видов отходов, в том числе органических, – актуальная экологическая проблема не только Республики Казахстан, но и всего мира. Одним из направлений переработки отходов является получение биоэнергии и биогаза из любого типа органического материала – сточных вод, их осадков, отходов животноводства и др. Производство биоэнергии имеет множество преимуществ для общества и вносит важный вклад в устойчивое развитие страны. В этом направлении перспективно развитие альтернативной энергетики, в частности биоэнергетики. Не утилизация, не сжигание, а именно биоконверсия накопившихся органических отходов в биоэнергию с последующим получением ценнейшего непосредственно для сельского хозяйства биоудобрения решила бы проблему избыточного накопления этих отходов и снизила бы зависимость потребителей от традиционных источников энергии, переводя их в экологически безопасный и полезный продукт. Переход отходов в полезный продукт (или чистая экология) осуществляется благодаря микроорганизмам, участвующим в процессе биоконверсии, протекающей в специальных установках. Для предотвращения загрязнения окружающей среды, водных экосистем важно разработать и внедрить экологически чистые технологии для переработки органических отходов в биоэнергию или ценное органоминеральное биоудобрение с использованием потенциала микроорганизмов. В эффективном производстве биоэнергии немаловажную роль играют сообщества микроорганизмов. Бактерии являются основным источником биоэнергии, они используют органические отходы для своей жизнедеятельности. На сегодняшний день развитие технологий привело к тому, что эти отходы становятся источником сырья для переработки и получения ценных продуктов.
Альтернативным вариантом использования сточных вод может служить анаэробное брожение, в результате которого можно получить высокоэффективный вторичный продукт в качестве биогаза, электроэнергии и органического удобрения для сельскохозяйственных угодий.
Таким образом, сточные воды являются ценным источником биогаза, биоэнергии и органических удобрений. Однако неадекватное управление ими приводит к множеству проблем, таких как загрязнение окружающей среды, эвтрофикация, выбросы парниковых газов, негативное влияние на здоровье человека и снижение экономической ценности отходов.
Настоящее исследование направлено на выделение микроорганизмов, продуцирующих гидролитические ферменты, и оценку их способности разлагать белки, жиры и углеводы в лабораторных условиях.
Цель исследования – выделение, скрининг микроорганизмов и создание на их основе консорциума для дальнейшей разработки метода биотехнологической переработки сточных вод в биогаз и органическое удобрение.
Материалы и методы исследования
Объектами исследования служили биомассы 3 видов биогазовых установок из Алматинской области, а также пробы сточной воды КОС г. Нур-Султан, г. Форт-Шевченко, навоза КРС и почвы и выделенные из них микроорганизмы различных таксономических групп, а также коллекционные штаммы ТОО «Экостандарт.kz»: Bacillus coagulans 918, Alcaligenes faecalis 44, Lysinibacillus sphaericus/Lysinibacillus fusiformis 559, Escherichia coli 914 и Lysinibacillus fusiformis 859.
Выделение и изучение фенотипических признаков выделенных микроорганизмов проводили стандартными микробиологическими методами. При идентификации бактериальных изолятов осуществляли сравнительный анализ их морфологических, культуральных, биохимических свойств. Определяли морфологию вегетативных клеток, спорообразование, подвижность, окраску по Граму, каталазную, оксидазную, амилолитическую, липолитическую, целлюлозолитическую, протеолитическую и сахаролитическую активность.
Чистые культуры микроорганизмов выделяли методом накопительных культур [1, 2] с последующим высевом на селективные среды. Инкубацию культур производили при 37°С и 45°С в течение 24–72 часов. Оценку чистоты проводили с помощью иммерсионного микроскопа. Мазки окрашивали по Граму [1]. Принадлежность изучаемых культур к группе грамположительных или грамотрицательных бактерий определяли экспресс-методом Грезерсона (1979).
Культуральные особенности изолятов изучали путем проведения серийных разведений 10-1 – 10-10 и инокуляции штамма в соответствующие стерильные твердые среды. Чашки инкубировали в течение 24–72 ч и наблюдали характеристики колоний.
Способность исследуемых культур ферментировать углеводы изучали на универсальных средах Гисса (с арабинозой, фруктозой, меллибиозой, трегалозой, маннитом, галактозой, адонитом и сорбитолом) и Клиглера (с глюкозой и лактозой). Визуально отмечали образование газа и кислоты, выделение сероводорода определяли на среде Клиглера.
Изучение фенотипических признаков микроорганизмов-деструкторов проводили стандартными микробиологическими методами [1–3]. Определение каталазной активности проводили с 3%-ным раствором пероксида водорода.
Определяли титр жизнеспособных клеток микроорганизмов по Miles and Misra [4]. Определяли ферментативную активность микроорганизмов – активность гидролаз и оксидоредуктаз: целлюлолитическую, липолитическую, протеолитическую и амилолитическую активности [5–8].
Скрининг активных культур проводили путем изучения биологических свойств культур микроорганизмов.
Идентификацию культур микроорганизмов до вида проводили с использованием MALDI-ToF масс-спектрометра серии FLEX производства Bruker.
Результаты исследования и их обсуждение
Выделение активных штаммов микроорганизмов, способных ферментировать биомассу из сточной воды в биогаз
Основу биогазовых технологий составляют сложные процессы биологического окисления органических веществ под воздействием особой группы анаэробных микроорганизмов. Учитывая, что в процессе разложения органических веществ участвуют разные группы микроорганизмов: гидролитические, кислотообразующие и метанообразующие бактерии, нами были проведены исследования по выделению ферментативно активных (амилолитических, протеолитических, целлюлозолитических и др.) микроорганизмов.
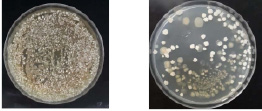
Результаты выделения микроорганизмов на плотных селективных и неселективных питательных средах СПА и МКС № 2 показаны на рисунке 1.
Выделение анаэробных культур микроорганизмов на жидких питательных средах Китта–Тароцци, СПБ, МРС под высоким столбиком вазелина и твердых питательных средах с применением биологического метода удаления кислорода по Фортнеру показано на рисунке 2.
При посеве по методу Фортнера на одну половину чашки засевали коллекционный штамм ТОО «Экостандарт.kz» облигатный аэроб – Ser. marcescens 965, на вторую – исследуемую культуру. Культивирование проводили в эксикаторе. Изучены культурально-морфологические признаки – характер роста культур на плотных агаризованных средах.
В результате выделения чистых изолятов в работу взяты 24 культуры микроорганизмов. Наибольшее количество изолятов выделено из сточной воды КОС г. Нур-Султан – 8, из сточной воды КОС г. Форт-Шевченко – 8 изолятов, из навоза КРС – 3, из почвы – 5 изолятов, а также отобраны 5 коллекционных штаммов.
Титр жизнеспособных клеток изученных культур был в пределах 107 – 109 КОЕ/см3. У 6 из 29 (20,7%) культур микроорганизмов титр ЖСП – 1,5–7×109 КОЕ/см3. 10 (34,5%) культур микроорганизмов показали титр жизнеспособных клеток на уровне 107 КОЕ/ см3. Титр ЖСП культур ниже 107 КОЕ/см3 считается недопустимым при разработке биопрепаратов и заквасок на основе промышленно ценных микроорганизмов, так как при воздействии неблагоприятных условий они могут терять свою жизнеспособность до более низких титров.
а) б)
Рис. 1. Рост культур на плотных средах: а) агаровая МКС №2; б) питательный агар

а) б)
Рис. 2. Выделение анаэробных культур микроорганизмов: а) рост на среде СПБ и МРС под высоким столбиком вазелина; б) посев по Фортнеру
Скрининг и отбор наиболее активных изолятов
Биогаз – это конечный продукт жизнедеятельности бактерий, питающихся входным биодеградируемым сырьем в разной фазе анаэробного брожения (в фазе гидролиза – гидролитиками, в фазе ацидогенеза – ацидогенными бактериями, в фазе ацетогенеза – ацетогенными бактериями и в конечной фазе – метаногенами: метанообразующими бактериями и археей). Биологические свойства микроорганизмов, в частности ферментативная активность культур, являются важным критерием, требующимся при создании на их основе заквасок для получения биогаза. С целью проведения скрининга культур нами изучены основные показатели биологической активности культур микроорганизмов. Изучение ферментативных свойств проводили по способности разлагать углеводы, белок и жиросодержащие продукты, для этой цели у исследуемых культур определяли наличие амилолитической, протеолитической, липолитической и целлюлолитической активностей.
При изучении амилолитической активности отобраны культуры, образующие на крахмалсодержащей среде зону гидролиза, которая оставалась бесцветной или приобретала красно-бурую окраску при гидролизе крахмала до декстринов, тогда как культуры, не гидролизующие углевод, окрашивались в сплошной синий цвет. В результате проведенных экспериментов из числа выделенных были определены 4 активные культуры, способные гидролизовать крахмал, и 1 коллекционный штамм Bacillus coagulans 918. Однако культура С/в 1.5 показала высокую амилолитическую активность, образовав большие зоны гидролиза крахмала диаметром до 18,0±0,10 мм, также наибольшую активность проявила культура С/в 4.5 – до 15,0±0,12 мм. Изоляты С/в 4.4, С/в 1.6 и штамм Bacillus coagulans 918 имели среднюю амилолитическую активность, их результаты были в пределах 4,0±0,43 и 4,7±0,37 мм соответственно.
Протеазы выделяются различными видами бацилл, актиномицетов, мицелиальных грибов и другими микроорганизмами. Активность внеклеточных протеаз определяли, используя в качестве специфического субстрата желатину и казеин. Разжижение желатина или его отсутствие отмечали визуально. Гидролиз казеина определяли по зоне просветления среды вокруг колонии или выросших по штриху микроорганизмов. При этом из изученных 29 культур способностью разжижать желатин обладали 20 (69,0%), тогда как 13 (44,8%) культур были способны расщеплять казеин на молочном агаре. При этом протеолитическая активность культур в отношении казеина была в диапазоне 2,5±0,69 – 11,0±0,16 мм. Самая высокая активность наблюдается у культуры С/в 4.3. Семь (24,1%) культур проявили активность в пределах 7,0±0,25 – 8,0±0,22 мм. Культуры микроорганизмов П 2.3, С/в 1.6, С/в 4.8 и коллекционный штамм Lysinibacillus fusiformis 859 проявили данную активность от 5,2±0,33 до 6,3±0,27 мм.
Продуценты липаз обнаружены среди дрожжей, мицелиальных грибов, бактерий рода Clostridium и других микроорганизмов. Культуры, продуцирующие липазу, выявляли на средах с добавлением твина, они образовывали вокруг штриха или колонии непрозрачную зону кальциевых солей жирных кислот, освобожденных из твина. В результате липолитическую активность с показателем активности от 1,5±1,15 мм до 11,7±0,15 мм проявили 7 из 24 (29,2%) вновь выделенных изолятов и коллекционный штамм Lysinibacillus fusiformis 859. При этом коллекционный штамм Lysinibacillus fusiformis 859 обладал наибольшей активностью, а наименьшая активность зафиксирована у культуры П 3.1.
Для выявления культур, продуцирующих целлюлозолитические ферменты, определяли диаметр зон просветления окраски вокруг выросших колоний после прокрашивания чашек красителем конго красным. В результате 10 изолятов из 29 (34,5%) культур микроорганизмов обладали способностью к разложению Na-КМЦ. При этом изоляты П 2.2 и Н 1.3 проявили наибольшую активность, которая была равна 11,3±0,15 и 11,0±0,16 мм соответственно. Следующий наивысший показатель активности показал изолят С/в 4.5, его активность зафиксирована в пределах 10,0±0,17 мм.
Культуры, обладающие ферментативной активностью, представлены на рисунке 3.
На основе проведенных исследований выявлено наличие протеолитической активности на молочном агаре у 13 (44,8%) культур, на среде с желатином – у 20 (69,0%), амилолитической активности – у 5 из 29 (17,2%), липолитической активности – у 8 (27,6%) и целлюлолитической активности – у 10 (34,5%) культур микроорганизмов. Для дальнейших исследований нами отобраны 17 наиболее активных изолятов, проявивших наибольшую ферментативную активность: С/в 3.1, П 1.1, С/в 2.1, П 2.1, П 2.2, П 2.3, Н 1.3, П 3.1, Н 2.2, С/в 1.3, С/в 1.5, Св 1.6, С/в 4.3, С/в 4.4, С/в 4.5, С/в 4.7, С/в 4.8 и 2 штамма Bacillus coagulans 918 и Lysinibacillus fusiformis 859.
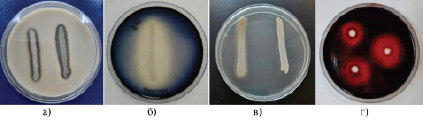
Рис. 3. Ферментативная активность культур микроорганизмов: а) протеолитическая активность; б) амилолитическая активность; в) липолитическая активность; г) целлюлолитическая активность
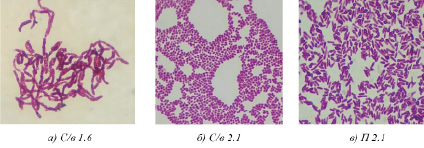
Рис. 4. Микроскопическая картина культур микроорганизмов, окрашенных по Граму, х100
Штамм Bacillus coagulans 918 и изолят С/в 1.5 были выделены на питательной среде MРС, и эта среда является для них оптимальной, так как на других средах они растут плохо либо не растут вовсе. В результате проведенных исследований по изучению культуральных, морфологических и биологических свойств изолят С/в 1.5 был предварительно отнесен к молочнокислым бактериям (МКБ).
Для определения родовой и видовой принадлежности активных выделенных культур микроорганизмов были изучены их культурально-морфологические и биохимические свойства общепринятыми методами в соответствии с определителем Берджи путем постановки дифференциальных тестов и методик, а также проведена идентификация культур микроорганизмов до видовой принадлежности путем сравнительных анализов спектров тотальных клеточных белков методом Maldi ToF масс-спектрометрии (Bruker).
С помощью микроскопии окрашенных по Граму мазков активных культур было определено, что в исследуемых образцах присутствуют грамположительные и грамотрицательные микроорганизмы разной формы (от кокков до палочек разных размеров), палочки с закругленными или обрубленными концами, спорообразующие или не образующие споры, расположенные одиночно, попарно, в цепочку или скоплениями. На рисунке 4 представлена микроскопия некоторых выделенных чистых культур.
Для проведения идентификации активных культур микроорганизмов по фенотипическим свойствам использовали чистую, свежую культуру на плотной агаризованной среде. Чистые культуры микроорганизмов были изучены по следующим признакам: определение морфологии, окраска по Граму, подвижность, спорообразование, наличие пигмента, а также отношение к температуре роста.
В целях изучения физиолого-биохимических свойств культур микроорганизмов, проявивших наибольшую активность, был поставлен ряд тестов.
Оценка сахаролитической и биохимической активности культур микроорганизмов по способности сбраживания углеводов была проведена на средах Гисса и Клиглера (рис. 5).

Рис. 5. Биохимические показатели культур микроорганизмов на среде Клиглера: а) пестрый ряд на среде Гисса с углеводами; б) ферментация глюкозы и лактозы с выделением сероводорода; в) ферментация углеводов с образованием газа
По отношению к углеводам на среде Гисса из 17 активных культур микроорганизмов 13 культур усваивают трегалозу, 12 усваивают фруктозу, 6 – галактозу, 7 выделенных изолятов усваивают маннит, 5 усваивают арабинозу, 3 – меллибиозу, 3 усваивают адонит и всего 2 выделенных изолята ферментируют сорбитол. Оксидазный тест показал, что все активные культуры были оксидазоотрицательными, тогда как тест на каталазу был противоположным: все культуры, кроме изолятов С/в 4.4 и С/в 4.7, были каталазоположительными.
В результате постановки методики по изучению способности культур к сбраживанию углеводов до кислоты и газа, а также выделению сероводорода на среде Клиглера было определено, что 14 выделенных изолятов усваивают глюкозу до образования кислоты, при этом 2 из них – с образованием газа (рис. 5в). 4 выделенные активные культуры сбраживают лактозу до кислоты, но с отсутствием газа. Шесть из 19 активных культур способны выделять сероводород. Известно, что большая часть сероводорода на планете генерируется сульфидогенными микробными сообществами, в них входят более 60 родов бактерий и археи рода Archaeoglobus (типовый вид A. fulgidus), роды Thermocladium и Caldivirga. В процессе жизнедеятельности они обычно конкурируют с метаногенами за водород и другие субстраты, однако нами принято решение идентифицировать все изоляты отобранные после скрининга.
В результате проведения биохимической идентификации изоляты С/в 3.1, П 1.1, П 2.1, П 2.2, П 2.3, П 3.1, Н 2.2, С/в 1.3, С/в 1.6, С/в 4.3, С/в 4.5, С/в 4.7, С/в 4.8 были предварительно идентифицированы до рода Bacillus. Изолят С/в 2.1 – грамотрицательные коккобациллы, споры не образуют, подвижные, не ферментировали углеводы, но выделяли сероводород; каталазоположительный, но оксидазоотрицательный, в связи с чем был предварительно отнесен в род Acinetobacter. Изолят Н 1.3 – грамположительные кокки, споры не образуют, не подвижные, не ферментировали мелибиозу, адонит и сорбитол, не выделяет сероводород; каталазоположительный, но оксидазоотрицательный, в связи с чем был предварительно отнесен в род Enterococcus. Изолят С/в 1.5 растет на среде МРС, грамотрицательные палочки, не подвижные, не образуют спор; оксидазоотрицательный, каталазоположительный, ферментирует глюкозу до кислоты и газа, не выделяет сероводород; согласно полученным данным можно предположить, что изолят относится к семейству Enterobacteriaceae, группы Klebsielleae. Изолят С/в 4.4 – грамотрицательные палочки, подвижные, спор не образуют; ферментирует глюкозу до кислоты и газа, выделяет H2S, гидролизует крахмал, казеин, разжижает желатин, арабинозу, мелибиозу, адонит, сорбитол и лактозу не сбраживает; на основе полученных данных он был предварительно отнесен к роду Aeromonas.
В результате сравнительного анализа белковых профилей всех выделенных бактерий, кроме 1-й культуры (не имеет сходства по белку ни видовой, ни родовой), они были идентифицированы как Bacillus cereus, megaterium, coagulans, subtilis, mojavensis, pummilis, Klebsiella pneumoniae, Enterobacter cloacae, Lysinibacillus fusiformis/boronitolerans, Acineaumtobacter bannii/ Acinetobacter baumannii и Aeromonas veronii. На основе полученных данных в ходе изучения фенотипических и физиолого-биохимических характеристик изолят П1.1 был идентифицирован как Bacillus cereus.
Таким образом, в результате проведенного исследования по выделению и скринингу наиболее активных штаммов в качестве перспективных при создании консорциума заквасочных культур для получения биогаза нами отобраны 17 наиболее активных кандидатов и 2 коллекционных штамма, проявивших наибольшую ферментативную активность: Bacillus cereus С/в 3.1, Bacillus cereus П 1.1, Acinetobacter bannii/Acinetobacter baumannii С/в 2.1, Lysinibacillus fusiformis/Lysinibacillus boronitolerans П 2.1, Bacillus pumilus П 2.2, Bacillus cereus П 2.3, Enterobacter cloacae Н 1.3, Bacillus cereus П 3.1, Bacillus cereus Н 2.2, Bacillus pumilus С/в 1.3, Klebsiella pneumoniae С/в 1.5, Bacillus megaterium С/в 1.6, Bacillus cereus С/в 4.3, Aeromonas veronii С/в 4.4, Bacillus subtilis С/в 4.5, Bacillus cereus С/в 4.7, Bacillus mojavensis/Bacillus subtilis С/в 4.8, Bacillus coagulans 918 и Lysinibacillus fusiformis 859.
Заключение
На основе проведенных экспериментов в целях выделения перспективных микроорганизмов для создания эффективной закваски в целях получения биогаза всего были выделены 24 изолята: из сточной воды КОС г. Нур-Султан – 8, из сточной воды КОС г. Форт-Шевченко – 8, из навоза КРС – 3, из почвы – 5 изолятов. Также для исследования нами были отобраны такие виды коллекционных штаммов, как: Bacillus coagulans 918, Alcaligenes faecalis 44, Lysinibacillus sphaericus/ Lysinibacillus fusiformis 559, Escherichia coli 914, Lysinibacillus fusiformis 859. Изучение ферментативной активности микроорганизмов показало наличие протеолитической активности на молочном агаре у 13 культур, на среде с желатином – у 20, амилолитической активности – у 5, липолитической активности – у 8 и целлюлолитической активности – у 10 культур микроорганизмов. Для дальнейших исследований нами отобраны 17 наиболее активных изолятов, проявивших наибольшую ферментативную активность: С/в 3.1, П 1.1, С/в 2.1, П 2.1, П 2.2, П 2.3, Н 1.3, П 3.1, Н 2.2, С/в 1.3, С/в 1.5, Св 1.6, С/в 4.3, С/в 4.4, С/в 4.5, С/в 4.7, С/в 4.8 и 2 коллекционных штамма: Bacillus coagulans 918, Lysinibacillus fusiformis 859.
В результате проведения фенотипической идентификации и идентификации отобранных микроорганизмов до вида с помощью метода масс-спектрометрии Maldi ToF (Bruker) была определена их принадлежность к Bacillus cereus, megaterium, coagulans, subtilis, mojavensis, pummilis, Klebsiella pneumoniae, Enterobacter cloacae, Lysinibacillus fusiformis/boronitolerans, Acineaumtobacter bannii/ Acinetobacter baumannii и Aeromonas veronii.
На основе полученных данных считаем, что все отобранные нами штаммы микроорганизмов являются перспективными для создания на их основе заквасок в целях получения биометана из сточной воды. Однако для создания консорциумов микроорганизмов из отобранных нами 19 активных штаммов планируется использовать только те штаммы, которые имеют более двух показателей ферментативной активности и у которых отмечена высокая активность. К сожалению, на данном этапе исследования нам не удалось получить чистые культуры анаэробных микроорганизмов, в связи с чем работа по выделению и получению чистых культур анаэробных метаногенных микроорганизмов, а также изучение их ферментативной активности будут продолжены. Получение метаногенных микроорганизмов с широким спектром ферментативной активности, которые пополнят фонд коллекции промышленно ценных штаммов микроорганизмов, и создание на их основе эффективной закваски для получения биогаза являются следующей задачей данного исследования.
На основе всех представленных данных можно сделать вывод, что отобранные штаммы микроорганизмов обладают очень хорошими показателями ферментативной активности и могут стать претендентами для создания на их основе эффективной закваски для получения биогаза.
Библиографическая ссылка
Нагызбеккызы Э., Молдагулова Э.Б., Сарсенова А.С., Данлыбаева Г.А., Ануарбекова С.С., Молдагулова Н.Б., Курманбаев А.А. ВЫДЕЛЕНИЕ И СКРИНИНГ МИКРООРГАНИЗМОВ, ПЕРСПЕКТИВНЫХ ПРИ СОЗДАНИИ НА ИХ ОСНОВЕ ЗАКВАСОК ДЛЯ ПОЛУЧЕНИЯ БИОГАЗА ИЗ СТОЧНОЙ ВОДЫ // Научное обозрение. Биологические науки. 2022. № 3. С. 27-33;URL: https://science-biology.ru/ru/article/view?id=1280 (дата обращения: 03.03.2026).
DOI: https://doi.org/10.17513/srbs.1280


 science-review.ru
science-review.ru