Острый панкреатит – это наиболее широко распространенное заболевание органов пищеварения, риск подверженности которому по всему миру прогрессивно увеличивается. [1, 2]. Несмотря на то, что недавно были выявлены некоторые основы патогенеза острого панкреатита, специфических средств профилактики и лечения этого заболевания пока не существует [3, 4]. Было описано, что триггером патогенеза острого панкреатита, вызванного перевязкой панкреатического протока, введением церулина или аминокислот, является оксидативный стресс, который вызывает увеличение таких опасных метаболитов, как активные формы кислорода и азота. Параллельно в ткани поджелудочной железы и сыворотке крови возрастают активности антиоксидантных и панкреатических гидролитических ферментов [5, 6]. Метаболиты оксидативного стресса вызывают деполяризацию и модификацию мембран и белков, перекисное окисление липидов, фрагментацию ДНК в клетках органа, приводя к некрозу ацинусов поджелудочной железы [6]. Они также служат в качестве сигналов, вовлекающих нитрогенактивируемые протеинкиназы и другие факторы воспалительного каскада при остром панкреатите [5, 6].
На сегодняшний день диета остается одним из важных моментов как в профилактике, так и в лечении заболевания. Она должна содержать необходимое количество основных нутриентов (белков, жиров и углеводов) при обязательном дробном питании и достаточное количество биологически активных веществ. Среди растительных биологически активных соединений многие флавоноиды привлекают внимание исследователей в качестве веществ, оказывающих корригирующее влияние на воспалительные процессы в поджелудочной железе и других органах пищеварения [7]. На этом основании было предположено, что растительные флавоноиды смогут оказать не только корригирующее, но и профилактическое влияние, т.е. облегчить развитие острого панкреатита и связанного с ним гидролиза углеводов в тонкой кишке. Этот вопрос требует исследования и потому, что большинство флавоноидов, поступая в полость тонкой кишки с пищей, непосредственно контактируют с ферментами в полости тонкой кишки и ферментами, встроенными в апикальную мембрану энтероцитов, а влияние их на мембранный гидролиз нутриентов, в том числе и гидролиз углеводов, практически не исследовано.
Цель работы – изучить профилактическое влияние некоторых флавоноидов на ассимиляцию углеводов при остром панкреатите.
Материалы и методы исследования
В опытах были использованы белые беспородные крысы-самцы массой 180–200 г. Крыс делили на одну контрольную и пять опытных групп, по 6 крыс в каждой. Контрольная и первая опытная группы крыс в течение двух дней с промежутком в 24 ч перорально получали физиологический раствор. У крыс второй опытной группы вызывали экспериментальный острый панкреатит двумя внутрибрюшинными инъекциями L-аргинина (500 мг/100 г) с интервалом в два часа. Крысам третьей, четвертой, пятой и шестой опытных групп за 2 дня до индуцирования острого панкреатита перорально вводили рутин, растворенный в 1 % растворе диметилсульфида, а также растворы дигидрокверцетина, пуликарона и тамифлазида в 0,9 % NaCl в дозе 50 мг/кг /сутки соответственно в те же сроки, таким же образом и в эквивалентном объёме.
Все используемые флавоноиды были получены в лаборатории терпеноидов и кумаринов Института химии растительных соединений Академии наук Республики Узбекистан. Рутин был получен из гречихи обыкновенной (Fagopyrum esculentum Moench), дигидрокверцетин – из черного берёзового гриба (Inonotus obliquus), пуликарон – из блошницы сушеницевидной (Pulicaria gnaphalodes), а тамифлазид – из васили́стника обыкновенного (Thalíctrum mínus).
Все процедуры выполнялись в соответствии с требованиями Женевской конвенции «International Guiding principles for Biomedical Research Involving Animals» (1990).
Кровь, полученную при декапитации крыс, на третий день после индукции острого панкреатита, собирали в парафиновые пробирки. Далее у крыс быстро вскрывали брюшную полость, извлекали поджелудочную железу, разрезали орган на кусочки, гомогенизировали тефлоновым пестиком при 3000 об/мин в течение минуты. Извлеченную тонкую кишку очищали от жировой ткани, промывали физиологическим раствором из расчета 1 мл на 10 см кишечника. Смыв кишечника применяли для определения активности α-амилазы кишечного химуса. Затем тонкую кишку просушивали фильтровальной бумагой и осторожно пластиковым шпателем соскабливали с неё слизистую. Слизистую взвешивали, заливали физиологическим раствором из расчета 9 мл на 1 г ткани и гомогенизировали тем же способом, что и поджелудочную железу.
Полученные пробы крови, смыв кишечника (разбавленный химус) и гомогенаты поджелудочной железы и слизистой оболочки тонкой кишки центрифугировали (5000 об/мин) в течение 15 мин. Супернатант крови переносили в этикированные пробирки и использовали для определения глюкозы, а также активности α-амилазы (КФ – 3.2.1.1). В супернатанте смыва тонкой кишки определяли активность α-амилазы, а в супернатантах поджелудочной железы и слизистой оболочки тонкой кишки была определена активность α-амилазы и мальтазы (КФ – 3.2.1.20) соответственно. Все операции проводили на холоде. Содержание глюкозы и активность α-амилазы определяли при помощи специального биохимического анализатора Rayto RT 1904C Semi Auto Chemistry Analyzer (Китай) с использованием стандартных реактивов. Активность мальтазы определяли глюкозооксидазным методом при помощи специального набора “Human” (Германия) содержание гликогена в печени – антроновым методом [8].
Полученные результаты были обработаны c применением t-критерия Стъюдента. Вычисляли среднюю арифетическую величину (М), среднюю ошибку средней (±m) и показатель достоверности (Р). Различия между опытными и контрольными группами принимали за достоверные при вероятности более 95 % (Р < 0,05).
Результаты исследования и их обсуждение
Оказалось, что экспериментальный панкреатит приводил к повышению уровня α-амилазы в сыворотке крови в 3,7 раз. Пероральное введение флавоноидов вызывало снижение повышенного при панкреатите уровня активности фермента. После введения крысам рутина и затем L-аргинина активность α-амилазы оставалась на уровне контроля. Введение дигидрокверцетина до вызванного панкреатита также не вызывало повышения активности α-амилазы, которое имело место у крыс с панкреатитом без предварительной обработки флавоноидами. Профилактическое влияние пуликарона и тамифлазида на активность α-амилазы было слабо выраженным. Однако активность фермента была ниже величин, зарегистрированных у крыс, не получавших флавоноидов для профилактики вызванного L-аргинином панкреатита (рис. 1, А).
Приблизительно такая же тенденция была отмечена в изменении активности α-амилазы ткани поджелудочной железы. Активность фермента возрастала в 8,1 после индукции острого панкреатита. Однако если до экспериментального панкреатита крысам перорально вводили рутин, дигидрокверцетин, пуликарон и тамифлазид, то увеличение активности фермента было в 5,7; 1,6; 7,0 и 1,8 раза соответственнно. т.е. введение биофлавоноидов предупреждало вызванное панкреатитом возрастание активности α-амилазы в ткани органа, хотя и не полностью (рис. 1, Б).
Несмотря на то, что при остром панкреатите активность α-амилазы в крови и ткани поджелудочной железы увеличивалась, в содержимом тонкой кишки, куда выделяется панкреатический сок, активность фермента была в 4,6 раз ниже по сравнению с контролем. Если до индукции острого панкреатита крысам перорально вводили рутин, дигидрокверцетин, пуликарон и тамифлазид активность фермента в полости тонкой кишки была ниже в 2,5; 1,2; 2,9 и 2,0 раза соответственно, чем в контроле. Профилактическое влияние рутина и дигидрокверцетина на активность α-амилазы содержимого тонкой кишки было наиболее выраженным (рис. 2, А).
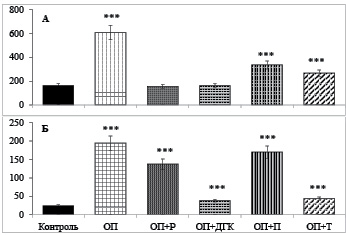
Рис. 1. Активность α-амилазы крови (ед/л) и ткани поджелудочной железы (ед/г ткани) у крыс с L-аргининовым паннкреатитом и крыс, получавших перорально до индукции панкреатита флавоноиды (M ± m, при n = 6). Здесь и далее: ОП – крысы с вызванным острым панкреатитом; ОП+Р; ОП+ДГК; ОП+П; ОП+Т – крысы, которым перед индуцированием острого панкреатита соответственно вводили рутин, дигидрокверцетин, пуликарон и тамифлазид: *– < 0,05; ** – 0,01: *** – < 0,001
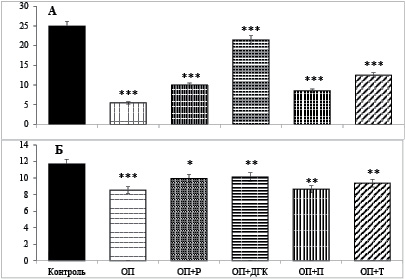
Риc. 2. Активность α-амилазы в содержимом кишечника (ед/л) (А) и мальтазы в слизистой оболочке кишки (µмоль/мин/г ткани) (Б) у крыс с острым панкреатитом и крыс, получавших перорально до индукции панкреатита флавоноиды (M ± m, при n = 6)
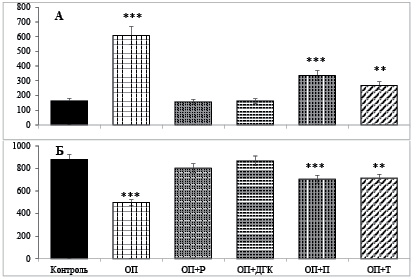
Рис. 3. Содержание глюкозы (ммоль/л) в крови (А) и гликогена в печени (мг/100 г массы) (Б) у крыс с острым панкреатитом и крыс, получавших перорально до индукции панкреатита флавоноиды (M ± m, при n = 6)
Острый панкреатит вызывал также снижение активности энтеральной мальтазы. Активность фермента уменьшалась у крыс с острым панкреатитом на 37,4 %. Если до получения L-аргинина крысам вводили рутин или пуликарон и тамифлазид, то уменьшение активности фермента сокращалось и составляло 19,8; 19,6 и 10,5 % соответственно. Дигидрокверцетин приводил к полному сохранению специфической активности мальтазы в слизистой оболочке тонкой кишки, несмотря на вызванный позже экспериментальный панкреатит (рис. 2, Б).
Ацинарные клетки поджелудочной железы способны к более быстрому синтезу и накоплению белка по сравнению с другими клетками органа [2]. Однако, когда содержание аминокислот, например L-аргинина, превышает допустимые нормы, структура и функция ацинусов поджелудочной железы нарушаются, приводя к выделению из лизосом ферментов и активации панкреатических зимогенов, являющихся причиной аутофагии органа. Такие патологические сдвиги вызывают на начальных стадиях заболевания неинфекционное, а затем и инфекционное воспаление тканей органа [9–11]. Кроме того, выявлено, что L-аргинин индуцирует экспрессию гена белка, ассоциированного с панкреатитом, а также апоптоз в ацинарных клетках поджелудочной железы [10]. Образование свободных радикалов и перекисное окисление липидов, способствующих разрушению мембран клеток и клеточных органелл, также играет существенную роль в патогенезе воспаления, фиброза и апоптоза ткани [5, 6].
Выявленное увеличение активности панкреатической α-амилазы в гемоциркуляции и ткани поджелудочной железы и уровня глюкозы в сыворотке крови имеет место одновременно с возрастанием активности и других, в частности протеолитических ферментов в поджелудочной железе и сыворотке крови, которые являются индикаторами аутофагии с сопутствующей деструкцией ацинусов поджелудочной железы [6]. Возрастание активности панкреатических ферментов в сыворотке крови обычно имеет место на фоне повышенной активности панкреатической миелопероксидазы, повышенного содержания фактора некроза опухоли-α, интерлейкина-6, а также снижения уровня интерлейкина-10 в сыворотке [10, 11]. Выявленное у крыс с L-аргининовым панкреатитом уменьшение активности α-амилазы в содержимом кишечника, скорее всего, обусловлено уменьшением секреции сока поджелудочной железы в двенадцатиперстную кишку и связано с непроходимостью микро- и макропротоков органа из-за гистофункциональных сдвигов в ацинусах, препятствующих оттоку панкреатического сока в полость тонкой кишки. В результате имеет место снижение интенсивности начальных стадий гидролиза углеводов, в частности крахмала, в полости тонкой кишки, в котором определяющую роль играет α-амилаза поджелудочной железы. В снижении способности ассимилировать углеводы в тонкой кишке при остром панкреатите вносит лепту и отмеченное в экспериментах уменьшение активности мальтазы слизистой оболочки тонкой кишки. Уменьшение полостного (активность α-амилазы химуса) и мембранного (активность мальтазы слизистой кишки) гидролиза улеводов в тонкой кишке при остром панкреатите, естественно, сокращает поступление глюкозы из полости кишечника в гемоциркуляцию. В этом случае существенной причиной гипергликемии, как показывают результаты, является распад полисахаридов тканей, в первую очередь гликогена печени, содержание которого в органе уменьшилось при остром L-аргининовом панкреатите в 1,8 раз (рис. 3, Б).
Используемые в настоящем исследовании флавоноиды: рутин, дигидрокверцетин, пуликарон и тамифлазид в той или иной степени оказывали профилактическое влияние на биохимические показатели крови, поджелудочной железы и слизистой оболочки тонкой кишки, отражающие степень выраженности острого панкреатита. Профилактическое влияние биофлавоноидов проявлялось, прежде всего, в уменьшении активности панкреатической α-амилазы в ткани поджелудочной железы и крови, а также в уменьшении содержания глюкозы в крови – маркеров панкреатита и предикторов тяжести заболевания [11, 12].
Большинство флавоноидов обладают выраженными антиоксидантными свойствами, с чем в значительной степени и связаны их потенциальные мембранотропные эффекты, в том числе и для мембран ацинарных клеток и их органоидов [7, 13]. Скорее всего, профилактирующее влияние флавоноидов определяется взаимодействием препаратов с клеточными мембранами, в конечном итоге способствующим сохранению фазового состояния липидов мембраны, а также структурной и функциональной организации ацинарных клеток поджелудочной железы при остром панкреатите. Заметное выраженное профилактическое влияние рутина и дигидрокверцетина предполагает использование их в качестве препаратов для предупреждения и коррекции острого панкреатита.
Библиографическая ссылка
Кучкарова Л.С., Каюмов Х.Ю., Эргашев Н.А., Эшбакова К.А. ПРОФИЛАКТИЧЕСКОЕ ВОЗДЕЙСТВИЕ НЕКОТОРЫХ ФЛАВОНОИДОВ НА АССИМИЛЯЦИЮ УГЛЕВОДОВ У КРЫС // Научное обозрение. Биологические науки. 2022. № 3. С. 51-56;URL: https://science-biology.ru/ru/article/view?id=1284 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1284


 science-review.ru
science-review.ru