Проблема стресса у человека встает особенно остро в связи с ухудшением экологической обстановки, утратой стабильности и усилением напряженности в обществе как результат локальных войн, терроризма, вынужденной миграции, эпидемий. Кроме того, значительная часть населения находится в напряжении и в обычной жизни из-за высоких социальных, психоэмоциональных нагрузок, интоксикаций, болезней и пр.
Для определения состояния стресса у людей ионные показатели не применяются. Чаще всего используется уровень кортизола в крови, но также концентрация общего белка в сыворотке крови, астроцит-специфического белка S100b, глюкозы, активность аминотрансаминаз и концентрация конечных продуктов метаболизма [1, 2]. У рыб диагностика состояния стресса по показателям водно-солевого равновесия крайне редка: если и встречается в работах уровень натриемии, то он выбирается в комплексе с другими параметрами, без учета его самостоятельной значимости для организма [3, 4]. Наиболее интенсивные исследования влияния стрессоров на ионные параметры у рыб проводились в 1970–1980-е гг. Информация была неоднородной, порой противоречивой и недостаточной: основная часть сведений по указанному вопросу основана на результатах изучения ответных реакций рыб на сильные и непродолжительные стрессоры. Не было создано обобщающего произведения, охватывающего широкий диапазон стрессовых состояний рыб, а предлагаемые в некоторых работах ионные критерии неблагополучия организма при стрессе не получили распространения и со временем исчезли из употребления. К тому же в них практически отсутствовал анализ уровня натриемии. Несмотря на активное изучение физиолого-биохимических процессов у рыб при стрессе в настоящее время [5–7], ионные показатели сыворотки (плазмы) крови рыб не используются для идентификации стресса. Нет информации по этому вопросу и для других, в том числе высших, позвоночных животных.
Длительный период времени в медицине за норму принимали широкий диапазон изменения концентрации натрия во внутренней среде организма человека: 130–150 ммоль/л. Фактически нормой называли не пределы границ физиологических колебаний этого показателя у здоровых лиц, а указывали границы величин при состояниях, совместимых с жизнью. Ситуация стала меняться сравнительно недавно: к норме теперь относят более узкий диапазон натриемии: 135–145 ммоль/л. При этом гипонатриемия (<135 ммоль/л) у людей встречается чаще, чем гипернатриемия (>145 ммоль/л). Диапазоны колебаний калиемии, кальциемии и магниемии у человека, судя по различным литературным источникам, в среднем составляли соответственно 3–5, 2–3 и 0,5–1 ммоль/л. У рыб значения указанных показателей представлены в результатах настоящего исследования.
В настоящей работе изучали изменения концентрации катионов натрия, калия, кальция и магния во внутренней среде у пресноводных рыб при различных стрессовых состояниях, обращая основное внимание на уровень натриемии. Кроме того, основываясь на литературных данных, анализировали закономерности изменения ионного состава внутренней среды при действии неблагоприятных факторов у млекопитающих, отмечая их сходство с таковыми у рыб.
Материалы и методы исследования
Основным объектом исследования служил половозрелый и близкий к половозрелости лещ (Аbramis brama L.) Рыбинского водохранилища. Отдельные опыты выполняли на взрослых особях щуки (Esox lucius L.), плотвы (Rutilus rutilus L.) и синца (Abramis ballerus L.) из того же водоема. Эксперименты проводили в летний период года при температуре воды 17–20 °C при остром, подостром и хроническом стрессе с летальным исходом, а также остром обратимом стрессе разной силы и длительности. Слабый стресс рассматривали как эустресс (физиологический стресс), различные типы сильного стресса – как дистресс (патологический стресс). За норму принимали состояние рыб сразу после кратковременной (не более 15 мин) поимки из естественной среды. Слабый стресс создавали помещением акклимированных рыб в ограниченный объем воды (соотношение массы тела и воды 1:20) с непрерывной аэрацией (рис. 1). Сильный обратимый острый стресс получали при кратковременной поимке рыб из естественной среды с последующей транспортировкой в лабораторию в течение 1,5–2 ч в ограниченном объеме воды (рис. 2, А; 3, А; 4, А (2–4); 5, А), резким изменением температуры на 18 °C (рис. 4, А (1)). Острый летальный стресс продолжительностью от 5 до 12 ч создавали комплексным действием нескольких сильных факторов: отлов, транспортировка в ограниченном объеме воды со снижающимся содержанием кислорода (до 2,5 мг/л) и повышающейся температурой (до 25 °C) (рис. 2, Б; 3, Б; 4, Б (2–4); 5, Б), применением всех этих факторов на акклимированных рыбах (рис. 4, Б (1)). Подострый стресс с летальным исходом продолжительностью 5–18 сут вызывали достаточно сильными стрессорами, к которым рыба не могла приспособиться: посттравматическими эффектами длительного траления и жесткой транспортировки (рис. 2, В; 3, В; 4, В (2–3)), содержанием рыб в садках (рис. 4, В (1)). Хронический летальный стресс продолжительностью 1–3 мес. создавали содержанием рыб в лабораторных условиях с повышенным фоном световых и шумовых раздражителей (рис. 2, Г; 3, Г; 4, Г (2–3); 5, В) и в неблагоприятных условиях прудов экспериментальной базы: высокая плотность посадки рыб в мелких прудах (рис. 4, Г (1)). Каждая экспериментальная точка представлена для леща 11–24 особями, для других видов рыб – 5–9 особями.
Концентрацию катионов натрия и калия в плазме крови анализировали на пламенном фотометре Flapho-4, а кальция и магния – на фотометре AAS-1, фирмы Carl Zeiss (Jena, Германия). В работе представлены средние значения концентрации ионов и стандартная ошибка средней x±SE. Проверку на нормальность распределения в выборках проводили с использованием критерия Шапиро –Уилка. Установлено, что все выборки имеют нормальное распределение. Достоверность различий оценивали по t-критерию.
Результаты исследования и их обсуждение
При слабом стрессе (т.е. в ответ на действие стрессоров, которые относятся к несильным и непродолжительным) у пресноводных рыб наблюдали гипернатриемию в пределах 10 % по сравнению с нормой (рис. 1, А). Самые большие изменения в составе внутренней среды, но направленные в противоположную сторону, наблюдали при очень сильном остром летальном стрессе: потери натрия могли составлять 50 % (рис. 2, Б; 4, Б). При хроническом стрессе с летальным исходом уровень гипонатриемии в среднем составлял 10 %, иногда чуть выше (рис. 2, Г; 4, Г). При подостром стрессе с летальным исходом гипонатриемия достигает 20 % (рис. 2, В; 4, В). При остром обратимом стрессе гипонатриемия могла колебаться в зависимости от силы стрессора от 1 до 30 % (рис. 2, А; 4, А).
Во время слабого стресса (т.е. при несильных непродолжительных нагрузках) наблюдали гипокалиемию (70–90 %) (рис. 1, А), а гиперкалиемию во всех остальных случаях при остром стрессе. Так, при действии сильных стрессоров, в особенности при летальном стрессе, изменения достигали, соответственно, 100–400 % (рис. 3, А, Б; 4, А, Б). Однако перед гибелью рыб при хроническом и подостром стрессе уровень калиемии близок к норме (рис. 3, В, Г; 4, В, Г).
При слабом стрессе (т.е. при действии несильных, непродолжительных стрессоров) уровень кальциемии увеличивается до 15–30 % и более (рис. 1, Б). При сильных нагрузках, напротив, наблюдали снижение до 30 % и более, при этом – особенно сильное при летальном стрессе (рис. 5, А, Б). Уровень магниемии в отличие от кальция при непродолжительных и слабых воздействиях, напротив, уменьшается примерно на 10 % (рис. 1, Б), а при достаточно сильном остром обратимом стрессе – наблюдали повышение до 20 % и более (рис. 5, А). При хроническом стрессе практически нет изменений в концентрации двухвалентных ионов в плазме крови (рис. 5, В).
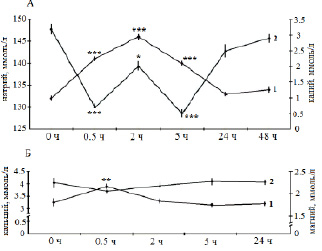
Рис. 1. Динамика концентрации натрия (1А), калия (2А), кальция (1Б) и магния (2Б) в плазме крови леща при эустрессе (физиологическом стрессе), ммоль/л; * p ≤ 0,05,** p ≤ 0,01; *** p ≤ 0,001 − по сравнению с нормой
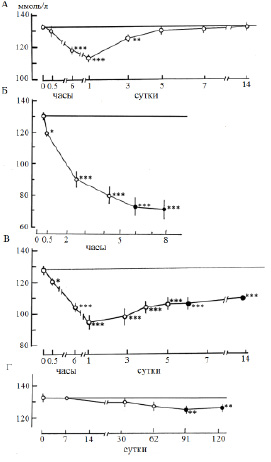
Рис. 2. Динамика концентрации натрия в плазме крови леща при дистрессе (патологическом стрессе), ммоль/л: А − острый обратимый стресс (продолжительность 1,5−2 ч); Б − острый летальный стресс; В – подострый летальный стресс; Г – хронический летальный стресс. По оси абсцисс (Б – Г) − время действия стрессора; темные кружочки – предгибельное состояние. * p ≤ 0,05, ** p ≤ 0,01, *** p ≤ 0,001 − по сравнению с нормой
Выявлены общие механизмы адаптации в системе водно-солевого равновесия пресноводных рыб, связанные с количеством (силой и продолжительностью) стрессора. Стрессоры также различались по качеству. Однако характер их действия, как показано в данной работе, зависел от интенсивности воздействия: при несильном непродолжительном – наблюдали изменения в сторону повышения концентрационных градиентов на мембране клеток (гипернатриемия, гиперкальциемия, гипокалиемия, гипомагниемия – эустресс), при сильном – в сторону снижения (гипонатриемия, гипокальциемия, гиперкалиемия, гипермагниемия – дистресс). Причем гипонатриемия наблюдалась во всех неблагоприятных условиях, т.е. также и при хроническом и подостром стрессе (тоже дистресс). Однако перед гибелью рыб при подостром и хроническом стрессе близки к норме уровни калиемии, кальциемии и магниемии.
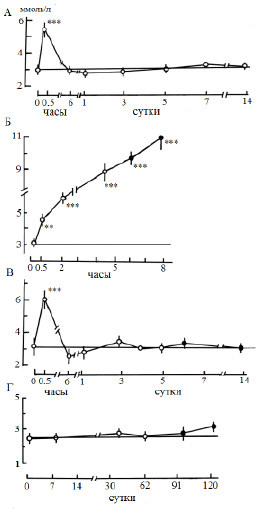
Рис. 3. Динамика концентрации калия в плазме крови леща при дистрессе (патологическом стрессе), ммоль/л. Остальные обозначения как на рис. 2. ** p ≤ 0,01,*** p ≤ 0,001 − по сравнению с нормой
Таким образом, гипонатриемию можно считать самым выраженным и надежным ионным показателем неблагополучия организма. Многие другие биохимические показатели также заметно меняются при острострессорных нагрузках, слабо или совсем не отвечая на подострый и хронический стресс (например, глюкоза, катехоламины и др.).
Ранее нами показано [8], что при нересте изменения ионного состава плазмы крови сходны с теми, что наблюдали при слабом стрессе, т.е. при действии слабых непродолжительных стрессоров, а после нереста – с изменениями при длительных стрессорных воздействиях
Функции ионов в организме многообразны. Укажем лишь на те из них, которые связаны с клеточной мембраной.
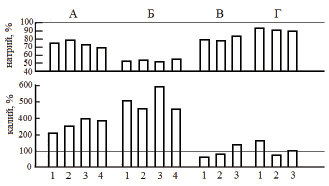
Рис. 4. Концентрация натрия и калия в плазме крови некоторых рыб при дистрессе (патологическом стрессе), ммоль/л: А − острый обратимый стресс продолжительностью 1,5−2 ч; Б − острый летальный стресс; В – подострый летальный стресс; Г – хронический летальный стресс (Б – Г − значения показателя перед гибелью рыб). 1, 2, 3, 4 – лещ, плотва, щука и синец соответственно
В медицине в первую очередь подчеркивается важная (главная) роль концентрации натрия в сыворотке (плазме) крови в поддержании осмоляльности жидкостей внутренней среды, околоклеточной среды и в конечном итоге в волюморегуляции каждой клетки. В настоящей работе впервые проведен анализ состояния системы водно-солевого равновесия животных при стрессе с позиции ведущей роли ионных концентрационных градиентов или мембранного потенциала в энергетике организма. Широко известна роль натрий-зависимых систем котранспорта в обеспечении потребности клетки различными веществами. В связи с близостью концентрации ионов в мышечной ткани у различных видов рыб [9] можно говорить о значительной зависимости концентрационного (и электрохимического) градиента по натрию на мембране скелетной мышцы от уровня натриемии. Для других клеток (тканей) уровень натриемии также может играть такую же значительную роль. Применительно к концентрационным градиентам на мембране клеток существует понятие вторичного активного транспорта. Работа натриевого насоса обеспечивает большинство транспортных функций клеток (от эпителиальных, хрящевых, мозговых и других), которые реализуются не за счет потребления непосредственно энергии АТФ, а за счет энергии ионных градиентов или мембранного потенциала. Явления возбуждения и торможения, а также основные поляризационные процессы на мембране клеток главным образом считаются зависимыми от ионов калия. Двухвалентные катионы кальция и магния также участвуют в балансе электролитов, транспорте ионов, проницаемости мембран, нервно-мышечной возбудимости.
Сказанное позволяет предположить, что поддержание постоянства ионного состава внутренней среды организма (главным образом натрия) есть в значительной степени поддержание энергетики организма, т.е. один из важнейших и, может быть, первоочередных механизмов сохранения жизни в напряженных (стрессовых) условиях. Таким образом, можно говорить об ионных концентрационных градиентах на мембране клеток как о резервуарах свободной энергии для различных физиологических процессов и как о механизме поддержания устойчивой неравновесности организма рыб.
Для функциональной системы в организме рыб при слабом стрессе, т.е. при несильных непродолжительных нагрузках и перед нерестом, характерны повышенные ионные концентрационные градиенты на мембране клеток и тканей. Функциональным системам во всех остальных стрессовых ситуациях свойственны сниженные концентрационные градиенты. При остром стрессе с летальным исходом, когда наблюдается максимальный ионный дисбаланс и минимальная продолжительность жизни, формируется самая неэффективная функциональная система. Функциональная система при хроническом стрессе обладает большими адаптивными возможностями в связи с минимальным ионным дисбалансом и большой продолжительностью жизни рыб. При подостром стрессе по величине ионного дисбаланса и продолжительности жизни рыб функциональную систему можно отнести к промежуточной между вышеуказанными. При сильном остром обратимом стрессе наблюдали значительно выраженные уровни гипонатриемии, гипокальциемии, гиперкалиемии и гипермагниемии.
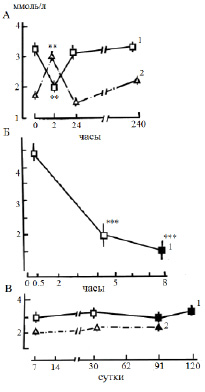
Рис. 5. Динамика концентрации кальция (1) и магния (2) в плазме крови леща при дистрессе (патологическом стрессе), ммоль/л: А − острый обратимый стресс (продолжительность 1,5−2 ч); Б − острый летальный стресс; В – хронический летальный стресс. По оси абсцисс: Б – В − время действия стрессора; темные кружочки – предгибельное состояние. * p ≤ 0,05, ** p ≤ 0,01 – по сравнению с нормой
Таким образом, в нормальных и экстремальных условиях пресноводные рыбы используют две разные стратегии адаптации или две разные защитные реакции: активную и пассивную, состоящие соответственно в повышении уровня неравновесности (энергетики) и снижении уровня неравновесности (или, следовательно, энергии или повышении конформности) организма. Первую стратегию адаптации можно отнести к гиперполяризационному торможению, а вторую – к деполяризационному. Прогрессивное развитие организма и наиболее полная реализация его функций обеспечивается первой стратегией адаптации. Избыточные анаболические процессы и повышение устойчивости к воздействию неблагоприятных факторов, вероятно, и обеспечиваются энергией увеличенных ионных концентрационных градиентов на мембране клеток и тканей. Сохранение жизни в экстремальных условиях гарантирует вторая стратегия адаптации. При хроническом стрессе наблюдается минимизация энерготрат: за счет снижения концентрационных градиентов и ослабления ионотранспортных потоков. Мы полагаем, что эти процессы играют значительную роль в метаболической депрессии. Только перед гибелью рыб можно наблюдать большие потери калия и аммония. Быстрое и значительное уменьшение ионных градиентов по натрию (когда потери калия и аммония еще невелики), т.е. использование больших количеств энергии, при сильном остром стрессе обеспечивают выживание рыб. При подостром стрессе наблюдали сильные катаболические процессы, так как в условиях заметно заниженных концентрационных градиентов по натрию происходили большие потери калия и аммония. Таким образом, повышение конформности организма, как эволюционно более древняя приспособительная реакция, может включаться лишь в чрезвычайных обстоятельствах. В нормальных условиях реализуются эволюционно более молодые механизмы адаптации, которые обеспечивают необходимый уровень энергетики (неравновесности) организма.
Концентрация ионов в других тканях также меняется по-разному, если используются стрессоры разной силы и длительности. Например, при действии слабых и непродолжительных воздействий концентрация калия и натрия в мышцах, основном ионном депо, увеличивается, а при влиянии сильных – уменьшается [10]. Изменение концентрации ионов в эритроцитах главным образом связано с их дыхательной функцией. Эритроцитарный магний в условиях слабого стресса может рассматриваться как один из молекулярных механизмов, обеспечивающих уменьшение поглощения организмом кислорода и, следовательно, усиления анаболизма и увеличения роста и развития животных [11]. Предложенная в данной работе концепция о двух стратегиях адаптации у рыб в нормальных и экстремальных условиях согласуется с положениями теории эустресса и дистресса Селье, или стресса физиологического и патологического Аршавского [12].
На основании проведенных результатов исследования и предложенной концепции двух защитных реакций в нормальных и экстремальных условиях предлагаются основные принципы диагностики рыб в природной и искусственной среде обитания по ионным показателям. Снижение ионных концентрационных градиентов на мембране клеток и тканей необходимо рассматривать как показатель той или иной степени неблагополучия (патологии), увеличение концентрационных градиентов – как предвестник возможной патологии в условиях продолжающегося ухудшения условий жизни (например, стресса). Нарушение самого тонкого уровня биологической организации – колебательного режима служит первым признаком начинающейся патологии в организме. Переход через фазу гиперкомпенсации (стимуляции) к фазе редукции (депрессии) – общая закономерность в ответной реакции биологических систем разного уровня организации на возрастающий стимул или непрекращающееся его действие в прежней интенсивности. Состояние ареактивности занимает промежуточное положение между фазами гиперкомпенсации и редукции. При этом, как уже указывалось, уровень натриемии является самым надежным показателем состояния организма из четырех основных катионов. К числу наиболее характерных признаков активной защитной реакции (физиологического стресса, или эустресса) относится гипернатриемия, а к пассивной (патологическому стрессу, или дистрессу) – гипонатриемия. При оценке уровня натриемии необходимо учитывать не только амплитуду, но и временной фактор. Важно определять степень устойчивости во времени гипонатриемии при диагностике собственно (настоящей) патологии, для того, чтобы исключить кратковременную (обратимую) гипонатриемию при остром стрессе. Достоинство этого показателя заключается еще в низкой вариабельности и некоторой латентности (задержке изменений) в организме. Другие три иона менее, чем ионы натрия, подходят для целей диагностики организма. При подостром и хроническом стрессе их значения близки к норме. Уровни калиемии, кальциемии и магниемии неплохо могут служить в качестве дополнительных критериев для определения острострессорного состояния животных.
Анализ литературной информации о состоянии системы водно-солевого равновесия у млекопитающих (главным образом человека) в стрессовых условиях и при болезнях, а также количества нагрузки, испытываемой объектом исследования, позволяет сделать заключение о сходстве механизмов адаптации при стрессе у рыб и высших позвоночных: при действии несильных непродолжительных нагрузок отклонения в системе водно-солевого равновесия направлены в сторону повышения концентрационных градиентов на мембране клеток, при сильных или длительных − снижения. Наиболее показательна в этом плане работа индийских исследователей, проведенная на крысах в условиях высотной гипоксии. Авторами установлено, что подъем животных на 2–5 тысяч метров над уровнем моря приводил к гипернатриемии, затем на высоте 7,5 тысяч метров наблюдали отсутствие реакции на воздействие, при дальнейшем подъеме до 10,5 тысяч метров – гипонатриемию и гибель животных [13]. В качестве основной причины, вызывающей изменения в содержании ионов в тканях, авторы называют острую гипоксию. В этом и другом аналогичных более ранних исследованиях не делается попыток установления общих механизмов адаптации. Авторы указанной работы [13] представили также литературную информацию о результатах изучений влияния высотной гипоксии на содержание ионов натрия и калия в тканях крыс, собак и людей-добровольцев, проведенных советскими и зарубежными учеными в 1930–1960-е гг. Анализ этих литературных сведений позволяет заключить, что они подтверждают нашу концепцию двух стратегий адаптации у животных в нормальных и экстремальных условиях: т.е. в зависимости от силы стрессоров (величины гипоксии или высоты над уровнем моря, а также времени экспозиции) характер ответной реакции мог протекать по типу гиперкомпенсации или редукции, возможно также отсутствие изменений (состояние ареактивности), в том числе уже и по причине восстановления функций при многочасовых наблюдениях.
Наиболее многочисленны исследования ионорегуляции на людях в экстремальных ситуациях − работы отечественных и американских авторов на космонавтах (астронавтах) во время полетов. При этом исследователи в качестве главного (нарушающего) фактора рассматривают невесомость и не делают заключений об общих механизмах адаптации [14, 15]. В общих чертах, установленные авторами закономерности изменений в системе водно-солевого равновесия при полетах в космос у людей соответствуют выявленной нами зависимости характера и величины ответной реакции у рыб от количества (силы) стрессора и исходного функционального состояния организма. Наиболее часто после продолжительных полетов у космонавтов наблюдали гипокалиемию и гиперкальциемию. В ряде случаев обнаруживались также гипернатриемия и повышение осмолярности крови. То есть все это «симптомы» физиологического стресса. Обычно гипернатриемия и гиперкальциемия отмечались только в течение самых первых дней пребывания на Земле. Однако гипокалиемия через неделю усиливалась и достигала 50 %. Для нас очевидно, что в условиях гиперполяризационного торможения происходят мощные восстановительные (анаболические) процессы у похудевших в результате полета космонавтов (в частности, констатировано уменьшение в объеме бедер). Однако сразу после взлета (при переходе к невесомости) наблюдалась гипонатриемия (т.е. сдвиги по типу патологического стресса). Небольшая гипонатриемия (1,5 %) отмечена после приземления при кратковременных полетах. Можно предположить, что снижение концентрации натрия в плазме крови могло быть более выраженным, если бы накануне приземления космонавты не получали пищу, обогащенную хлоридом натрия. Кроме того, при полетах и в результате полетов возрастала индивидуальная вариабельность исследуемых показателей. Например, после приземления коэффициент вариации концентрации натрия в плазме крови возрастал в 2 раза. Индивидуальные различия в реакциях на экстремальные условия полетов были столь высоки, что в ряде случаев у членов одного экипажа изменялась не только величина, но и направленность ответной реакции. То есть у одних индивидуумов сдвиги в системе водно-солевого равновесия протекали в большей степени по типу физиологического стресса, а у других – просматривалась явная тенденция в изменении ряда показателей в сторону патологизации. По сообщениям средств массовой информации примерно двадцатилетней давности у одного из космонавтов во время полета случился инфаркт миокарда. Это заболевание Селье относил к идиопатическим или плюрокаузальным, т.е. вызываемым неспецифическими (стрессовыми) раздражителями. К ним он относил также рак, артроз, остеохондроз, инсульт и др. Иначе такие заболевания называются болезнями адаптации. То есть в условиях очень сильных нагрузок (космических полетов) оказалось возможным разделять людей на основании величины и направленности ионных изменений по степени стрессоустойчивости (состояния здоровья). У космонавтов во время полетов и после приземления отмечен высокий уровень альдостерона в крови и большие потери калия из организма, т.е. характерные признаки стресса. В этом видна общая реакция на сильный стрессор, связанная с интенсивным катаболизмом мышечных белков. В результате длительных полетов наблюдали также вымывание кальция из костей, потери магния, фосфора и ряда других ионов, т.е. такой же отрицательный баланс ионов, который имеет место при действии сильных стрессоров и болезнях, на что ранее указывал еще Селье.
В последние годы обнаружена связь гипонатриемии с целым рядом болезней: сердечной недостаточностью [16, 17], циррозом печени [18, 19], почечной недостаточностью [20, 21], раком [22, 23], алкоголизмом [24], а также возрастом [25]. Гипонатриемия отмечена у пациентов в послеоперационный период [26]. Таким образом, в основном гипонатриемия наблюдалась при болезнях адаптации. О связи гипонатриемии с болезнями адаптации, особенно с сердечной недостаточностью, циррозом печени и онкогенезом, существует много работ (в несколько раз больше, чем представлено здесь), но в настоящей статье в силу ограниченности ее объема не могут быть приведены многие ссылки. Установлена более высокая смертность и длительность пребывания в стационаре у пациентов с гипонатриемией, чем с нормонатриемией. В работе А.В. Кутиной с соавт. [27], содержащей ссылки более чем на 450 литературных источников, по собственным и литературным данным авторами предлагается значение нормальных уровней натриемии, калиемии, кальциемии и магниемии. Так, у здорового человека значения указанных ионов составляли соответственно 141±2,3; 4,1±0,3; 2,39±0,13; 0,86±0,07 ммоль/л. Хотя сами авторы не связывают изменение уровней ионов во внутренней среде со стрессом, однако из работы очевидно, что часто встречающаяся гипонатриемия у человека вызвана тем или иным стрессором либо болезнью. Например, авторы указывают, что гипонатриемия чаще развивается у детей, длительно находящихся на стационарном лечении, независимо от вида патологии и возраста, она может служить индикатором развития сепсиса, а также встречается у людей с тяжелой формой малярии. Редко регистрируемая авторами гипернатриемия обусловлена действием непродолжительного стрессора на здоровых тренированных людей.
Хотя в литературе встречается предложение об излечивании от гипонатриемии при различных болезнях, главным образом сердечно-сосудистой недостаточности и цирроза печени, с помощью применения блокаторов рецепторов в почках гормона вазопрессина (антидиуретического гомона) [28, 29]. Однако, как следует из настоящей работы, лечение от стресса и особенно ликвидация его причин (если это возможно) могут оказаться наиболее эффективными способами излечивания от гипонатриемии. Кроме того, сама болезнь может выступать в качестве эндогенного стрессора. На рыбах показано, что в начальный период болезни изменения концентрации ионов в тканях рыб направлены в сторону повышения концентрационных градиентов на мембране клеток (гиперкомпенсация), а на поздних стадиях заболевания − в сторону снижения (редукция), это относится как к заразным, так и незаразным болезням [10].
Изменения концентрации ионов в больных тканях (органах) при болезнях адаптации также происходят по типу редукции, т.е. в сторону уменьшения концентрационных градиентов на мембране клеток и тканей. Еще Селье наблюдал уменьшение концентрации калия и повышение натрия в сердечной мышце при инфаркте миокарда. В дальнейшем подобную динамику ионного состава сердечной мышцы, а также изменения по типу редукции внутренней среды при инфарктах наблюдали многие исследователи в мире. Авторами выявлена прямая зависимость между степенью поражения сердечной мышцы и снижением концентрационных градиентов по натрию и калию на мембране клеток. С улучшением клинического состояния больных наблюдалась нормализация ионного состава тканей. При онкогенезе ионный состав больных клеток также изменяется по типу редукции.
Однако при инсультах (ишемии мозга и кровоизлияния в мозг), также относящихся к болезням адаптации, регистрировали как гипонатриемию, так и (в более ранних работах) гипернатриемию [30–32]. Вероятно, в данном случае нужно говорить о специфических изменениях в системе водно-солевого обмена. Можно предположить, что при ишемии и кровоизлияниях в мозг нарушаются некоторые нервные структуры, связанные с гормональной регуляцией водно-солевого обмена (гипоталамус, гипофиз), например, недостаточно выделяется вазопрессин (антидиуретический гормон), и таким образом ослаблено действие гормона на соответствующие рецепторы почек. При депрессии также возможна гипернатриемия [33]. Вероятно, при этой болезни недостаток влияния антидиуретического гормона на почечные структуры связан с избыточным влиянием его на соответствующие мозговые структуры.
Возникает вопрос, почему на высших позвоночных не была замечена зависимость характера ответной реакции системы водно-солевого равновесия от количества (силы и длительности) стрессора? Основных причин здесь, вероятно, две. Во-первых, в медицине и во всех областях биологии на высших позвоночных, т.е. прямо или косвенно связанных с медициной, по-прежнему в исследованиях приоритет остается за изучением специфического компонента ответной реакции (т.е. качества в ущерб количеству) и значительно меньше внимания уделяется изучению общих механизмов адаптации. В первую очередь указываются специфические причины недуга, обусловленные, например, избытком или недостатком действия гормонов, регулирующих водно-солевой баланс организма, а также нарушениями в потреблении воды и соли, как произвольными, так и непроизвольными. Вторая причина – это высокий уровень гомеостатирования у млекопитающих, что проявляется как в меньшем диапазоне отклонений содержания ионов от нормальных значений, так и в редко применяемой стратегии по типу редукции. Повышение гомеостатирования следует рассматривать как один из важнейших признаков прогрессивной эволюции системы водно-солевого равновесия. Другими словами, у водных низших позвоночных легче выявить зависимость изменений в системе водно-солевого равновесия от количества стрессора. Отклонения по типу редукции у рыб более обычны и часты, чем у высших позвоночных. Обратимая гипонатриемия при действии сильных стрессоров, как показано в данной работе, может составлять 30 %. Такой же величины и большой длительности возможна обратимая гипонатриемия у рыб при гипобиозе в низких температурах воды. У млекопитающих даже при достаточно длительном действии сильного стрессора организм предпочитает поддерживать натриевый гомеостаз (поглощая и/или удерживая большие количества натрия) при больших потерях калия. Рассматриваемые выше ситуации при чрезмерных нагрузках в условия космических полетов представляют примеры небольшого отклонения натрия во внутренней среде от нормы по типу редукции. Лишь специфические изменения системы водно-солевого равновесия при различных болезнях (например, синдром неадекватной секреции антидиуретического гормона, дефицит адренокортикотропного гормона и другие) представляют более высокие отклонения концентрации натрия во внутренней среде (обычно до 15–16 %) [27]. Гипонатриемия у высших позвоночных в острых летальных случаях меньше, чем у рыб [13].
В связи со сказанным вызывает удивление широкий диапазон колебания нормальных значений концентрации натрия в плазме крови у человека (130–150 ммоль/л), указываемый в различных справочниках на протяжении нескольких десятилетий. Вероятно, предлагаемый в настоящее время нормальный диапазон натриемии у человека также достаточно широк: 135 – 145 ммоль/л. Это тем более странно, что даже у рыб, относящихся к низшим позвоночным, нами обнаружен узкий диапазон нормальных значений натриемии: у леща, например, 130−133 ммоль/л в нормальных лабораторных условиях и в экологически чистых районах Рыбинского водохранилища. Даже небольшое ухудшение условий содержания рыб в лаборатории вызывало небольшую (2−4 %) гипонатриемию, а у леща в экологически неблагополучных районах могла наблюдаться как невысокая гипо- и гипернатриемия, так и нормонатриемия (состояние ареактивности) в зависимости от времени и интенсивности действия стрессора [10]. При значительном ухудшении экологической обстановки после большой промышленной катастрофы концентрация натрия в плазме крови леща могла снижаться до 80 ммоль/л [4]. Однако стоит признать, что и в исследованиях на людях уже появляются работы, где указывается более узкий диапазон нормальных значений натриемии. Так, концентрация натрия в плазме крови в 136 и 138 ммоль/л рассматривается как маркер смертности и риска сердечно-сосудистых заболеваний у пожилых мужчин [25].
Еще со времен Селье была непонятна роль задержки натрия и воды в организме при стрессе, вызываемая увеличением в крови альдостерона и сопровождающаяся усилением воспалительных процессов в тканях и подъемом давления в крови. Как стало известно сравнительно недавно на человеке, альдостерон связан с повышенным риском смертности от сердечно-сосудистых заболеваний [34]. Адаптивное значение этих явлений может быть объяснено с позиции энергетической роли натриевого потенциала. Среди гормонов у рыб аналогичную альдостерону функцию по сохранению натрия в организме при стрессе выполняют действующие на жаберный эпителий пролактин и кортизол.
Результаты собственных исследований на рыбах и анализ литературного материала по состоянию системы водно-солевого равновесия у млекопитающих при стрессе и болезнях позволяет заключить, что поддержание постоянства ионного состава внутренней среды (главным образом натрия) есть в значительной степени поддержание энергетики организма, т.е. один из важнейших и, может быть, первоочередных механизмов сохранения жизни в напряженных (стрессовых) условиях. Не отрицая существование специфических причин гипонатриемии, мы рассматриваем ее в большинстве случаев как системную реакцию, ибо она указывает на снижение энергетики организма. Особенно это очевидно при болезнях адаптации. Уровень натрия в плазме (сыворотке) крови может быть надежным показателем состояния организма.
Заключение
Интенсивность действия стрессора любого качества определяет характер ионной регуляции в организме. При слабом стрессе (т.е. при действии несильных и непродолжительных стрессоров) происходит отклонение уровня натриемии в сторону повышения ионных концентрационных градиентов на клеточной мембране (гипернатриемия – эустресс, или физиологический стресс); при действии сильных и/или продолжительных стрессоров − происходит отклонение уровня натриемии в сторону понижения ионных концентрационных градиентов (гипонатриемия – дистресс, или патологический стресс). Концентрация ионов калия, кальция и магния во внутренней среде изменяется при остром стрессе по отношению к концентрационным градиентам на клеточной мембране также в зависимости от интенсивности воздействия, т.е., соответственно, гиперкалиемия, гипермагниемия и гипокальциемия при дистрессе и гипокалиемия, гипомагниемия и гиперкальциемия – при эустрессе. Судя по литературным данным, у высших позвоночных животных одинаковые с рыбами изменения ионного состава внутренней среды при стрессе. В настоящей работе впервые проведен анализ состояния системы водно-солевого равновесия животных при стрессе с позиции ведущей роли ионных концентрационных градиентов на мембране клеток в энергетике организма. Высказывается мнение о существовании у животных двух разных стратегий адаптации в нормальных и экстремальных условиях: активной и пассивной. Предполагается, что гипонатриемия, сопровождающая многие болезни у людей (главным образом болезни адаптации), является неспецифической реакцией организма и служит показателем сниженной энергетики организма. Уровень натрия во внутренней среде организма предлагается для диагностики стрессового состояния животных.
Библиографическая ссылка
Запруднова Р.А., Гарина Д.В. ИОННАЯ РЕГУЛЯЦИЯ У ЖИВОТНЫХ И ЧЕЛОВЕКА ПРИ СТРЕССЕ: СРАВНИТЕЛЬНЫЕ АСПЕКТЫ // Научное обозрение. Биологические науки. 2022. № 4. С. 32-43;URL: https://science-biology.ru/ru/article/view?id=1292 (дата обращения: 06.03.2026).
DOI: https://doi.org/10.17513/srbs.1292


 science-review.ru
science-review.ru