Введение
Известно, что в настоящее время распространенность гипотиреоза в общей популяции населения составляет приблизительно 2%, однако в некоторых возрастных группах этот показатель может достигать 6–8%. Клинические проявления заболевания отличаются разнообразием и специфичностью, зачастую они не определяются, маскируясь под другими патологиями [1]. Это связано с тем, что тиреоидные гормоны обладают широким спектром влияния. Они усиливают захват кислорода, повышают уровень глюкозы в крови, усиливают глюконеогенез в печени, тормозят синтез гликогена в печени и скелетных мышцах, они ответственны за захват и утилизацию глюкозы клетками, активность ключевых ферментов углеводного, белкового и липидного обмена. Кроме того, тиреоидные гормоны повышают системное артериальное давление, частоту и силу сердечных сокращений, частоту дыхания, температуру тела и уровень основного обмена [2]. Гормоны щитовидной железы также играют определяющую роль в росте и развитии нервной, костной систем, тканей, двигательной активности соматических и висцеральных органов. Так, при гипотиреозе имеет место снижение моторной активности желудочно-кишечного тракта на фоне уменьшения как электрической, так и механической активности пищевода, желудка, тонкой и толстой кишки [3]. Эти нарушения сопровождаются дисфагией, замедлением эвакуации пищи из желудка и её продвижения по кишечнику. Хотя влияние гипотиреоза на моторику органов пищеварения описано [3; 4], сведения о воздействии функциональной недостаточности щитовидной железы на гидролиз и транспорт нутриентов, в частности углеводов, в литературе отсутствуют.
Тиреоидные гормоны также принимают участие в регуляции углеводного обмена посредством прямого воздействия на экспрессию генов, а также перекрестного взаимодействия с другими ядерными рецепторами [5]. Однако, несмотря на то, что основным источником энергии в организме являются углеводы и что среди макронутриентов содержание углеводов в пище наибольшее, роль тиреоидных гормонов в ассимиляции углеводов в полости желудочно-кишечного тракта не исследована.
Цель работы – изучить влияние экспериментального гипотиреоза на гидролиз и всасывание углеводов в тонкой кишке крыс.
Материалы и методы исследования
Опыты были проведены на белых беспородных крысах-самцах массой 200-220 г. Крыс содержали в виварии при естественном освещении и комнатной температуре. Доступ к воде и пище у животных был неограничен.
Гипотиреоз у крыс вызывали интрагастральным введением мерказолила (АО «Акрихин», Россия) в дозе 0,5 мг/кг/24 ч в течение 30 дней. Животным контрольной группы вводили физиологический раствор в том же объеме и в то же время, что и крысам контрольной группы. Для анализа крови крыс забивали на 31-й день наблюдений декапитацией под лёгким эфирным наркозом с соблюдением стандартных норм и правил обращения с лабораторными животными.
В сыворотке крови были определены уровень тиреотропного гормона (ТТГ) и также уровень общих трийодотиронина (Т3) и тироксина (Т4). В слизистой оболочке тонкой кишки и кишечном химусе были определены активности дисахаридаз – мальтазы (КФ 3.2.1.20) и сахаразы (КФ 3.2.1.48).
Для определения уровня гормонов кровь собирали при декапитации животных в гепанизированные пробирки. Затем образцы центрифугировали при 5000 об./мин. в течение 15 минут на центрифуге D2012 plus (DLAB, Китай). Сыворотку крови тщательно отсасывали и использовали для определения уровня тиреоидных гормонов. Только те крысы, уровень Т4 у которых был вдвое ниже, чем у крыс контрольной группы, допускались для изучения процессов гидролиза и всасывания углеводов в тонкой кишке.
Содержание Т4 и ТТГ в сыворотке крови крыс было определено с помощью иммуноферментного анализатора RT-2100C Rayto (Китай) и набора реактивов Sunlong biotech (Китай), а уровень Т3 в сыворотке крови выявляли на этом же иммуноферментном анализаторе с использованием набора реактивов Assay Genie ELISA KITS (Ирландия).
Для определения активности пищеварительных карбогидраз у декапитированного животного вскрывали брюшную полость, извлекали из неё тонкую кишку и очищали от жирового слоя. Тонкий кишечник промывали физиологическим раствором из расчёта 10 мл на 1 см его длины, полученный химус собирали в мерные центрифужные пробирки. Кишечник разрезали вдоль, просушивали фильтровальной бумагой и затем слизистую кишечника отделяли на стеклянной поверхности пластиковым шпателем. Определив массу слизистой, к ней добавляли физиологический раствор в соотношении 1/9, смесь гомогенизировали с помощью тефлонового гомогенизатора при 300 оборотах в минуту. Полученные смыв кишечника и гомогенат отставали около 30 минут и затем центрифугировали на лабораторной центрифуге DN0412, DLAB (Китай). Все операции проводили в холоде.
Супернатанты слизистой кишечника и химуса использовали для инкубации с субстратами. В качестве судстрата для определения активности сахаразы применяли 2%-ный раствор сахарозы, а для определения активности мальтазы – 2%-ный раствор мальтозы.
После 30-минутной инкубации супернатанта слизистой оболочки и химуса тонкой кишки с субстратами в них определяли активности сахаразы и мальтазы глюкооксидазным методом по А. Далквисту (1964) [6]. Активность фермента выражали в мкмоль образовавшейся глюкозы за 1 мин. на 1 слизистой для дисахаридаз мукозы или на 1 мл химуса для дисахаридаз в содержимом тонкой кишки.
Для определения всасывания глюкозы подопытное животное усыпляли препаратом Xyla (кетамин-кселазин) (70 мг/кг) [7]. У наркотизированной крысы изолировали отрезок тонкой кишки длиной около 20 см, при сохранности его иннервации и кровоснабжения, и исследовали на нем всасывание глюкозы по Козловой и др. [8]. Для этого в изолированный и промытый 5 мл физиологического раствора отрезок тонкой кишки вводили 2 мл раствора глюкозы концентрацией 100 ммоль/л. В отличие от Козловой и других [8], в данной работе была изучена концентрация глюкозы не только в конечном инкубате раствора глюкозы в изолированной петле тонкой кишки, но и в сыворотке крови. Инкубирование раствора глюкозы в кишечнике продолжалось в течение 15 минут. Глюкозу в инкубате в конце 15-минутного наблюдения определяли при помощи биохимического анализатора Rayto RT1904C (Китай). Глюкозу в крови, полученной при насечке хвоста крысы, определяли при помощи глюкометра «Акку-Чек Актив» (Германия).
Результаты анализировались с использованием t-критерия Стьюдента. Рассчитывали среднее арифметическое (М), стандартную ошибку и коэффициент достоверности (Р). Вероятность, превышающая 95%, считалась статистически значимой (P < 0,05).
Результаты исследования и их обсуждение
Содержание ТТГ и общего Т3 и Т4 в сыворотке крови крыс с экспериментальным гипотиреозом представлено на рисунке.
Видно, что у гипотиреоидных крыс содержание ТТГ увеличилось на 116,2%, а содержание Т4 и Т3, напротив, уменьшилось на 79,9 и 76,1% соответственно по сравнению с животными контрольной группы. Эти данные показывают, что у крыс экспериментальной группы выработан манифестный гипотиреоз, который проявляется в повышении концентрации гипофизарного ТТГ на фоне уменьшения концентрации тиреоидных гормонов в циркулирующей крови.
В таблице 1 показана активность кишечных дисахаридаз у крыс контрольной и экспериментальных групп в слизистой оболочке и химусе тонкой кишки.
Видно, что у крыс с гипотиреозом активность сахаразы слизистой оболочки тонкой кишки уменьшилась на 34,0%, а в кишечном содержимом на 41,7% по сравнению с контролем. Активность второй исследуемой α-глюкозиды – мальтазы у крыс с экспериментальным гипотиреозом в слизистой оболочке и химусе тонкой кишки также уменьшилась – на 37,7 и 44,9% соответственно по сравнению с животными, обработанными физиологическим раствором.
Следовательно, экспериментальный гипотиреоз приводит к уменьшению гидролитической способности тонкой кишки, что проявлялось в уменьшении активности мальтазы и сахаразы в слизистой оболочке и химусе тонкой кишки.
На последнем этапе данного исследования была определена скорость всасывания глюкозы из растворов глюкозы в изолированном отрезке тонкой кишки (табл. 2 и 3).
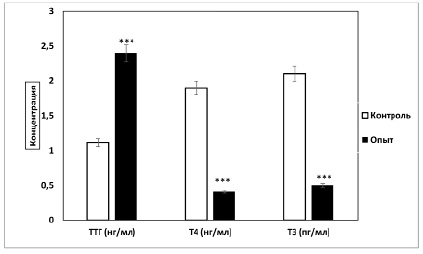
Содержание ТТГ, Т4 и Т3 в сыворотке крови у крыс с экспериментальным гипотиреозом (M±m; при n=6)
Таблица 1
Содержание ТТГ, Т4 и Т3 в сыворотке крови крыс с экспериментальным гипотиреозом (M±m; при n=6)
|
Группы животных |
Мукоза |
Химус |
|
Сахараза |
||
|
Контроль % Гипотиреоз % Р |
5,6 ± 0,2 100 3,70±0,25 66,0 <0,001 |
3,6 ± 0,3 100 2,1±0,2 58,3 <0,001 |
|
Мальтaзa |
||
|
Контроль % Гипотиреоз % Р |
21,2±0,36 100 13,2±0,9 62,3 <0,001 |
15.6±0,36 100 8,6±0,2 55,1 <0,001 |
Таблица 2
Содержание глюкозы в крови крыс с экспериментальным гипотиреозом после инкубации раствора моносахарида в изолированном отрезке тонкой кишки (ммоль/л) (М±m при n=6)
|
Группы животных |
До инкубации |
После инкубации |
∆ |
|
Контроль % |
4,9±0,3 100 |
11,3±0,1 100 |
6,4±0,2 100 |
|
Гипотиреоз % Р |
4,2±0,2 85,7 <0,02 |
7,55±0,16 66,8 <0,001 |
3,3±0,3 78,5 <0,01 |
Примечание: ∆ – разница в концентрации глюкозы в начале и конце инкубации.
Таблица 3
Содержание глюкозы в кишечном инкубате крыс с экспериментальным гипотиреозом после инкубации раствора моносахарида в изолированном отрезке тонкой кишки (ммоль/л) (М±m при n=6)
|
Группы животных |
Количество глюкозы в начальном растворе, ммоль |
Количество всосавшейся глюкозы, ммоль |
% всасывания глюкозы |
|
Контроль % |
30,4±0.43 |
26.2±0.2 100 |
86,1±0.82 100 |
|
Гипотиреоз % Р |
21,7±0.3 82,8 <0,001 |
71,3±0.68 82,8 <0,001 |
Из таблицы 2 видно, что гипотиреоз сам по себе приводит к снижению содержания уровня глюкозы в крови. У крыс с экспериментальным гипотиреозом уровень глюкозы был меньше по сравнению с контрольными животными на 14,3%, ещё до введения моносахарида в полость тонкой кишки. После введения и инкубирования раствора глюкозы в изолированной петле тонкой кишки уменьшение уровня глюкозы в крови у гипотиреоидных крыс было выражено в большей степени по сравнению с животными контрольной группы и составляло 33,2% по сравнению с контролем, что говорит о том, что скорость перехода глюкозы из полости тонкой кишки в гемоциркуляцию у крыс с экспериментальным гипотиреозам намного меньше, чем у крыс контрольной группы.
Данные таблицы 3 показывают, что эффективность всасывания глюкозы у крыс контрольной группы составила 86,14%, а у гипотериоидных крыс этот показатель был на 14,8% ниже. И этот тест также подтверждает, что интенсивность всасывания глюкозы в тонкой кишке под влиянием экспериментального гипотиреоза ингибируется.
Следовательно, гипотиреоз вызывает существенное снижение всасывания глюкозы из полости тонкой кишки, о чем свидетельствует уменьшение концентрации моносахарида в растворе, полученного после инкубации в отрезке тонкой кишки. Меньший переход глюкозы из кишечника в кровь у гипотиреоидных крыс, по сравнению с контролем, проявляется также и в более низком содержании глюкозы в крови после углеводной нагрузки, т.е. введения глюкозы в отрезок тонкой кишки, что, возможно, является одной из причин отмеченной у гипотиреоидных крыс гипогликемии.
Таким образом, данные показывают, что гипотиреоз оказывает существенное влияние на процессы гидролиза и всасывания углеводов в тонкой кишке. Это проявляется в уменьшение активности энтеральных мальтазы и сахаразы, а также в уменьшении эффективности всасывания глюкозы у гипотиреоидных крыс по сравнению с крысами контрольной группы. Ранее было выявлено, что гипотиреоидное состояние матери приводит к задержке развития кишечных сахаразы и мальтазы, а гипертиреоидное, напротив, приводит к преждевременной экспресии активности этих дисахаридаз у крыс-сосунков [9], что наводило на мысль об участии тиреоидных гормонов материнского молока в развитии кишечного пищеварения у потомства. Полученные данные явно свидетельствуют о регуляторной роли собственных тиреоидных гормонов в пищеварении и всасывании углеводов, что проявлялось в уменьшении активности энтеральных карбогидраз и эффективности всасывания глюкозы у крыс-самцов с гипотиреозом.
Следовательно, гипотиреоз, помимо влияния на моторную активность кишечника [3], оказывает заметное репрессирующее влияние и на секреторную и всасывательную функцию кишечника.
Известно, что уровень глюкозы в сыворотке крови уравновешивается поступлением глюкозы в кровоток и ее выведением из него. Глюкоза, поступающая в кровоток, в первую очередь обуславливается процессами гидролиза и всасывания углеводов, поступающих с пищей в кишечник, а также гликогенолизом и глюконеогенезом в тканях [10]. Полученные данные показывают, что в глюкозном гомеостазе, который имеет решающее значение для поддержания жизни млекопитающих, существенная роль, помимо инсулина бета-клеток поджелудочной железы, принадлежит и гормонам щитовидной железы. Это проявлялось в снижении активности мальтазы и сахаразы слизистой оболочки тонкой кишки и скорости всасывания глюкозы у гипотиреоидных крыс по сравнению с контрольными животными. Кроме того, полученные данные показывают, что одной из причин гипогликемии, проявляющейся при гипотиреозе, может быть ингибирование периферического усвоения глюкозы, т.е. уменьшение темпов гидролиза и всасывания углеводов в тонкой кишке.
Заключение
Таким образом, полученные данные показывают, что при экспериментальном фармакологическом гипотиреозе у крыс снижаются активности мембраносвязанных кишечных карбогидраз (мальтазы, сахаразы) и также всасывание глюкозы из полости тонкой кишки. Выраженная репрессия активности ферментов, переваривающих основные углеводы пищи (мальтаза и сахараза), свидетельствует о заметном участии щитовидной железы в глюкозном гомеостазе путем регуляции кишечного пищеварения и всасывания углеводов в тонкой кишке. Следовательно, нарушения гидролитической и всасывательной функции кишечника при гипотиреозе необходимо принимать во внимание как при лечении различных видов гипотиреоза, так и при терапии мальдигестии и мальабсорбции углеводных компонентов пищи.
Библиографическая ссылка
Кучкарова Л.С., Бердиерова С.Х., Каюмов Х.Ю. ВЛИЯНИЕ ЭКСПЕРИМЕНТАЛЬНОГО ГИПОТИРЕОЗА НА ГИДРОЛИЗ И ВСАСЫВАНИЕ УГЛЕВОДОВ В ТОНКОЙ КИШКЕ // Научное обозрение. Биологические науки. 2025. № 2. С. 18-22;URL: https://science-biology.ru/ru/article/view?id=1400 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1400


 science-review.ru
science-review.ru