Введение
Тиоацетамид (ТАА) широко используется для моделирования печеночного повреждения, опосредованного окислительным стрессом [1–3]. Считается, что фиброзные изменения в печени лабораторных животных под воздействием ТАА во многом схожи с таковыми у людей, что позволяет детально изучать молекулярно-клеточные механизмы, лежащие в основе фиброзного процесса [3], а также апробировать подходы к лечению этого патологического состояния [4]. Токсичность ТАА тесно связана с его биотрансформацией в реактивные метаболиты: токсикант подвергается двухэтапному окислению в печени, сперва образуя сульфоксид, первичный метаболит, образующийся при монооксигеназном окислении. Дальнейшим этапом является образование высокореактивного сульфдиоксида. Оба этих метаболита способны взаимодействовать с макромолекулами напрямую и опосредованно. Прямое взаимодействие включает возможность ковалентно связываться с нуклеофильными центрами ДНК, белками и фосфолипидами мембран, индуцируя перекисное окисление липидов. Опосредованное действие связано с генерацией активных форм кислорода, разобщением окислительного фосфорилирования и дальнейшей митохондриальной дисфункцией, истощением антиоксидантной системы [3, 5].
Известно, что тиоацетамид вызывает как острые, так и хронические поражения печени в экспериментальной модели на животных [1–3]. Кроме того, он способен индуцировать серьезные нарушения со стороны других органов и систем: вызывает печеночную энцефалопатию, метаболический ацидоз, повышение уровня трансаминаз, нарушение свертываемости крови [3, 5]. В отличие от детально изученных гепатотоксических эффектов [1–3], нефротоксическое действие ТАА остается недостаточно исследованным. Согласно имеющимся данным, острое воздействие ТАА в дозах от 25 до 100 мг/кг массы тела приводит к значительному повышению активности цитолитических ферментов, свидетельствующему о гепатоцеллюлярном повреждении, а также вызывает увеличение экскреции с мочой биомаркера почечного повреждения KIM-1, «kidney injury molecule-1» [6]. При этом биохимические изменения не сопровождаются выраженными гистоморфологическими нарушениями в почечной ткани [6]. В другом исследовании показано, что при длительном воздействии ТАА вызывает нефротоксичность, проявляющуюся повреждением клубочков, застоем, повышением уровней азота мочевины и креатинина, а также дисрегуляцией провоспалительных цитокинов и маркеров окислительного стресса [1]. Однако молекулярные механизмы развития этих нарушений, особенно при субхроническом и хроническом воздействии, требуют дальнейшего изучения.
Цель исследования – в условиях эксперимента провести оценку изменений экспрессионной активности генов антиоксидантной защиты (Nfe2l2, Hmox1, Nqo1) в почечной ткани крыс при длительном воздействии тиоацетамида.
Материалы и методы исследования
Планирование работы осуществлялось с учетом набора рекомендаций, разработанных для улучшения качества исследований, связанных с использованием животных, – ARRIVE guidelines (Animal Research: Reporting of In Vivo Experiments). Экспериментальное исследование было одобрено биоэтическим комитетом учреждения, протокол № 01-02 от 08.02.2024 и осуществлялось в соответствии с требованиями законодательства Российской Федерации в отношении лабораторных животных в условиях специально оборудованного вивария. Животные находились в стандартных условиях вивария при 12-часовом световом режиме и температуре 21–26 °С, на стандартном пищевом рационе, при неограниченном доступе к воде и пище. Акклиматизация продолжалась 5 дней. Хронический эксперимент был выполнен на 28 аутбредных конвенциональных крысах-самцах в течение 100 дней, с промежуточным контролем изменения параметров через 50 дней от начала воздействия. Начальный вес животных составлял 170–190 г, возраст – 12–14 недель.
Экспериментальные животные случайным образом были распределены на 2 группы по 14 животных в каждой. Животным первой группы на протяжении периода воздействия вводили ТАА в разовой дозе 50 мг/кг массы тела («Опыт»). Вторая группа являлась контрольной («Контроль») и получала эквивалентный токсиканту объем растворителя (физиологического раствора) в аналогичном режиме.
Выбор дозы был обусловлен на основании литературных данных по экспериментальному моделированию фиброза печени у крыс [1–3]. Вместе с тем имелись весомые аргументы в пользу использования доз значительно меньших, чем классические токсические уровни токсиканта. Во-первых, в современных условиях концентрации загрязнителей среды обитания, с учетом устойчивого снижения уровня химической нагрузки, редко достигают высоких токсичных уровней. Выбор низкой дозы сделает результаты эксперимента более применимыми для экстраполяции. Во-вторых, выявление молекулярно-генетических механизмов предполагает использование низких доз, что позволяет изучить ранние маркеры повреждений до того, как произойдут необратимые изменения в тканях. Высокие же дозы вызывают массовую гибель клеток и быстрое развитие органной недостаточности, что затрудняет анализ.
По завершению воздействия выведение животных из эксперимента осуществляли эвтаназией углекислым газом с последующей декапитацией. Транскрипционную активность генов оценивали в почках животных, немедленно извлеченных после эвтаназии. Изменение регуляции клеточной защиты от окислительного стресса оценивали с помощью анализа экспрессии гена NFE2 like bZIP transcription factor 2. Он был выбран, поскольку важнейшим участником антиоксидантной защиты во всех клетках является фактор транскрипции Nrf2, кодируемый геном Nfe2l2, ядерный фактора эритроидного происхождения 2 (идентификатор гена согласно NCBI: 83619). Он активирует экспрессию множества генов, кодирующих антиоксидантные ферменты и белки детоксикации [7, 8]. Нормальная активность этого гена имеет решающее значение для поддержания окислительно-восстановительного, метаболического и белкового гомеостаза, а также для регуляции воспалительных процессов [8]. Nfe2 экспрессируется во многих органах, причем большая часть его в почках и мышцах, менее – в легких, сердце, печени и головном мозге. Известно, что при нормальных условиях, в отсутствие стресса, Nfe2 поддерживается в цитоплазме кластером белков, которые быстро его деградируют. При влиянии окислительного стресса Nrf2 не разрушается, а вместо этого переходит в ядро, где связывается с промотором ДНК и инициирует транскрипцию антиоксидантных генов и их белков [9]. В исследовании анализировали также изменения экспрессии гена Heme oxygenase 1 (Hmox1), который кодирует фермент гемоксигеназу-1 (идентификатор гена согласно NCBI: 24451). Гемоксигеназа-1 катализирует распад гема до биологически активных молекул: монооксида углерода, двухвалентного железа и биливердина-IXα, который затем восстанавливается до билирубина-IXα биливердинредуктазой [10]. Экспрессия Hmox1 находится под строгим транскрипционным контролем через Nrf2/Bach1-зависимые пути и активируется в ответ на окислительный стресс и избыток свободного гема, как потенциального катализатора перекисного окисления липидов. Hmox1 рассматривается как чувствительный биомаркер окислительного стресса, его уровень коррелирует с тяжестью соматической патологии [10]. Изучали уровень экспрессии гена NAD(P)H quinone dehydrogenase 1 (Nqo1), NAD(P)H-дегидрогеназы хинон 1, кодирующего NAD(P)H-хиноноксидоредуктазу 1 (идентификатор гена согласно NCBI: 24314). NAD(P)H-хинон оксидоредуктаза 1 является антиоксидантным ферментом, критическим компонентом антиоксидантной защиты, который катализирует двухэлектронное восстановление биомолекул, за счет чего обеспечивает детоксикацию ксенобиотиков и регуляцию окислительно-восстановительного баланса в клетке [11, 12]. Антиоксидантные свойства NQO1 особенно важны при истощении других детоксикационных систем [11, 12]. РНК выделяли из тканевых образцов органа с использованием набора ExtractRNA («Евроген», Россия) в строгом соответствии с инструкциями производителя. Синтез кДНК осуществляли с применением набора реактивов MMLV RT kit и праймеров олиго(dT)15 («Евроген», Россия). Для исследования транскрипции генов использовали метод полимеразной цепной реакции в режиме реального времени, при котором применяли специфичные олигонуклеотидные праймеры и интеркалирующий краситель SYBR Green. Ген Gapdh служил внутренним контролем. Для оценки относительной экспрессии генов использовался общепринятый метод, предложенный K.J. Livak и T.D. Schmittgen [13]. Для определения разницы между группами рассчитывался показатель ΔΔCT, который представлял собой разность между средним значением ΔCT группы сравнения и группы контроля. Результирующее значение, полученное посредством экспоненциального преобразования этой разности, интерпретировалось как «fold change», что позволяло оценить, насколько изменена экспрессия целевого гена в исследуемой группе относительно контроля.
Статистический анализ проводили с использованием программного обеспечения SPSS Statistics 21.0 (IBM, USA). В качестве критерия нормальности распределения признаков в изучаемых группах использовали критерий Колмогорова – Смирнова. При нормальном распределении данных для оценки значимости различий между группами использовали однофакторный дисперсионный анализ (ANOVA) и апостериорные критерии Тьюки и Тамхейна. Данные представлены как среднее арифметическое и стандартная ошибка. Статистический анализ данных проводился с использованием метода бутстрап (Bootstrap), что обеспечивало надежность и воспроизводимость результатов через многократную генерацию выборок методом Монте-Карло. Различия считали статистически значимыми при р < 0,05.
Результаты исследования и их обсуждение
Результаты исследования представлены на рисунке. Не выявлено статистически значимых изменений в кратности экспрессии гена Nqo1 в ткани почек крыс как на 50-й день воздействия ( -7,26 ± 0,28 в группе «Контроль» против -7,17 ± 0,09 в группе «Опыт», p = 0,783), так и на 100-й день воздействия (-8,23 ± 0,20 против -8,15 ± 0,43, p = 1,000).
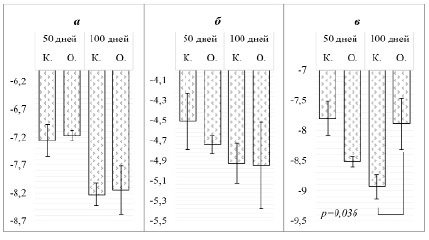
Изменение кратности экспрессии генов антиоксидантной защиты в почках крыс при субхроническом и хроническом воздействии тиоацетамида: Nqo1 (а), Nfe2l2 (б), Hmox1 (в). По оси ординат указана относительная кратность экспрессии исследуемого гена, по оси абсцисс – группы животных
Не обнаружено статистически значимых различий в уровне экспрессии гена Nfe2l2 между группами в ткани почек крыс как на 50-й день воздействия (-4,51 ± 0,14 против -4,74 ± 0,21, p = 1,000), так и на 100-й день (-4,93 ± 0,17 против -4,95 ± 0,15, p = 0,937). Кратность экспрессии гена Hmox1 не изменилась на 50-й день воздействия (-7,80 ± 0,31 против -8,52 ± 0,25, p = 0,4452), однако продемонстрировала различия относительно контроля с 100 дням воздействия (-7,89 ± 0,20 против -8,93 ± 0,32, p = 0,036).
Хроническое воздействие ТАА в исследуемых условиях не привело к достоверным изменениям экспрессии генов Nqo1 и Nfe2l2, однако вызвало избирательное увеличение уровня экспрессии Hmox1 на 100-й день. Эти результаты требуют интерпретации с учетом известных механизмов действия ТАА и физиологии антиоксидантной системы. Исходя из известных по данным научной литературы механизмов действия тиоацетамида и регуляции изученных генов антиоксидантной защиты, можно сделать следующие выводы.
Ген Nfe2l2, кодирующий транскрипционный фактор Nrf2, играет ключевую роль в регуляции клеточной антиоксидантной защиты и детоксикации. Повышение его экспрессии характерно для острого или умеренного окислительного стресса [7, 8]. Такой эффект был показан как на примере токсических воздействий при интоксикации этанолом, лекарственными средствами и тетрахлорметаном [14], так и при различных физиологических и патологических состояниях, таких как физическая нагрузка [9] и опухолевый процесс [15]. Однако в условиях хронической интоксикации возможно истощение клеточных антиоксидантных резервов, прежде всего пула глутатиона, необходимого для адекватного функционирования сигнального пути Nrf2–Keap1 [16]. Это может приводить к угнетению экспрессии Nfe2l2 на поздних сроках. Высказанное авторами предположение подтверждается результатами экспериментального исследования, в котором авторы при воздействии ТАА в дозе 200 мг/кг массы тела обнаружили как повышение уровня глутатиона к третьему месяцу воздействия, так и ряд изменений, в совокупности указывающий на нарушение функционирования γ-глутамильного цикла [2]. γ-глутамильный цикл представляет собой ключевую биохимическую систему, обеспечивающую метаболизм глутатиона – главного клеточного антиоксиданта. В отличие от первоначальных представлений, современные данные показывают, что этот цикл не участвует в транспорте аминокислот, а представляет собой сложную регулируемую систему, обеспечивающую не только антиоксидантную защиту, но и участвующую в ключевых метаболических процессах детоксикации. Его нарушение приводит к каскаду патологических изменений на клеточном и организменном уровнях [17]. Дополнительным фактором, потенциально влияющим на экспрессию Nfe2l2, может быть дисбаланс аминокислотного обмена. Известно, что изменение аминокислотного профиля может модулировать активность Nrf2 [18], а ТАА способен нарушать аминокислотный обмен в тканях почек [3]. Также возможно, что метаболиты ТАА, особенно тиоацетамидсульфоксид, могут индуцировать повреждение клеточных структур напрямую, минуя классические пути окислительного стресса, что снижает участие Nrf2-зависимых механизмов [19].
Отсутствие изменений в экспрессии гена Nqo1 также может быть обусловлено особенностями метаболизма ТАА. Несмотря на то, что Nqo1 участвует в детоксикации ряда ксенобиотиков, включая ароматические и хинон-содержащие соединения [11, 12], его участие в метаболизме ТАА ограничено. Основной путь биоактивации ТАА реализуется через CYP2E1-зависимое окисление до реактивных метаболитов (ТАА-S=O и ТАА-SO₂), а не через субстраты, традиционно индуцирующие Nqo1. Это может объяснять отсутствие изменения транскрипции Nqo1 при субхроническом воздействии ТАА в используемой дозе.
Наиболее существенные изменения выявлены для гена Hmox1, кодирующего гемоксигеназу-1 – фермент, чувствительно реагирующий на широкий спектр повреждающих факторов, включая окислительный стресс, воспаление и гипоксию [10]. Увеличение экспрессии Hmox1 на 100-й день воздействия ТАА, при отсутствии активации Nfe2l2, может свидетельствовать о переходе от ранней антиоксидантной адаптации к поздней стадии стресс-ответа, в том числе фиброгенезу. Повышенная экспрессия Hmox1 ранее описана как один из маркеров фибротических процессов [20], что позволяет предположить, что в проведенном эксперименте на позднем сроке могли начаться процессы ремоделирования интерстициальной ткани почек. Настоящее предположение требует дополнительных исследований – например, гистоморфологических исследований с применением специфических гистохимических окрасок для визуализации коллагеновых волокон, иммуногистохимического метода для оценки наличия маркеров маркеры фиброгенеза и пролиферативной активности, либо морфометрического анализа с количественной оценкой площади фиброза при наличии выраженных изменений тканей.
Заключение
После 100 дней воздействия ТАА в разовой дозе 50 мг/кг массы тела наблюдается изолированная активация гена Hmox1 при отсутствии изменений со стороны экспрессии генов Nfe2l2 и Nqo1, что может отражать сдвиг в сигнальных путях клеточного ответа от Nrf2-зависимого антиоксидантного механизма к более поздним адаптационно-воспалительным реакциям. Это согласуется с гипотезой о том, что в условиях длительного воздействия ТАА происходит истощение первичных защитных механизмов и переход к активации неспецифических стресс-ассоциированных генов; согласуется и с данными о способности гена Hmox1 отражать течение фибротических процессов. Вместе с тем для окончательного подтверждения этого предположения необходимы дополнительные гистоморфологические исследования, направленные на оценку состояния тканей почек и наличие фибротических изменений в структурах органа.
Библиографическая ссылка
Рябова Ю.В., Якупова Т.Г., Репина Э.Ф., Смолянкин Д.А., Каримов Д.О., Ахмадеев А.Р., Хуснутдинова Н.Ю. ИЗМЕНЕНИЯ КРАТНОСТИ ЭКСПРЕССИИ ГЕНОВ NFE2L2, HMOX1 И NQO1 В ТКАНИ ПОЧЕК КРЫС ПРИ ДЛИТЕЛЬНОМ ВОЗДЕЙСТВИИ ТИОАЦЕТАМИДА // Научное обозрение. Биологические науки. 2025. № 2. С. 33-38;URL: https://science-biology.ru/ru/article/view?id=1403 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1403


 science-review.ru
science-review.ru