Введение
Рак молочной железы является одним из распространённых видов рака среди женщин и одной из ведущих причин смертности среди них. В частности, в Узбекистане в период с 2019 по 2021 год рак молочной железы был диагностирован у 10 984 женщин [1]. В настоящее время имеется множество данных о различных факторах, влияющих на развитие онкологических заболеваний. Одним из таких факторов является наследственная предрасположенность. Последние исследования выявили наличие генов с высокой (BRCA1, BRCA2, TP53), средней (ATM, CDH1, CHEK2) и низкой пенетрантностью, которые могут способствовать развитию рака молочной железы [2-4]. Частота встречаемости генов риска рака молочной железы (РМЖ) варьирует среди различных популяций. Насколько нам известно, частота распространения гена CHEK2 (белка CHK2) среди узбекских популяций до настоящего времени не изучалась. Протеин киназа CHEK2 (hCDS1) состоит из 543 аминокислот и имеет молекулярную массу 60 915 Да. Этот ген отвечает за синтез белка CHK2, который играет важную роль в процессах репарации ДНК и апоптоза [5]. Ген CHEK2 фосфорилируется на остатке Thr68 с участием ATM, после чего взаимодействует с такими молекулами, как CDC25, CDC25B, CDC25C, NEK6, транскрипционный фактор FOXM1, TP53, BRCA1 или BRCA2. Он является одним из ключевых факторов, контролирующих процесс деления клетки [6]. Ген CHEK2 состоит из 16 экзонов, а его белковый продукт включает три основных домена. N-концевой SCD (SQ/TQ) домен, выполняющий регуляторную функцию, охватывает 20–75 аминокислот. FHA-домен охватывает 112–175 аминокислот и отвечает за связывание белка CHK2 с другими фосфорилированными белками. C-концевой серин-треонинкиназный KD-домен охватывает 225–475 аминокислот [7]. В нашем исследовании мы изучили два полиморфизма гена CHEK2, влияющих на функцию белка: 1100delC и IVS2+1G>A. Полиморфизм 1100delC гена CHEK2 возникает в результате делеции одного цитозина в позиции 1100, что приводит к сдвигу рамки считывания и внедрению стоп-кодона после 380 аминокислот [8]. Установлено, что носители полиморфизма 1100delC подвержены не только риску развития РМЖ, но и более высокой вероятности возникновения рака желудка, почек и саркомы. Носители этого патогенного варианта имеют риск развития рака молочной железы в 2,0–4,8 раза выше в течение жизни [9]. Сплайсинговая мутация IVS2+1G>A приводит к дефектному взаимодействию CHEK2 с p53, Cdc25 и BRCA1 [10]. В результате нарушается функция гена CHEK2.
Поскольку до настоящего времени исследования полиморфизмов CHEK2 среди узбекских женщин не проводились, целью данного исследования было изучение связи двух полиморфизмов гена CHEK2 (1100delC и IVS2+1G>A) с РМЖ. Полиморфизм 1100delC и IVS2+1G>A в различных популяциях может отличаться. Мутация 1100delC является одной из наиболее распространённых, и в некоторых популяциях она ассоциируется с 28-37% риском развития РМЖ в течение жизни [11; 12]. Частота встречаемости 1100delC в популяциях стран Северной Европы, таких как Финляндия, Великобритания, Нидерланды, составляет 1,4% [13-15], в Швеции – 0,7% [16], в Польше – 0,25%, в Чехии – 0,15% [17]. Полиморфизм IVS2+1G>A гена CHEK2 также ассоциирован не только с РМЖ, но и с развитием рака мочевого пузыря, толстого кишечника, предстательной железы, желудка и щитовидной железы [18]. Однако данный полиморфизм изучен слабо. Известно, что он встречается среди населения Германии, Восточной Европы, Беларуси и Польши [11; 18]. Мы думаем, что редкость мутации IVS2+1G>A в популяциях может быть связана с недостаточной изученностью [19]. Исследования показали, что IVS2+1G>A, как и 1100delC, редко встречается или полностью отсутствует среди азиатских и тюркских популяций [19-21].
Цель исследования – изучение полиморфизмов IVS2+1G>A и 1100delC гена CHEK2 среди узбекских женщин, страдающих РМЖ.
Материалы и методы исследования
В исследовании было изучено два полиморфизма гена CHEK2 в основной группе пациенток, страдающих РМЖ (n = 200), и в условно здоровой контрольной группе (n = 100), состоящей из женщин узбекской национальности. Дополнительные сведения о пациентках были получены из их медицинских карт. Отсутствие РМЖ у женщин контрольной группы было подтверждено методом маммографии. Для исследования у пациенток из обеих групп было взято по 3 мл периферической крови, которая хранилась в пробирках с этилендиаминтетрауксусной кислотой (ЭДТА). Выделение ДНК из периферической крови проводилось с использованием лизационного раствора, фенола, хлороформа, этанола, а также наборов AmpliPraym Ribo-prep (ООО «Некст Био», Россия) и Diatom TM DNA Prep 100 («Лаборатория Изоген», Россия). Количество и качество выделенной ДНК оценивалось с помощью спектрофотометра NanoDrop 2000 (Thermo Fisher Scientific, США). Все молекулярно-генетические исследования проводились в отделе молекулярной медицины и клеточных технологий Республиканского специализированного научно-практического медицинского центра гематологии.
Анализ мутаций CHЕK2 1100delC и IVS2+1G>A методом ПЦР. Амплификация исследуемых локусов 1100delC (rs555607708) и IVS2+1G>A (rs121908698) гена CHEK2 проводилась методом ПЦР с использованием амплификатора Corbett Research GRADIENT PALM CYCLER PCR Analyzers CG1-96 (Австралия). Для амплификации применялись реактивы тест-набора компании Litex (01338-100, ООО НПФ «Litex», Россия). Для подготовки амплификационной смеси на один образец (с двумя компонентами АЛЛЕЛЬ-1 и АЛЛЕЛЬ-2) использовались 17,5 мкл растворителя, 2,5 мкл реакционной смеси, 0,2 мкл Taq-полимеразы. Готовая амплификационная смесь в объеме 20 мкл переносилась в пробирки, после чего в каждую пробирку добавляли по 1 капле (примерно 25 мкл) минерального масла. Затем в каждую амплификационную смесь АЛЛЕЛЬ-1 и АЛЛЕЛЬ-2 под слой масла добавляли 5 мкл анализируемой ДНК. В качестве отрицательного контроля в обе реакционные смеси добавляли 5 мкл растворителя, после чего пробирки центрифугировали на микроцентрифуге FV-2400 при 2400 об./мин. в течение 3–5 секунд. После пробирки помещали в термостат, предварительно нагретый до 94 °C, и амплификацию проводили согласно программе.
Детекция продуктов амплификации. Разделение продуктов амплификации проводилось методом горизонтального электрофореза в 3%-ном агарозном геле, приготовленном на ТАЕ-буфере. Для визуализации результатов электрофореза в гель добавляли 1%-ный раствор бромистого этидия в количестве 5 мкл на 50 мл расплавленного геля. Анализируемые фрагменты ДНК визуализировались под ультрафиолетовым (УФ) излучением на длине волны 310 нм, проявляясь в виде ярких оранжево-красных полос (рис. 1).
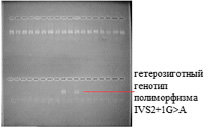
Рис. 1. Электрофореграмма выявления полиморфизма IVS2+1G>A гена CHEK2
Статистический анализ. Статистическая обработка полученных данных проводилась с использованием статистических компьютерных программ «WinPEPI 2016, Version 11.65» и «EpiCalc 2000, Version 1.02».
Результаты исследования и их обсуждение
Наибольшая частота заболеваний наблюдалась в возрастной категории 55–64 года (n = 63), а наименьшая – в возрастной группе 29–33 года (n = 7). По локализации опухоли у 2 пациенток новообразования выявлены в обеих молочных железах (правая и левая), у 100 пациенток – в левой молочной железе, у 98 пациенток – в правой молочной железе. Распределение по типу опухоли показало, что 20,3% пациенток имели люминальный А тип, 42,9% – люминальный B, 21,5% – HER2/neu-положительный, 15,2% – тройной негативный тип (табл. 1).
По стадиям заболевания 7 (3,5%) пациенток имели I стадию, 125 (62,5%) – II стадию, 60 (30%) – III стадию, 8 (4%) – IV стадию (рис. 2).
В 4 образцах из 200 в основной группе и 1 образце из контрольной группы был выявлен гетерозиготный генотип полиморфизма 1100delC гена CHEK2. Гетерозиготный генотип полиморфизма IVS2+1G>A был обнаружен в 6 образцах основной группы и в 1 образце контрольной группы (табл. 2).
Полиморфизмы IVS157+1G>A и 1100delC гена CHEK2 преимущественно выявлялись у женщин старше 45 лет (соответственно у 6 и 4 пациенток). У пациентов с выявленными полиморфизмами исследуемых локусов опухоли в основном имели размер 2-5 см (T2) и находились на II стадии заболевания (табл. 3).
Таблица 1
Описательные характеристики пациентов с раком молочной железы (n=200)
|
Характеристики пациенток основной группы (n=200) |
||||||||||
|
Возраст |
от 65 до 85 |
от 55 до 64 |
от 45 до 54 |
от 34 до 44 |
от 29 до 33 |
|||||
|
39 |
63 |
55 |
36 |
7 |
||||||
|
Локализация опухоли |
в обеих молочных железах |
в правой молочной железе |
в левой молочной железе |
|||||||
|
2 |
100 |
98 |
||||||||
|
Классификация вида рака молочной железы |
люминальный A |
люминальный B |
HER2 позитивный |
HER2 негативный |
||||||
|
20,3% |
42,9% |
21,5% |
15,2% |
|||||||
|
Стадия болезни |
I |
II |
III |
IV |
||||||
|
3,6% |
62,3% |
29,9% |
4,2% |
|||||||
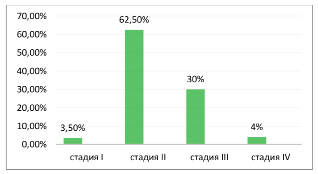
Рис. 2. Процентное соотношение пациентов с опухолью на различных стадиях
Таблица 2
Исследование связи предрасположенности к раку молочной железы с полиморфизмом гена CHEK2 в узбекской популяции
|
Мутация |
Основная группа (n=200) |
Контрольная группа (n=100) |
Частота (p) |
||
|
имеет |
не имеет |
имеет |
не имеет |
||
|
IVS157+1G>A |
6 |
194 |
1 |
99 |
p=0,2 |
|
1100delC |
4 |
196 |
1 |
99 |
p=0,5 |
Таблица 3
Связь полиморфизмов IVS2+1G>A и 1100delC с клиническими показателями пациентов основной группы (n=200)
|
Показатели |
Основная группа (n=200) |
IVS157+1G>A |
1100delC |
|
Возраст пациентов |
>45 лет |
6 |
3 |
|
<45 лет |
0 |
1 |
|
|
Размер опухоли |
>2 см (T1) |
1 |
0 |
|
2-5 см (T2) |
5 |
3 |
|
|
>5 см (T3) |
0 |
1 |
|
|
Опухоли, распространившиеся на органы грудной клетки различного размера (T4) |
0 |
0 |
|
|
Стадия |
I |
1 |
0 |
|
II |
5 |
3 |
|
|
III |
0 |
1 |
|
|
IV |
0 |
0 |
|
|
Локализация опухоли |
В обеих молочных железах |
0 |
0 |
|
В правой молочной железе |
3 |
2 |
|
|
В левой молочной железе |
3 |
2 |
|
|
Вовлечённость лимфоузлов (N) |
Метастазы в лимфатических узлах не обнаружены |
4 |
0 |
|
Метастазы в подмышечных лимфатических узлах |
2 |
2 |
|
|
Метастазы в соседних подмышечных лимфатических узлах |
0 |
2 |
|
|
Отдалённые метастазы |
Метастазы в других органах не обнаружены (M0) |
6 |
4 |
|
Метастазы в других органах обнаружены (M1) |
0 |
0 |
Таблица 4
Частота полиморфизмов 1100delC и IVS2+1G>A в основной и контрольной группах
|
Группа |
Частота аллелей C and G полиморфизма 1100delC |
Частота аллелей G and A полиморфизма IVS2+1G>A |
||||||
|
C |
G |
G |
A |
|||||
|
n |
% |
n |
% |
n |
% |
n |
% |
|
|
Основная группа (n = 200) |
396 |
99,0 |
4 |
1,0 |
394 |
98,5 |
6 |
1,5 |
|
Контрольная группа (n=100) |
199 |
99,5 |
1 |
0,5 |
199 |
99,5 |
1 |
0,5 |
Примечание: природный аллель полиморфизма 1100delC обозначен буквой C, функционально опасный аллель буквой G. Природный аллель полиморфизма IVS2+1G>A обозначен буквой G, функционально опасный аллель буквой A.
В исследовании у пациенток с выявленными полиморфизмами IVS157+1G>A и 1100delC не было обнаружено метастазов, что согласуется с полученными данными других авторов, что у 90% пациентов опухоль не метастазирует на момент постановки диагноза РМЖ [22].
Исследование CHEK2 1100delC и IVS2+1G>A в узбекской популяции выявило следующие результаты: функционально опасный аллель G в 1100delC встречался чаще у пациентов с раком молочной железы (РМЖ) по сравнению со здоровыми донорами (1,0% против 0,5%), но статистически значимых различий не выявлено (χ²=0,4; p=0,5). Относительный риск (OR) = 2,0 (95% ДИ: 0,22-18,11), коэффициент риска (RR) = 2,0 (95% ДИ: 0,22-17,77). Безопасный аллель C чаще встречался в контрольной группе, чем в основной (99,5% против 99%), но различие также не достигло статистической значимости (χ²=0,4; p=0,5). OR = 0,5 (95% ДИ: 0,05-4,48), RR = 1,0 (95% ДИ: 0,98-1,01). Функционально опасный аллель A в IVS2+1G>A также был чаще у пациентов с РМЖ, чем у здоровых доноров (1,5% против 0,5%), но статистически значимого различия не выявлено (χ²=1,2; p=0,2). OR = 3,0 (95% ДИ: 0,36-25,34), RR = 3,0 (95% ДИ: 0,36-24,75). Безопасный аллель G чаще встречался в контрольной группе (99,5% против 98,5%), но статистически значимых различий не выявлено (χ²=1,2; p=0,2). OR = 0,3 (95% ДИ: 0,04-2,76), RR = 0,9 (95% ДИ: 0,974-1,005). Несмотря на отсутствие статистической значимости, выявлено, что наличие аллеля A в IVS2+1G>A может увеличивать риск развития РМЖ в 3 раза (табл. 4).
Впервые в узбекской популяции было проведено изучение полиморфизмов IVS2+1G>A и 1100delC гена CHEK2 у женщин, страдающих раком молочной железы. Полученные результаты, по мнению автора, вносят вклад в повышение скорости и эффективности диагностики данного типа рака. Мутация IVS2+1G>A на данный момент изучена относительно мало, и исследование данного полиморфизма также способствует его идентификации в генетически близких популяциях, анализу его наследственных особенностей, а также проведению более широких генетических исследований.
Ограничения данного исследования. Во-первых, количество участников в основной и контрольной группах было относительно небольшим. Считается, что проведение данного исследования в более широком масштабе позволит повысить точность диагностики рака молочной железы у женщин. Во-вторых, большинство обследованных пациентов не имели выраженных клинических проявлений (в основном это были пациенты на II стадии заболевания без метастазов). В-третьих, период проведения исследования был ограничен (1,5 года). В связи с этим не было возможности получить данные о рецидивах заболевания или летальных исходах среди пациентов.
Заключение
В лечении онкологических заболеваний крайне важно своевременно поставить правильный диагноз, достичь максимально положительных результатов, сохранить жизнь пациента, также минимизировать ущерб здоровья пациента во время лечения. Определение частоты минорных аллелей имеет важное значение для выбора методов лечения, поскольку позволяет принимать решения о проведении радикальных хирургических операций, а также способствует своевременной профилактике заболевания среди родственников пациентов с выявленными мутациями. Полученные результаты показывают, что полиморфизмы IVS2+1G>A и 1100delC гена CHEK2 могут служить специфическими генетическими маркерами для оценки вероятности развития рака молочной железы в узбекской популяции. Автор надеется, что в дальнейшем будут проведены дополнительные исследования, направленные на изучение взаимосвязи гена CHEK2 с другими генами, отвечающими за процесс апоптоза, что позволит получить более точные данные.
Автор выражает искреннюю благодарность сотрудникам отделения маммологии Республиканского специализированного научно-практического медицинского центра онкологии и радиологии Республики Узбекистан и его Ташкентского городского филиала, а также сотрудникам отдела молекулярной медицины и клеточных технологий Республиканского специализированного научно-практического медицинского центра гематологии.
Библиографическая ссылка
Худойбердиева Н.В. АССОЦИАЦИЯ МУТАЦИЙ IVS2+1G>A И 1100DELC ГЕНА CHEK2 С РАКОМ МОЛОЧНОЙ ЖЕЛЕЗЫ В УЗБЕКСКОЙ ПОПУЛЯЦИИ // Научное обозрение. Биологические науки. 2025. № 2. С. 45-50;URL: https://science-biology.ru/ru/article/view?id=1405 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1405


 science-review.ru
science-review.ru