Введение
Известно, что распространение сахарного диабета приобретает пандемический характер. По данным Всемирной диабетической федерации в мире в 2021 г. 537 млн чел. болели сахарным диабетом [1]. Несмотря на обширные исследования, направленные на изучение сахарного диабета, все же еще остается ряд неизученных аспектов его патогенеза. Так как сахарный диабет относится к метаболическим заболеваниям, то интерес представляет состояние метаболизирующей системы организма. Одной из ведущих метаболизирующих систем организма является цитохром Р-450 зависимая монооксигеназная система, локализованная в эндоплазматическом ретикулуме печени, где осуществляется метаболизм ряда эндо- и ксенобиотиков [2; 3]. В литературе имеются сведения о состоянии монооксигеназной системы печени при сахарном диабете [4; 5]. Однако активность монооксигеназной системы печени индивидуальна для каждого организма, и поэтому остается вопрос об особенностях развития сахарного диабета у организмов с разной активностью монооксигеназной системы печени.
Цель исследования – оценка особенностей течения экспериментального сахарного диабета у крыс с разным фенотипом по показателям функциональной активности детоксикации в печени.
Материалы и методы исследования
Опыты проведены на 110 белых крысах-самцах согласно руководству «Guide for the Care and Use of Laboratory Animals: Eighth Edition National Research Council» [6]. Протокол опытов рассмотрен и был одобрен Этическим комитетом МЗ РУз (№ 7/26-1053а от 18.10.2024).
Главным методом определения активности печеночной цитохром Р-450 зависимой монооксигеназной системы является фенотипирование в условиях in vivo [7, с. 302]. Фенотипирование экспериментальных животных по активности монооксигеназной системы печени проводили на основании нембуталового теста. Животным нембутал вводился внутрибрюшинно в дозе 40 мг/кг массы тела. Время наркотического сна рассчитывалось в минутах, и на основании результатов крысы были разделены на три группы – быстрые, средние и медленные метаболизеры.
Через две недели после нембуталового теста у животных моделировался сахарный диабет. За день до начала моделирования диабета крысам вводился 4 %-ный раствор аскорбиновой кислоты. Это способствует большей выживаемости крыс при развитии у них гипергликемии [8]. Для моделирования сахарного диабета животным однократно вводился аллоксан моногидрат (Sigma, США) в дозе 150 мг/кг в 0,4 мл цитратного буфера.
Анатомо-физиологические показатели и показатели углеводного обмена изучались до (контроль) и на 7, 14 и 21-е сутки (опыт) введения аллоксана. Вес экспериментальных животных определялся на автоматических весах фирмы HERMES high technology (Ганновер, ФРГ) (максимальный вес 1200 г). Для определения потребления корма и воды экспериментальными животными каждая крыса содержалась в отдельной клетке, количество корма и воды измерялось на порционных весах CAS SWN (США) до и через 24 ч после того, как крыса помещалась в клетку. Расход корма и воды рассчитывался на 100 г веса крысы за 1 ч их употребления и результаты были выражены в мг*ч/100 г и мкл*ч/100 г соответственно. Для оценки диуреза крысам в желудок вводилась вода в объеме равном 2 % их веса. Далее для сбора мочи животные содержались в метаболических клетках в течение 4 часов. Результаты выражались в мл*4 ч/100 г массы тела.
Кровь у крыс до и в выбранные сроки опыта бралась из хвостовой вены с помощью иглы размером G-24 [9] и собиралась в пробирки с гепарином. Для получения плазмы кровь центрифугировалась в центрифуге EBA 200 (компания Hettich) со скоростью 3000 об./мин в течение 15 мин.
В плазме крови содержание глюкозы определялось с помощью реагентов Human (ФРГ) на автоматическом анализаторе Humastar 100. Содержание инсулина и С-пептида определялось с помощью реагентов Rat Insulin, ELISA Kit и Rat C-Peptide ELISA Kit (США) на иммуноферментном анализаторе Mindray MR 96A (КНР). На 21-е сутки у подопытных крыс был проведен тест на толерантность к глюкозе (ТТГ). Для этого у крыс вечером отбирался корм, утром бралась кровь и с помощью атравматичного зонда вводился в желудок 20 % раствор глюкозы в разовой дозе 2 мл/кг. Затем у животных снова бралась кровь через 30, 60, 90 и 120 мин. Содержание глюкозы в пробах определялось вышеуказанным способом, и на основании результатов строилась кривая «концентрация глюкозы – время» и рассчитывалась площадь под этой кривой. Содержание гликогена в печени определялось с помощью антронового реактива также на 21-е сутки опыта.
Числовые результаты статистически обрабатывались на персональном компьютере с использованием пакета прикладных программ для статистического анализа в Excel. Различия в числах между разными группами считались статистически достоверными при Р < 0,05.
Результаты исследования и их обсуждение
Результаты показали, что продолжительность наркотического сна у крыс общей популяции варьирует от 76 до 418 мин (рис. 1, а). При этом продолжительность сна общей популяции крыс составила 216,36±16,67 мин. Анализ гистограммы результатов позволил разделить общую популяцию на три группы: быстрые метаболизеры (продолжительность сна – 76–98 мин, среднее значение – 91,11±2,35 мин), средние метаболизеры (продолжительность сна – 110–150 мин, среднее значение – 130,29±3,80 мин) и медленные метаболизеры (продолжительность сна – 183–418 мин, среднее значение – 313,54±15,10 мин) (рис. 1, б). Различия между группами оказались статистически значимыми (Р < 0,001) (рис. 2).
Обычно при моделировании диабета в эксперименте путем введения аллоксана смертность среди подопытных животных составляет от 30 до 60 % [10]. Расчет уровня смертности в общей популяции крыс на 21-е сутки опыта показал, что она составляет 39 % (рис. 3). Однако между различными группами наблюдались сильные различия в уровне смертности: у крыс с быстрым метаболизмом смертность составила 60 %, а у крыс в группах со средним и медленным метаболизмом – 32 и 25 % соответственно.
У крыс при аллоксановом диабете снижение массы тела в динамике имело некоторые особенности между различными фенотипами по детоксикационной способности.
Так, у крыс с быстрым метаболизмом, в отличие от крыс со средним и медленным метаболизмом, наблюдалось более интенсивное его снижение (табл. 1). На 21-й день диабета животные с быстрым, средним и медленным метаболизмом имели вес на 21,8; 16,9 и 13,6 % ниже исходного уровня, соответственно. Результаты экспериментов показывают, что потеря веса у животных с быстрым метаболизмом при аллоксановом диабете более выраженная, чем у животных со средним и особенно медленным метаболизмом.
При изучении потребления корма при аллоксановом диабете у крыс с быстрым, средним и медленным метаболизмом уже на 7-й день опыта наблюдалось резкое увеличение показателей во всех группах по сравнению с исходными значениями (табл. 1).

Рис. 1. Гистограмма продолжительности нембуталового сна (в мин) (а) и распределение по отдельным группам (б) в общей популяции испытуемых крыс, ось ординат – продолжительность нембуталового сна, мин
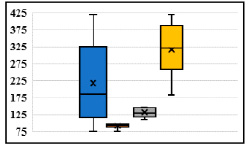
Рис. 2. Статистика отдельных групп общей популяции экспериментальных животных по продолжительности нембуталового сна (ящик с усами): ось ординаты – мин; синий – общая популяция; коричневый – быстрые метаболизеры; серый – средние метаболизеры; желтый – медленные метаболизеры; усы ящика – верхняя и нижняя границы, верхняя и нижняя границы ящика – верхний и нижний квартили, линия внутри ящика – медиана, X – средняя величина

Рис. 3. Уровень смертности при аллоксановом диабете у крыс с различными фенотипами по детоксикационной способности печени, кривая – линия тренда
Таблица 1
Некоторые анатомо-физиологические индикаторы развития аллоксанового диабета у крыс с разным фенотипом по активности метаболизирующей функции печени
|
Показатели |
Фенотип |
Периоды опыта |
|||
|
Исходное |
7-е сутки |
14-е сутки |
21-е сутки |
||
|
Вес, г |
Быстрый |
217±7,98 |
203,4±6,48 |
186,8±5,89* |
169,65±6,55* |
|
Средний |
221,7±12,35 |
213,14±11,59 |
200,14±10,88 |
184,14±10,01* |
|
|
Медленный |
232,2±9,36 |
222,38±8,72 |
213,5±8,39а |
200,7±7,89*,а |
|
|
Потребление корма, мг*ч/100 г |
Быстрый |
331,09±21,84 |
607,54±42,80* |
713,9±49,66* |
853,13±76,74* |
|
Средний |
336,97±20,55 |
533,71±37,77* |
602,27±42,73* |
697,48±49,50* |
|
|
Медленный |
332,75±20,06 |
487,29±31,47*,а |
527,61±34,23*,а |
585,58±37,96*,а |
|
|
Потребление воды, мкл*ч/100 г |
Быстрый |
454,10±51,34 |
804,96±78,30* |
950,76±91,05* |
1163,15±141,44* |
|
Средний |
438,62±42,25 |
703,33±69,57* |
797,9±79,21* |
926,69±91,90* |
|
|
Медленный |
438,64±42,23 |
646,55±58,14*,а |
702,93±63,34*,а |
783,14±70,57*,а |
|
|
Диурез, мл*4 ч/100 г |
Быстрый |
1,28±0,17 |
2,62±0,39* |
3,09±0,46* |
3,80±0,72* |
|
Средний |
1,20±0,09 |
2,25±0,18* |
2,56±0,20* |
2,97±0,23* |
|
|
Медленный |
1,21±0,09 |
2,02±0,15* |
2,19±0,16* |
2,45±0,18* |
|
Примечание. * – Р < 0,05 по сравнению с исходным показателем, а – Р < 0,05 по сравнению с показателем быстрых метаболизеров.
При этом показатели быстрых, средних и медленных метаболизеров были соответственно на 83,5; 58,4 и 46,4 % выше, чем в исходных условиях. В оставшиеся дни эксперимента также наблюдалось увеличение потребления корма: на 14-й день аллоксанового диабета показатели быстрых, средних и медленных метаболизеров были выше исходных показателей на 115,6; 78,7 и 58,6 % соответственно, а на 21-й – на 157,7; 107,0 и 76,0 % соответственно. Следовательно, результаты свидетельствуют о том, что потребление корма животными с быстрым метаболизмом при аллоксановом диабете значительно выше по сравнению с животными со средним и особенно медленным метаболизмом.
При изучении потребления воды в условиях аллоксанового диабета у крыс с быстрым, средним и медленным метаболизмом замечено, что показатели всех групп резко увеличиваются по сравнению с исходными показателями уже на 7-й день опыта (табл. 1). При этом показатели быстрых, средних и медленных метаболизеров были соответственно на 77,3; 60,4 и 47,4 % выше, чем в начале опыта. В оставшиеся дни также наблюдалось увеличение потребления воды. Например, на 14-й день аллоксанового диабета показатели быстрых, средних и медленных метаболизеров были выше, чем исходные показатели, на 109,4; 81,9 и 60,3 % соответственно, а на 21-й – на 156,1; 111,3 и 78,5 % соответственно.
Результаты экспериментов показывают, что потребление воды животными с быстрым метаболизмом при аллоксановом диабете значительно выше по сравнению с животными со средним и особенно медленным метаболизмом.
При изучении диуреза при аллоксановом диабете у крыс с быстрым, средним и медленным метаболизмом показатели всех групп в 1,5–2 раза превышали исходные показатели на 7-й день опыта (табл. 1). При этом показатели крыс с быстрым, средним и медленным метаболизмом были соответственно на 104,7; 87,5 и 66,9 % выше, чем исходные показатели на 7-й день опыта. На 14-й день опыта показатели крыс с быстрым, средним и медленным метаболизмом были на 141,4; 113,3 и 81,0 % соответственно выше исходных показателей, а на 21-й – на 196,9; 147,5 и 102,5 % соответственно.
Результаты показали, что диурез у животных с быстрым метаболизмом при аллоксановом диабете значительно выше по сравнению с животными со средним и особенно медленным метаболизмом. При этом разница между животными с быстрым и медленным метаболизмом была почти в 2 раза.
Таким образом, полученные результаты показали, что у крыс с быстрым метаболизмом в динамике аллоксанового диабета снижение массы тела, повышение потребления корма и воды, а также падение скорости диуреза значительно выше, чем у крыс с умеренным и медленным метаболизмом. Выявленные при этом различия оказались статистически значимыми, и они свидетельствуют о том, что тяжесть сахарного диабета в некоторой степени зависима от функционально-метаболического состояния организма, включая исходное метаболическое состояние печени.
Величины показателей углеводного обмена крыс, различающихся по функциональной активности детоксикации в печени, представлены в табл. 2. Результаты показали, что при аллоксановом диабете уровень глюкозы в крови у крыс с быстрым метаболизмом на 7-й день эксперимента был на 149,7 % выше исходного уровня (табл. 2). При этом у животных со средним и медленным метаболизмом этот показатель был на 120,5 и 122,9 % выше исходного показателя соответственно. На 14-й день диабета уровни глюкозы в крови у крыс с быстрым, средним и медленным метаболизмом были на 186,8; 149,3 и 140,7 % соответственно выше исходных показателей. И, наконец, на 21-й день диабета уровни глюкозы в крови у крыс с быстрым, средним и медленным метаболизмом были на 270,5; 188,0 и 176,2 % соответственно выше исходных показателей.
Таблица 2
Показатели углеводного обмена при аллоксановом диабете у крыс с разным фенотипом по активности метаболизирующей функции печени
|
Показатели |
Фенотип |
Периоды опыта |
|||
|
исходное |
7-е сутки |
14-е сутки |
21-е сутки |
||
|
Глюкоза, ммоль/л |
Быстрый |
3,42±0,12 |
8,54±0,40* |
9,81±0,27* |
12,67±0,45* |
|
Средний |
3,51±0,20 |
7,74±0,24* |
8,75±0,27*,а |
10,11±0,26*,а |
|
|
Медленный |
3,32±0,18 |
7,40±0,21*,а |
7,99±0,24*,а,б |
9,17±0,19*,а,б |
|
|
Гликоген, мг/100 г ткани |
Быстрый |
716,30±10,37 |
– |
– |
283,05±10,04* |
|
Средний |
735,22±9,79 |
– |
– |
313,97±8,54*,а |
|
|
Медленный |
694,64±11,35б |
– |
– |
395,58±8,80*,а,б |
|
|
Инсулин, pg/ml |
Быстрый |
82,1±6,95 |
37,50±2,09* |
26,80±1,73* |
22,33±1,44* |
|
Средний |
71,65±6,67 |
42,05±1,57* |
34,58±1,29*,а |
28,81±1,08*,а |
|
|
Медленный |
82,55±8,41 |
47,38±2,20*,а |
37,08±0,92*,а |
30,90±0,77*,а |
|
|
С-пептид, ng/ml |
Быстрый |
2,85±0,27 |
2,32±0,13* |
1,41±0,09* |
1,18±0,08* |
|
Средний |
2,65±0,36 |
2,38±0,06* |
1,99±0,09*,а |
1,66±0,08*,а |
|
|
Медленный |
2,93±0,40 |
2,60±0,06*,а,б |
2,08±0,08*,а |
1,73±0,07*,а |
|
Примечание. * – Р < 0,05 по сравнению с исходным показателем, а – Р < 0,05 по сравнению с показателем быстрых метаболизеров, б – Р < 0,05 по сравнению с показателем средних метаболизеров.
Результаты свидетельствуют о том, что уровень глюкозы в крови у животных с быстрым метаболизмом при аллоксановом диабете выше, чем у животных со средним и особенно медленным метаболизмом.
Результаты изучения количества гликогена в печени экспериментальных животных показали, что на 21-й день заболевания во всех группах наблюдается снижение его уровня. При этом у быстрых, средних и медленных метаболизеров уровень гликогена в печени был на 60,5; 57,3 и 43,1 % соответственно ниже исходных показателей (табл. 2). Содержание гликогена в печени крыс со средним уровнем метаболизма было статистически значимо на 10,9 % выше, чем у крыс с быстрым метаболизмом. А содержание гликогена в печени крыс с медленным метаболизмом было статистически значимо выше, чем у крыс с быстрым и средним метаболизмом, на 39,8 и 26,0 % соответственно. Результаты свидетельствует о том, что скорость распада гликогена у крыс с медленным метаболизмом при сахарном диабете значительно ниже, чем у крыс с быстрым и средним метаболизмом.
Исследование уровня инсулина в крови крыс с быстрым метаболизмом показало, что он был на 54,3; 67,4 и 72,8 % ниже исходного уровня на 7, 14 и 21-е дни аллоксанового диабета соответственно (табл. 2). У средних метаболизеров этот показатель был ниже исходного на 41,3; 51,7 и 59,8 % соответственно срокам исследования. Наконец, содержание инсулина в крови у медленных метаболизеров было на 42,6; 55,1 и 62,6 % ниже исходного показателя соответственно. Результаты показывают, что при аллоксановом диабете уровень инсулина в крови животных с быстрым метаболизмом значительно ниже по сравнению с показателями средних и особенно медленных метаболизеров.
В крови крыс с быстрым метаболизмом уровень С-пептида оказался ниже исходного уровня на 18,6; 50,3 и 58,6 % соответственно на 7, 14 и 21-е дни аллоксанового диабета (табл. 2). У средних метаболизеров этот показатель был ниже исходного на 10,2; 24,9 и 37,4 % соответственно дням исследования. Наконец, содержание С-пептида в крови у медленных метаболизеров было на 11,3; 29,0 и 41,0 % ниже исходного показателя на 7, 14 и 21-е сутки аллоксанового диабета соответственно. Результаты показали, что содержание С-пептида в крови животных с быстрым метаболизмом при аллоксановом диабете значительно ниже по сравнению с показателями животными со средним и особенно медленным метаболизмом.
На 21-й день эксперимента была изучена толерантность к глюкозе у крыс с разными фенотипами. Результаты показали, что чувствительность к инсулину у подопытных животных значительно снижена. Эта закономерность наблюдалась у крыс как с быстрым (рис. 4, а), так и со средним (рис. 4, б) и медленным (рис. 4, в) метаболизмом.
Для сравнения результатов в цифровом формате была рассчитана площадь под кривой уровня глюкозы. Результаты показали, что на 21-й день опыта площадь под кривой «концентрация глюкозы – время» у животных с аллоксановым диабетом была выше на 51,1; 50,6 и 48,5 % исходного показателя у крыс с быстрым, средним и медленным метаболизмом соответственно (рис. 5).
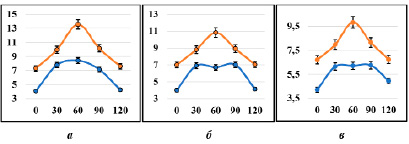
Рис. 4. Тест на толерантность к глюкозе при аллоксановом диабете у крыс с различными фенотипами по активности микросомальных оксидаз: а – крысы с быстрым метаболизмом, б – крысы со средним метаболизмом, в – крысы с медленным метаболизмом, красная кривая – животные с аллоксановым диабетом на 21-й день, синяя кривая – показатель интактных животных, ось ординат – концентрация глюкозы, ммоль/л, ось абсцисс – время, мин
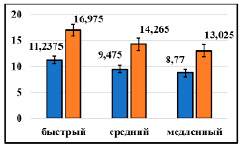
Рис. 5. Значения площадей под кривой «концентрация глюкозы – время» при аллоксановом диабете у животных с различными фенотипами по активности микросомальных оксидаз: синий столбик – исходный показатель, оранжевый столбик – 21-й день эксперимента, линия ординат – ммоль*ч/л
Заключение
Таким образом, полученные результаты свидетельствуют о том, что существуют определенные различия в анатомо-физиологических показателях и показателях углеводного обмена организма крыс в зависимости от интенсивности у них детоксикационной функции печени. Результаты показали, что при аллоксановом диабете крысы с быстрым метаболизмом теряют вес быстрее по сравнению с крысами со средним и особенно медленным метаболизмом, потребляя больше пищи и воды, а также у них наблюдается более сильный диурез. При аллоксановом диабете именно у этой группы крыс изменения в углеводном обмене были более выраженными, чем в других группах. При моделировании сахарного диабета введением аллоксана смертность у быстрых метаболизеров была в 1,88 и 2,40 раза выше, чем у средних и медленных метаболизеров соответственно. Результаты показывают, что у крыс с быстрым метаболизмом сахарный диабет протекает тяжелее, чем у крыс со средним и медленным метаболизмом.
Библиографическая ссылка
Юлдашев Н.М., Мамазулунов Н.Х., Хабибуллаев С.М. ОСОБЕННОСТИ РАЗВИТИЯ ЭКСПЕРИМЕНТАЛЬНОГО ДИАБЕТА У КРЫС С РАЗНЫМ ФЕНОТИПОМ ПО АКТИВНОСТИ МИКРОСОМАЛЬНЫХ ОКСИДАЗ // Научное обозрение. Биологические науки. 2025. № 2. С. 51-57;URL: https://science-biology.ru/ru/article/view?id=1406 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1406


 science-review.ru
science-review.ru