Введение
Тетрахлорметан (CCl4) образует гепатотоксичные метаболиты с участием фермента CYP2E1, что приводит к развитию как острых, так и хронических заболеваний печени [1]. В последнее время для изучения гепатопротекторных свойств часто используют растительные дубильные вещества в условиях токсического гепатита (ТГ). Показано, что среди биологически активных веществ танины обладают высокой гепатопротекторной активностью [2]. Обычно при гепатитах, особенно при ТГ, определяют и изучают количество ферментов аланинаминотрансферазы (АЛТ) и аспартатаминотрансферазы (АСТ) в сыворотке крови [3], поскольку повышение этих ферментов является основным признаком гепатита. В некоторых литературных источниках сообщается, что в условиях ТГ активности неспецифической Са2+-зависимой поры (mitochondrial permeability transition pore – mPTP) и АТФ-зависимого калиевого канала (митоКАТФ-канал) [4; 5], локализованные во внутренней мембране митохондрий печени, сильно изменяются .
Цель исследования – изучить влияние гидролизуемых танинов растения Pistacia vera L. на активность ферментов АЛТ и АСТ в сыворотке крови, а также на состояние mPTP и митоКАТФ-канала митохондрий печени крыс.
Материалы и методы исследования
Гексагаллоил-глюкоза (ГексаГГ) и гептагаллоил-глюкоза (ГептаГГ), которые относятся к группе гидролизуемых танинов, были выделены из листьев Pistacia vera L., их чистота составила более 90 %.
У экспериментальных животных ТГ вызывали с использованием небольших модификаций метода Е.С. Шилкиной [6]. При этом ТГ у экспериментальных животных вызывали путем подкожного введения в брюшную полость 0,5 мл/кг раствора CCl4 один раз в сутки в течение трех дней, а не один раз в четыре дня как у Е.С. Шилкиной. Исследования проводились в шести группах, а именно:
группа I – интактный контроль,
группа II – ТГ-контроль,
группа III – ТГ + ГексаГГ (10 мг/кг),
группа IV – ТГ + ГексаГГ (30 мг/кг),
группа V – ТГ + ГептаГГ (10 мг/кг)
и группа VI – ТГ + ГептаГГ (30 мг/кг). Также проводилась фармакокоррекция ТГ у животных путем перорального введения танинов в течение восьми дней. Все процедуры, проводимые с животными, соответствуют требованиям Декларации Совета Европейского союза 86/609/EEC и протокола по биоэтике Института биофизики и биохимии при Национальном университете Узбекистана с № BRC/IBB-N44/2024/75-1. Лабораторные животные, использованные в исследованиях, были утилизированы службой биологической утилизации отходов.
Исследование проводили на белых беспородных крысах массой 180–200 г. Митохондрии из печени крыс выделяли по методу дифференциального центрифугирования [7]. Среда выделения содержала 250 мМ сахарозу, 1 мМ ЭДТА, 10мМ трис-HCl, pH 7,4. На первом этапе центрифугирование проводили на угловом роторе в центрифуге РС-6МЦ при скорости 1500 об/мин в течение 7–8 мин. На втором этапе центрифугирование проводили в течение 15 мин при скорости 6000 об/мин. Митохондрии суспендировали в среде выделения без ЭДТА в соотношении 10:1. Во время эксперимента суспензия митохондрий хранилась в ледяной бане. Белок определяли по методу биурета с использованием бычьего сывороточного альбумина в качестве стандарта.
Уровни АСТ и АЛТ в сыворотке крови определяли с помощью тест-набора Cypress Diagnostica (Бельгия) с целью оценки гепатопротекторной активности у крыс с экспериментальной моделью ТГ, получавших танины. У животных брали кровь, центрифугировали при 3000 об/мин в течение 12 мин, отделяли сыворотку крови и исследовали биохимические показатели [3].
Анализ состояния mPTP проводился с помощью оценки скорости Ca2+-зависимого набухания митохондрий путем регистрации светорассеяния митохондриальной суспензии при 540 нм [8]. Инкубационная среда следующая: сахароза – 200 ммоль, KH2PO4 – 1 ммоль, сукцинат – 5 ммоль, ЭГТА – 20 мкмоль, HEPES – 20 ммоль, трис-HCl – 20 ммоль, ротенон – 2 мкмоль, pH – 7,2 и белок митохондрий 0,3 – 0,4 мг/мл.
Активность митоКAТФ-канала в митохондриях измеряли по динамике изменения оптической плотности на длине волны 540 нм. Содержание белка митохондрий в среде составило 0,3–0,4 мг/мл. Инкубационная среда была следующей: 125 мМ KCl, 10 мМ Hepes, 5 мМ сукцинaт, 1 мМ MgCl2, 2,5 мМ K2HPO4, 2,5 мМ KH2PO4, 0,005 мМ ротенон и 0,001 мМ олигомицин, рН 7,4.
Статистическую обработку полученных результатов проводили с помощью программы Origin 6.1 с вычислением средней арифметической величины (М), стандартной ошибки (m) и показателя достоверности (р) с использованием t-теста Стьюдента. Величину р < 0,05 рассматривали как показатель статистически значимых различий.
Результаты исследования и их обсуждение
Дисфункция митохондрий является одним из основных механизмов, приводящих к патологии печени.
В условиях ТГ цитохромы CYP2E1, CYPB1, CYP32, а также CYP3A превращают CCl4 в трихлорметильный радикал CCl3*. Этот радикал реагирует с кислородом, образуя трихлорметилпероксирадикал CCl3OO*, который атакует и расщепляет полиненасыщенные жирные кислоты, инициируя цепную реакцию перекисного окисления липидов (ПОЛ) [9]. Известно, что в условиях ТГ в организме развиваются основные патогенные механизмы, вызывающие функциональные и органические изменения в печени: воспаление, дисфункция цитохрома P450 и окислительный стресс [10]. Также было показано, что ТГ вызывает увеличение количества H2O2 и МДА в митохондриях, уменьшая количество глутатиона и активность Mn-СОД [11].
Известно, что при заболеваниях ТГ повышается активность ферментов АЛТ и АСТ в крови. По полученным результатам представлены экспериментальные данные по влиянию дубильных веществ ГексаГГ и ГептаГГ на активность ферментов АЛТ и АСТ в сыворотке крови крыс с ТГ (таблица).
При коррекции ТГ исследуемыми танинами наблюдалось значительное снижение активностей сывороточных ферментов крови АЛТ и АСТ.
В экспериментах активность АЛТ и АСТ в сыворотке крови интактных крыс (группа I) составила 32,6±1,5 и 44,6±1,1 ед/мл. У лабораторных животных с ТГ (группа II) активность АЛТ составила 126,2±4,7 ед/мл, а АСТ – 142,6±4,3 ед/мл. У животных с ТГ активность ферментов АЛТ и АСТ увеличилась в 3,9 и 3,2 раза соответственно по сравнению с интактной группой. У лабораторных животных III группы активность АЛТ в сыворотке крови составила 90,3±3 ед/мл, что в 1,4 раза ниже, а уровень АСТ – 97,5±2,4 ед/мл, что в 1,5 раза ниже, чем у животных II группы. В IV группе активность АЛТ составила 62,5±4 ед/мл, то есть снизилась в 2 раза, а уровень АСТ составил 75,3±1,1 ед/мл, снизился в 1,9 раза. В последующих экспериментах определялась активность АЛТ и АСТ в крови V и VI групп лабораторных животных. У животных V группы активность АЛТ составила 88,4±1,6 ед/мл, что в 1,4 раза ниже, чем в II группе, а уровень АСТ – 96,7±1,5 ед/мл, что в 1,5 раза ниже. У животных VI группы обнаружилось, что активность АЛТ составила 55,1±1,4 ед/мл, снизилась в 2,3 раза, а активность АСТ снизилась в 1,7 раза (82,5±2,5 ед/мл).
Таким образом, танины ГексаГГ и ГептаГГ, выделенные из Pistacia vera L., снижают активность ферментов АЛТ и АСТ в крови экспериментальных животных с ТГ.
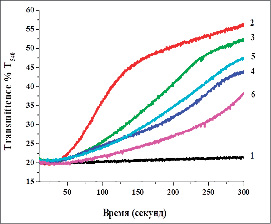
В последующих экспериментах было изучено состояние PTP митохондрий печени крыс в условиях ТГ и фармакотерапии с танинами (рис. 1).
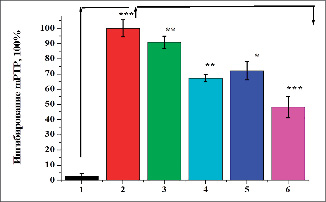
В условиях ТГ было обнаружено резкое увеличение проницаемости PTP в митохондриях печени. Это патологическое состояние, которое приводит к образованию АФК и усилению процесса ЛПО в мембранах митохондрий. В условиях ТГ танины ГексаГГ и ГептаГГ в дозах 10 и 30 мг/кг корригировали дисфункцию митохондрий печени. Согласно этим исследованиям, у животных III группы открытие PTP митохондрий печени ингибировалось на 9,2±1,9 %, у животных IV группы – на 32,9±2,4 %, у животных V группы – на 27,8±3,7 % и у VI группы животных – на 51,9±5,2 %. Это свидетельствует о том, что танины ГексаГГ и ГептаГГ ингибируют открытие PTP митохондрий и корригируют нарушения митохондриальной функции в условиях ТГ.
Из результатов эксперимента можно понять, что увеличение отека митохондрий при патологических состояниях напрямую связано с переходом РТР в открытое состяние. Таким образом, танины ГексаГГ и ГептаГГ могут ингибировать проницаемость PTP в митохондриях печени в условиях ТГ, тем самым переводя mPTP в закрытое состояние.
Влияние ГексаГГ и ГептаГГ на активность ферментов АЛТ и АСТ в сыворотке крови крыс в модели ТГ (Ед/мл) (**– р < 0,01; *** – р < 0,001; n = 5)
|
№ |
Группы |
АЛТ (Eд/мл) |
АСТ (Ед/мл) |
|
1 |
I группа – интактный контроль |
32,6±1,5 |
44,6±1,1 |
|
2 |
II группа – ТГ-контроль |
126,2±4,7*** |
142,6±4,3*** |
|
3 |
III группа – ТГ + ГексаГГ (10 мг/кг) |
90,3±3*** |
97,5±2,4** |
|
4 |
IV группа – ТГ + ГексаГГ (30 мг/кг) |
62,5±4*** |
75,3±1,1*** |
|
5 |
V группа – ТГ + ГептаГГ (10 мг/кг) |
88,4±1,6*** |
96,7±1,5** |
|
6 |
VI группа – ТГ + ГептаГГ (30 мг/кг) |
55,1±1,4*** |
82,5±2,5*** |
|
А |
|
Б |
Рис. 1. Влияние танинов ГексаГГ и ГептаГГ на состояние PTP митохондрий печени при ТГ: А – оригинальная запись; Б – статистически обработанные данные: 1) интактный контроль; 2) ТГ – контроль; 3) ТГ + ГексаГГ (10 мг/кг); 4) ТГ + ГексаГГ (30 мг/кг); 5) ТГ + ГептаГГ (10 мг/кг); 6) ТГ + ГептаГГ (30 мг/кг) (* – р < 0,05; ** – р < 0,01; *** – р < 0,001; n = 5)
Таким образом, танины ГексаГГ и ГептаГГ оказывают стабилизирующее действие на мембрану митохондрий печени крыс при ТГ и ингибируют открытие PTP, что дает возможность использовать их в гепатопротекторных целях. Также полученные результаты, а именно коррекция нарушений проницаемости mРТР при интоксикации с CCl4 с растительными танинами, открывают новые молекулярные аспекты создания эффективных гепатопротекторов. Потому что митохондриальная РТР играет важную роль в физиологических и патологических процессах клеток. Проницаемость митохондрий переходит в высокопроницаемое состояние при различных патологиях, включая ТГ. При остром отравлении печени CCl4 также развиваются некроз, апоптоз, окислительный стресс и воспаление, приводящие к печеночной недостаточности [12].
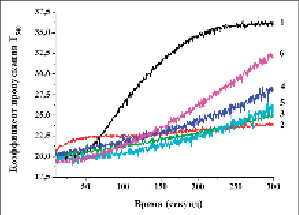
В последующих экспериментах in vivo также была исследована активность КАТФ каналов в митохондриях печени (рис. 2).
|
А |
|
Б |
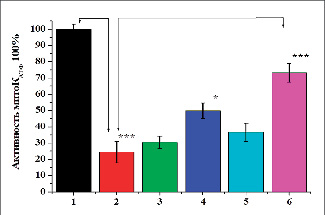
Рис. 2. Влияние ГексаГГ и ГептаГГ на митоКАТФ-канал митохондрий печени крыс при ТГ: А – оригинальная запись; Б – статистически обработанные данные: 1) интактный контроль; 2) ТГ – контроль; 3) ТГ + ГексаГГ (10 мг/кг); 4) ТГ + ГексаГГ (30 мг/кг); 5) ТГ + ГептаГГ (10 мг/кг); 6) ТГ + ГептаГГ (30 мг/кг) (* – р < 0,05; *** – р < 0,001; n = 5)
Полученные результаты показали, что в условиях патологии (II группа) митохондрии печени крыс набухали незначительно, что свидетельствует об ингибировании активности проницаемости печени крыс в условиях интоксикации. При этом ингибирование активности проницаемости митохондрии печени составило 75,6±6,5 %, по сравнению с животными I группы.
Проницаемость мембран митохондрий в печени крыс, получавших танины при ТГ, была выше, чем митохондрии печени крыс II группы. Так, доза 10 мг/кг танина ГексаГГ увеличивала проницаемость на 8,1±3,7 %, а доза 30 мг/кг – на 33,6±4,9 % по сравнению с крысами с ТГ. Дозы танина ГептаГГ 10 мг/кг и 30 мг/кг увеличивали проницаемость у крыс группы с TГ на 16,3±5,7 и 64,6±5,6 % соответственно. Это означает, что ГептаГГ действует на мембраны митохондрии более активно, чем ГексаГГ.
Таким образом, в результате интоксикации организма с CCl4 лабораторных животных открываются поры перехода проницаемости митохондрий. Длительное открытие mPTP приводит к гибели клетки. Однако имеются данные об ингибировании mPTP путем открытия митоКАТФ-канала [13]. МитоКАТФ-канал, расположенный во внутренней митохондриальной мембране, блокирует открытие mPTP, защищая клетку от гибели. В результате нарушение потока ионов через внешнюю и внутреннюю мембраны может привести к изменению окислительно-восстановительного состояния, мембранного потенциала и снижению биоэнергетической эффективности [14].
Заключение
После лечения ГексаГГ и ГептаГГ в дозах 10 и 30 мг/кг в условиях ТГ активность АЛТ и АСТ в крови сравнивали с показателями ТГ группы II. Согласно полученным результатам, активность АЛТ была снижена у животных VI группы, а активность АСТ – у животных IV группы, демонстрируя активность, близкую к таковой у животных I группы.
ГексаГГ и ГептаГГ при пероральном введении в дозе 30 мг/кг массы тела ингибировали переход митохондриальной проницаемости в печени крыс. Среди исследованных танинов было обнаружено, что группа VI способна стабилизировать митохондриальную мембрану.
В митохондриях печени крыс в условиях ТГ наблюдалось снижение проницаемости мембран для ионов К+. Однако было обнаружено, что танины ГексаГГ и ГептаГГ в дозе 30 мг/кг увеличивают проницаемость мембран митохондрий для ионов К+ по сравнению с группы II крыс. Среди исследованных танинов ГептаГГ в группе VI оказала наибольшее активирующее влияние на проницаемость для ионов К+.
Библиографическая ссылка
Абдулхакова Г.В., Комилов Э.Ж., Асраров М.И., Эргашев Н.А. ГЕПАТОПРОТЕКТОРНЫЕ СВОЙСТВА ТАНИНОВ ГЕКСАГАЛЛОИЛ-ГЛЮКОЗЫ И ГЕПТАГАЛЛОИЛ-ГЛЮКОЗЫ // Научное обозрение. Биологические науки. 2025. № 2. С. 58-63;URL: https://science-biology.ru/ru/article/view?id=1407 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1407


 science-review.ru
science-review.ru