Введение
Сахарный диабет (СД) – это хроническое метаболическое заболевание, развивающееся в результате нарушения секреции инсулина или его действия, влияющее на обмен углеводов, жиров и белков в организме. В последние годы широкое распространение данного заболевания в эпидемиологических масштабах представляет серьезную угрозу для здоровья человечества. По данным Всемирной организации здравоохранения, в 2021 г. количество больных диабетом достигло 537 млн чел., и этот показатель с каждым годом увеличивается. Согласно прогнозам, к 2045 г. это число может превысить 783 млн [1]. Основными факторами риска считаются неправильное питание, физическая неактивность, стрессовые состояния и наследственная предрасположенность. Сахарный диабет не ограничивается лишь нарушением метаболизма глюкозы, но также затрагивает липидный и белковый обмен, систему антиоксидантной защиты, глюконеогенез, гликогенолиз, окислительный стресс и воспалительные маркеры, нарушая множество метаболических путей. Это приводит к резкому нарушению гомеостаза, апоптозу клеток и развитию инсулинорезистентности. Указанные патофизиологические процессы вызывают снижение функции β-клеток поджелудочной железы и снижение чувствительности к инсулину в периферических тканях. Кроме того, сахарный диабет снижает синтез и накопление гликогена в печени, вызывает глюкозурию в почках, влияет на сердечно-сосудистую и центральную нервную системы, вызывая патологические изменения в их структуре и функции. Осложнения, связанные с диабетом, такие как ангиопатия, нефропатия, ретинопатия и невропатия, значительно снижают качество и продолжительность жизни пациентов. Развитие этих осложнений связано с повреждением эндотелиальных клеток, нарушением микроциркуляции и усилением окислительного стресса на фоне гипергликемии [2]. В связи с этим изучение уровня органических субстратов (таких как глюкоза, лактат, пировиноградная кислота и аминокислоты) и активности ферментов (таких как ALT, AST, КК, AP) в крови, а также определение их роли в патологическом процессе является важным направлением современной экспериментальной и клинической биологии.
Создание моделей диабета в лабораторных условиях предоставляет возможность более глубокого изучения патогенеза данного заболевания, а также его физиологических и биохимических механизмов. Одним из широко применяемых методов для этой цели является индукция экспериментального диабета с помощью аллоксана. Аллоксан – это производное мочевины, обладающее селективной токсичностью по отношению к β-клеткам, проникающее в них как аналог глюкозы и вызывающее образование большого количества активных форм кислорода. Это приводит к повреждению мембраны клеток, ДНК и белков, вызывая некроз клеток. Данная модель позволяет глубже понять патогенез сахарного диабета 1 типа, а также тестировать новые лечебные препараты. Кроме того, модель диабета, вызванного аллоксаном, позволяет анализировать компенсаторные реакции организма в условиях гипергликемии, включая изменения уровня стресс-гормонов (кортизол, адреналин), медиаторов воспаления и гормонов-антагонистов инсулина (глюкагон, соматотропин) [3]. С помощью модели диабета, вызванного аллоксаном, также возможно изучение митохондриальной дисфункции, нарушения энергетического баланса и сбоев в клеточных сигнальных путях. Это имеет важное значение для понимания молекулярных основ диабета и определения мишеней для новых лекарственных средств. Наряду с этим для ранней диагностики и эффективного лечения сахарного диабета важно оценивать метаболические показатели, определяющие его развитие, в частности уровень субстратов и активность ферментов в крови. Такой подход позволяет осуществлять индивидуальный контроль над заболеванием, мониторинг фармакологического воздействия и разработку стратегий диетотерапии.
Цель исследования – определить изменения активности некоторых органических субстратов и ферментов в сыворотке крови при аллоксановом диабете.
Материалы и методы исследования
Эксперименты проводились на половозрелых беспородных крысах-самцах массой тела 180–200 г. Животные содержались при естественном свето-темновом режиме, температуре воздуха 23,0±2,1°С и относительной влажности воздуха 50–70 % на стандартном рационе вивария при неограниченном доступе к воде и пище. Все экспериментальные работы выполнялись в соответствии с международными биоэтическими нормами проведения исследований на лабораторных животных.
Крысы были разделены случайным образом на две группы – контрольную и опытную. У крыс опытной группы вызывали диабет тремя внутрибрюшинными инъекциями аллоксана моногидрата (Sigma-Aldrich, США) в дозе 50 мг/кг каждые 24 ч в объеме 0,3 мл. Контрольной группе крыс вводили физиологический раствор в том же объеме и в то же время, что и опытной группе. Через 5–6 дней после введения аллоксана моногидрата у крыс определяли содержание глюкозы в крови. Для этого хвост крысы обрабатывали новокаином с целью обезболивания и осторожно его кончик надрезали острыми хирургическими ножницами. К полученной капле крови прикладывали тест-полоску, которая пропитывалась кровью. Интенсивность окрашивания содержащейся в тест полоске глюкозы крови, оксидоредуктазой глюкозы, согласно инструкции производителя, была пропорциональна концентрации моносахарида в крови. Окрашенная полоска переносилась в специальную ячейку глюкометра (ACCU-CHEK, Германия), в результате просвечивания которой на дисплее прибора отражалась концентрация глюкозы в сыворотке крови в ммоль/л. Только те крысы, уровень глюкозы у которых в крови был выше 15 ммоль/л считались диабетическими и были использованы в дальнейших исследованиях.
Кровь для биохимических анализов собирали при декапитации в гепаринизированные центрифужные пробирки. Кровь отстаивали в течение 30 мин при комнатной температуре и затем центрифугировали при 3000 об/мин в течение 10 мин на высокоскоростной микроцентрифуге D2012 PLUS (Китай). Сыворотку крови осторожно отсасывали и в ней определяли содержание глюкозы, холестерина, триглицеридов, общего белка, мочевины, а также активность α-амилазы (α-1,4-глюкан-4-глюканогидролаза), креатинфосфокиназы (креатин-N-фосфотрансфераза), аланинаминотрансферазы (L-аланин:2-оксоглутарат инотрансфераза), аспартатаминотрансферазы (L-аспартат:2-оксоглутаратминотрансфераза) и щелочной фосфатазы при помощи автоматического биохимического анализатора RT-904C Китай. Кроме того, в моче были определены содержание глюкозы и общего белка с использованием анализатора мочи URIT-50 (Китай). Полученные данные были обработаны при помощи статистической программы Origin Pro 8.6 с определением критерия Стьюдента (t) и определение показателя достоверности Р. Разница между показателями опытной и контрольных групп считалась достоверной при Р < 0,05.
Результаты исследования и их обсуждение
Данные по изменению содержания белка и глюкозы в сыворотке крови крыс представлены на рис. 1.
Как видно из рис. 1, содержание глюкозы у крыс опытной группы в сыворотке крови возрастало на 184,7 %, а содержание белка, напротив, не возрастало а уменьшалось на 18,7 %. В отличие от сыворотки крови содержание как глюкозы, так и белка в моче диабетических крыс статистически достоверно увеличивалось по сравнению с животными контрольной группы.
Разрушение β клеток островков Лангерганса поджелудочной железы аллоксаном моногидратом, естественно, снижая уровень секретируемого инсулина, приводило к повышению уровня глюкозы у диабетических крыс. Доказано, что инсулин является единственным гормоном, вызывающим снижение уровня глюкозы в крови путем утилизации его в гликоген печени [4]. Если уровень глюкозы у крыс с аллоксановым диабетом в сыворотке крови повышался, то уровень общего белка, напротив, заметно снижался в группе крыс с аллоксановым диабетом, по сравнению с контрольной группой (рис. 1). Изменение концентрации общего белка в плазме крови, скорее всего, обусловлено скоростью либо его катаболизма, либо анаболизма и, возможно, перераспределением белка среди тканей. У диабетических крыс на фоне уменьшения содержания белка, в моче его количество возрастало. Такая же тенденция была обнаружена в клинических исследованиях у больных сахарным диабетом, что авторы связывали с повреждением почечной ткани [5].
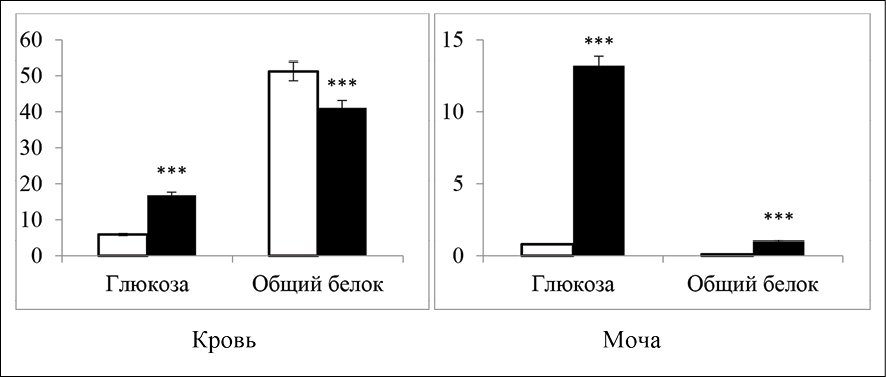
Рис. 1. Влияние аллоксанового диабета на содержание глюкозы и общего белка в крови и моче крыс (M±m, при n = 6); *** – P < 0,001
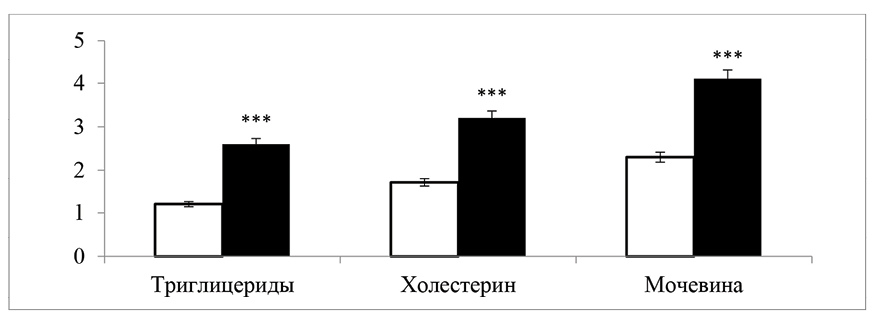
Рис. 2. Влияние аллоксанового диабета на содержание триглицеридов, холестерина и мочевины в сыворотке крови (M±m, при n = 6); *** – P < 0,001
В нормальных условиях фильтрационная система почек предотвращает проникновение крупных белковых молекул в мочу. Однако при диабете фильтрация из-за повреждения почечных клубочков нарушается, что вызывает протеинурию, то есть повышенное выделение белков с мочой. Этот процесс является одним из первых признаков развития диабетической нефропатии. Кроме того, снижение уровня белка в крови свидетельствует о развитии общих метаболических нарушений, связанных с уменьшением синтеза белка и его повышенной потерей. Уровень триглицеридов, холестерина и мочевины в сыворотке крови диабетических крыс представлен на рис. 2.
Как видно из рис. 2, у крыс с сахарным диабетом в сыворотке крови уровень триглицеридов возрастал на 116,7 %, содержание холестерина на 88,2 %, а уровень мочевины 78,2 % по сравнению с уровнем этих субстратов в крови у животных, которых инъецировали физиологическим раствором.
Эти данные подтверждают, что у диабетических крыс при отсутствии лечения избыточная глюкозная нагрузка способствует резкому нарушению липидного обмена, которое проявляется повышением уровня триглицеридов и холестерина в сыворотке крови. Действительно, было отмечено, что особенности липидного спектра при сахарном диабете характеризуются увеличением концентрации триглицеридов, снижением уровня холестерина липопротеинов высокой плотности и преобладанием в крови липопротеинов низкой плотности, то есть «плохого холестерина» [6]. Отмеченное увеличение общего холестерина в данном эксперименте явно связано с возрастанием содержания, скорее всего, «плохого» холестерина. Наряду с изменением липидного обмена, нарушается и белковый обмен, который в данных экспериментах проявляется не только в гипопротеинемии и протеиноурии (рис. 2), но и в увеличении концентрации мочевины – одного из конечных продуктов белкового распада в крови и маркера диабетической нефропатии [7].
Влияние аллоксанового диабета на активность некоторых ферментов в сыворотке крови крыс (M±m, при n = 6)
|
Фермент |
Контроль |
Опыт |
% по отношению к контролю |
P |
|
α-Амилаза |
140,2±12,1 |
99,1±7,7 |
70,7 |
< 0,01 |
|
Креатининкиназа |
188,4±10,4 |
245,2±12,8 |
130,1 |
< 0,01 |
|
Аланинаминотрансфераза |
120,1±9,2 |
235,2±19,4 |
195,8 |
< 0,001 |
|
Аспартатаминотрансфераза |
63,4±5,3 |
150,4±8,2 |
237,2 |
< 0,001 |
|
Щелочная фосфатаза |
70,4±6,4 |
140,1±7,7 |
199,0 |
< 0,001 |
Примечание: PP < 0,001 – достоверность различий при сравнении показателей экспериментальных групп с контрольными группами.
Изменения активности некоторых ферментов в сыворотке крови при аллоксановом диабете представлены в таблице. Активность всех определяемых ферментов у крыс с аллоксан-индуцированным диабетом статистически достоверно изменялась, что свидетельствует о выраженных метаболических нарушениях, сопровождающих развитие данного патологического состояния.
Так, активность α-амилазы у диабетических крыс уменьшалась на 29,3 %, что, вероятно, связано с угнетением синтеза фермента в ацинарных клетках поджелудочной железы вследствие деструкции β-клеток островков Лангерганса. Считаем, что уменьшение активности α-амилазы обусловлено замедлением темпов синтеза фермента, приводящим к уменьшению экскреции фермента в кровь. Этот процесс, вероятно, усиливается на фоне повреждения поджелудочной железы и дефицита ферментпродуцирующих клеток. Кроме того, при диабетической нефропатии α-амилаза в большем количестве выводится с мочой, что также приводит к снижению активности фермента в плазме крови. Следует подчеркнуть, что уменьшение активности α-амилазы в крови, отмеченное в данном наблюдении, при прогрессировании заболевания и развитии осложнений, может замениться возрастанием активности фермента, выявленным в других работах. Возрастание инкреции α-амилазы в гемоциркуляцию в таких случаях свидетельствует о том, что сахарный диабет может быть поводом или причиной нарушения экзокринной функции поджелудочной железы, способствуя развитию панкреатита [8, 9].
Активность креатинфосфокиназы возрастала на 30,1 %, что указывает на усиление катаболизма мышечных белков и нарушение энергообеспеченности клеток. Креатинфосфокиназа в основном присутствует в мышечной ткани и играет важную роль в энергетическом обмене. Увеличение активности креатинфосфокиназы у крыс с аллоксановым диабетом ассоциирует с дегенерацией мышечной ткани из-за нарушения метаболизма по причине дефицита инсулина. При повреждении мышечных клеток креатинфосфокиназа в большем количестве поступает в кровь. Эти данные предполагают, что при аллоксан-индуцированном диабете гликемический стресс негативно влияет на здоровье мышц [10].
Активность аланинаминотрансферазы увеличивалась на 95,8 %, а активность аспартатаминотрансферазы – на 137,2 %, что убедительно отражает глубокие деструктивные изменения в гепатоцитах, так как эти ферменты являются маркерами повреждения печени. Это связано с тем, что гипергликемия вызывает экссудативный стресс и воспаление печени, что способствует выходу аланинаминотрансферазы и аспартатаминотрансферазы в кровь
Активность щелочной фосфатазы увеличивалась на 99,0 %, что свидетельствует о возможном вовлечении в патологический процесс костной ткани или развитии осложнений, связанных с нарушением функции печени и желчевыводящих путей. Активное изучение взаимосвязи между сахарным диабетом и здоровьем костной ткани показало, что центральным звеном патогенеза развития повышенной ломкости костей у пациентов с сахарным диабетом 1 типа является нарушение активности и дифференцировки остеобластов [11].
Изменение активности ферментов при аллоксановом диабете в сыворотке крови крыс является сложным и многокомпонентным процессом, который зависит от стадии развития заболевания, состояния метаболических процессов, а также функционального статуса отдельных органов и тканей. Нарушения в углеводном, липидном и белковом обмене, вызванные инсулиновой недостаточностью, оказывают системное воздействие на органы и ферментные системы, способствуя развитию вторичных изменений. Очевидно, что аллоксановый диабет способен вызвать не только нарушение функции β-клеток островков Лангерганса поджелудочной железы, но и ряда висцеральных и соматических функциональных систем.
Заключение
Результаты данного исследования позволили подробно проанализировать метаболические изменения при экспериментальном диабете 1 типа, индуцированном аллоксаном. Они доказывают, что сахарный диабет и сопутствующая гипергликемия являются факторами, вызывающими осложнения во многих, если не во всех тканях и функциональных системах организма. Выявленное у диабетических крыс значительное увеличение уровня глюкозы и мочевины, триглицеридов и холестерина, активностей аланинаминотрансферазы, аспартатаминотрансферазы, креатинфосфокиназы и щелочной фосфотазы на фоне снижения уровня общего белка и активности α-амилазы в сыворотке крови способствует более широкому пониманию этиогенеза и патогенеза модели диабета и создает фундаментальную основу для разработки новых терапевтических стратегий. Эти метаболические изменения, скорее всего, и приводят к серьезным морфофункциональным сдвигам, лежащим в основе таких осложнений диабета, как нефропатия, ретинопатия, диабетическая стопа, стенокардия, инфаркт миокарда, полинейропатия и др. Кроме того, они подчеркивают важность контроля метаболических показателей у пациентов, страдающих диабетом.
Следовательно, глубокий анализ метаболических и физиологических механизмов сахарного диабета является одной из ключевых научно-исследовательских задач специалистов в области диабетологии, с целью предупреждения и своевременной коррекции этой опасной патологии и ее осложнений.
Библиографическая ссылка
Кучкарова Л.С., Ачилов Р.Х. НЕКОТОРЫЕ ПОКАЗАТЕЛИ КРОВИ ПРИ АЛЛОКСАНОВОМ ДИАБЕТЕ У КРЫС // Научное обозрение. Биологические науки. 2025. № 3. С. 27-32;URL: https://science-biology.ru/ru/article/view?id=1414 (дата обращения: 28.01.2026).
DOI: https://doi.org/10.17513/srbs.1414


 science-review.ru
science-review.ru