Введение
В современных биотехнологических и фармакологических разработках наблюдается устойчивый интерес к использованию природных источников биоактивных веществ, обладающих низкой токсичностью, высокой биологической активностью и доступностью. Одним из перспективных объектов являются дрожжи Saccharomyces cerevisiae, которые, помимо своей традиционной роли в пищевой промышленности, рассматриваются как источник низкомолекулярных полипептидов с потенциальными функциональными свойствами [1, 2].
Сухие дрожжи штамма S288C являются удобной моделью для получения полипептидных комплексов благодаря устойчивым культурологическим свойствам и генетической изученности [3]. На сегодняшний день недостаточно разработаны и стандартизированы методы получения целевых полипептидных фракций с высокой степенью чистоты и стабильным биохимическим профилем, что обуславливает актуальность настоящего исследования [4, 5].
Цель исследования – разработка и апробация оптимального метода выделения и очистки низкомолекулярных полипептидов из сухих дрожжей S288C с последующим анализом их аминокислотного состава и спектроскопических свойств для потенциального применения в биотехнологии и фармакологии.
Материалы и методы исследования
Объектом исследования являлись сухие дрожжи штамма S288C. Количественное определение белка проводилось спектрофотометрически с использованием реактива Несслера. Для экстракции использовали 0,2 % раствор NaOH при оптимизированном гидромодуле (1:5) и температуре 37 °C с последующей ультразвуковой обработкой (34 кГц, 5 мин). Очистка экстрактов проводилась методом фракционирования сульфатом аммония (20 и 80 %), гель-фильтрацией на сефадексе G25 и лиофильной сушкой. Характеризация полипептидов включала инфракрасную спектроскопию (ИК-спектральный анализ), электрофорез в 10 % полиакриламидном геле (ПААГ) и аминокислотное секвенирование методом высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хроматографа Agilent Technologies 1200.
Результаты исследования и их обсуждение
Определение содержания белка в исследуемых объектах проводили после предварительной минерализации пробы с серной кислотой с последующим определением белкового азота с реактивом Несслера. Для этого использовали прибор спектрофотометр, аналитические весы с точностью до 0,0001 г, фильтровальную бумагу, конические воронки, мерные колбы на 50 мл, натрий едкий, сегнетовую соль, реактив Несслера, дистиллированную воду, серную кислоту концентрированную, перекись водорода концентрированную. От подготовленных проб отбирали навески в термостойкие колбы, приливали концентрированную серную кислоту H2SO4 (ρ 1,84 г/см) и разлагали на песчаной бане или плитке, избегая бурного кипения. Окончанием процесса минерализации являлось получение абсолютно прозрачного бесцветного раствора. В подготовленных пробах определяли содержание белка колориметрическим методом с реактивом Несслера при длине волны 400 нм на спектрофотометре V-5000 Metash. Полученные результаты при двукратной повторности эксперимента представлены в табл. 1.
Таблица 1
Результаты анализа количественного содержания белка
|
Объект исследования |
Навеска, г |
Аликвот, мл |
400 нм |
Белок, % |
Азот, % |
|
Дрожжи |
0,287 |
0,2 |
0,578 |
44,8 |
7,16 |
Источник: составлено автором.

Рис. 1. Очищенные полипептиды штамма дрожжей S288C Источник: составлено автором
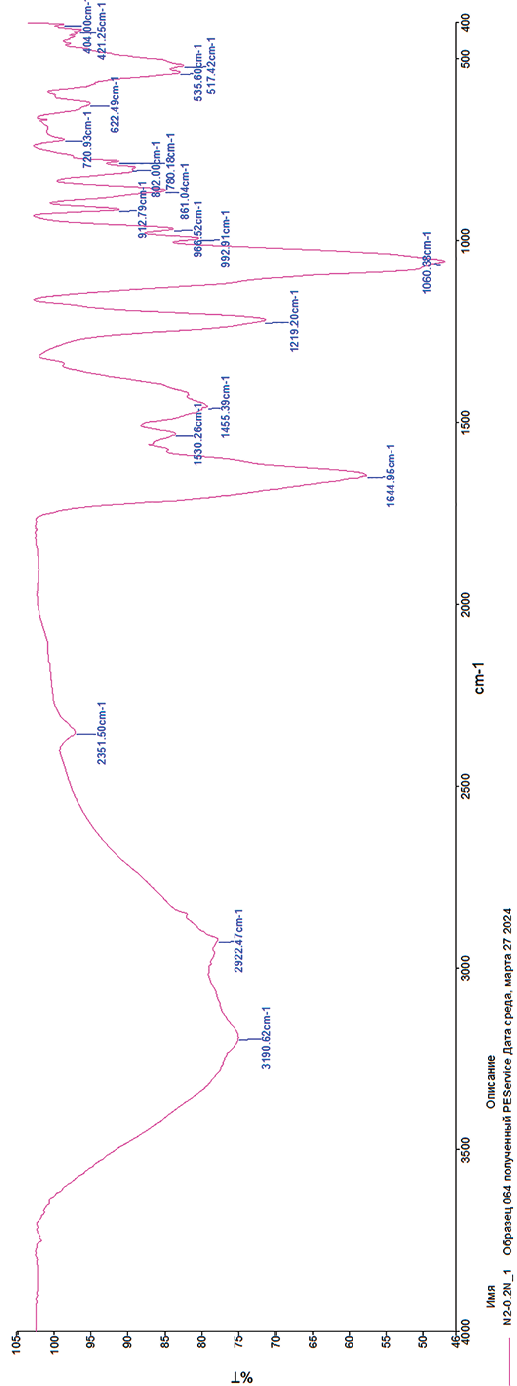
Рис. 2. Полипептид, полученный экстрагентом 0,2 N-ного NaOH Источник: составлено автором
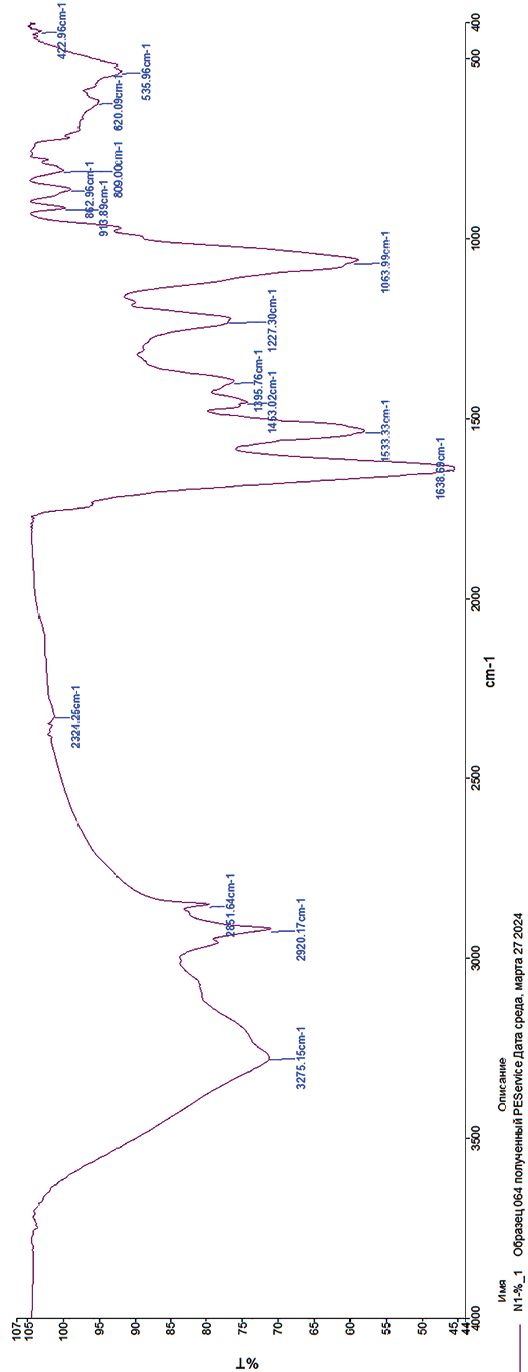
Рис. 3. Полипептид, полученный экстрагентом 0,2 %-ного NaOH Источник: составлено автором
Затем разрабатывались оптимальные условия для экстракции белков. Экстракцию проводили 0,05 трис HCl (pH 8,5), 2 % Na2CO3, 0,2 % NaOH [3]. Подбирали гидромодуль (1:5, 1:10, 1:15), и время проведения экстракции 60, 120, 180, 240 минут, для полного разрушения клеток гомогенат обрабатывали ультразвуком (частота колебаний) 34 кГц [6, 7].
Экстракцию проводили 0,2 % NaOH в течение 3 ч, 370 ºС, при гидромодуле 1:5, затем обработку ультразвуком в течение 5 мин, при которых обеспечивается максимальный выход белка. После экстракции проводили центрифугирование в течение 30 мин при 8000 об/мин. На следующем этапе очистки использовали фракционирование сухим сульфатом аммония. Для удаления высокомолекулярных белков использовали сульфат аммония при 20, 40, 60 %-ном осаждении. Результаты показали, что 20 %-ное высаливание экстракта сульфатом аммония является наиболее, оптимальным для удаления балластных (высокомолекулярных) белков.
Затем использовали сульфат аммония при 80 %-ном осаждении для получения низкомолекулярных полипептидов. Экстракт 80 %-ного осаждения центрифугировали и полученный осадок низкомолекулярных полипептидов обессоливали на колонке c сефадексом G25. Гель-фильтрацию на сефадексе G25 проводили со сбором элюата по 4 мл [8]. Концентрацию полученных обессоленных белковых фракций определяли на спектрофотометре Cary 60 (Германия) при длине волны 280 и 260 нм. Полученную обессоленную белковую фракцию собирали и лиофильно сушили при высоком вакууме (-870 С) на приборе CHRIST Alpha 2–4 LSCbasic (Германия). Выход очищенных полипептидов составил 5,7 % (рис. 1).
Для идентификации функциональных групп получен ИК-спектральный анализ для полипептидов. Геометрия исследуемых соединений построена с помощью программы MaSK и предварительно оптимизирована методом B3LYP1/6-31G (d,p). Расчеты проводили в пакете программ Firefly 8.0.1 ИК-спектры исследуемых полипептидов в таблетках с KBr записаны (4000–400 см-1) на ИК-Фурье-спектрофотометре System 2000 фирмы Perkin-Elmer. ИК-спектры выражены в виде зависимости частот от оптической плотности (Absorbance).
Результаты приведены на рис. 2 и 3.
ИК-спектр (KBr, vmax, sm-1): 31-96 (NH), 30-34 (CH3), 16-46 (S=O), 14-03 сигналов, характерных для ароматического кольца, 1240, 1049 (- C-O-C -), 704 линий поглощения, характерных для ароматического кольца (S-N), группы размером 602 см-1 (S-SH).
ИК-спектр (KBR, VMAX, SM-1): 3275 (NH), 2920, 2852 (CH2), 1639 (S=O), 1533, 1453 сигналы, специфичные для ароматических колец, 1396 (CH3), 1227, 1064 (- C-O-C -), 863, 809 (s-n), 620, 536 см-1 (s-sh, -c-S-C-) группы в ароматическом кольце, демонстрирующие характерные линии поглощения.
Характеристику очищенных полипептидов проводили с помощью электрофореза в 10 %-ном ПААГ [9]. В качестве маркеров использовали стандартный набор белков Novex™ Sharp pre-stained Protein Ladder (Invitrogen). Электрофорез проводили в денатурирующих условиях. Образцы наносились по 20 мкл в каждую лунку. Во время миграции образцов в концентрирующем геле (6 %) напряжение поддерживали на уровне 50 В. При перемещении фронта в разделяющем геле (10 %) напряжение повышали до 80 В. Электрофорез проводили до выхода бромфенолового синего из геля [10]. Гели окрашивали 0,25 %-ным раствором Coomassie G250 (Sigma, USA) в смеси вода : этанол : уксусная кислота : вода (1:1:2).
По данным электрофореза очищенные полипептиды имеют идентичный фракционный состав с молекулярной массой от 8 до 40 кДа.
Выделение свободных аминокислот. Осаждение белков и пептидов водного экстракта образов проводили в центрифужных стаканах. Для этого к 1 мл исследуемого образца добавляли по 1 мл (точный объем) 20 % ТХУК. Через 10 мин осадок отделяли центрифугированием при 8000 об/мин в течение 15 мин. Отделив 0,1 мл надосадочной жидкости, лиофильно высушивали. Гидролизат упаривали, сухой остаток растворяли в смеси триэтиламин – ацетонитрил – вода (1:7:1) и высушивали. Эту операцию повторяли дважды для нейтрализации кислоты. Реакцией с фенилтиоизоцианатом получали фенилтиокарбамил-производные (ФТК) аминокислот по методу A. Steven, Daviel Cohen [11]. Идентификацию производных аминокислот проводили методом ВЭЖХ [12]. Полученные результаты при двукратной повторности эксперимента представлены в табл. 2.
Проведенные исследования показали, что содержание общего белка в биомассе дрожжей S288C достигает 44,8 %, что свидетельствует о высоком белковом потенциале штамма и его биотехнологической значимости. Оптимальные условия экстракции (0,2 % NaOH, 37 °С, 3 ч, гидромодуль 1:5, ультразвуковая обработка) обеспечили эффективное разрушение клеточной стенки и высокий выход белков [13].
Таблица 2
Аминокислотный состав полипептида
|
Аминокислоты |
Белок, мг/гр |
|
Аспарагиновая кислота |
21.18344 |
|
Глутаминовая кислота |
24.64502 |
|
Серин |
15.31665 |
|
Глицин |
46.67304 |
|
Аспарагин |
0 |
|
Глутамин |
0 |
|
Цистеин |
2.940984 |
|
Треонин |
5.240469 |
|
Аргенин |
44.39112 |
|
Аланин |
1.088789 |
|
Пролин |
9.861871 |
|
Тирозин |
15.83588 |
|
Валин |
23.9325 |
|
Метионин |
2.827883 |
|
Гистидин |
27.41822 |
|
Изолейцин |
14.51658 |
|
Лейцин |
24.88968 |
|
Триптофан |
0 |
|
Фенилаланин |
6.89199 |
|
Лизин |
17.61042 |
|
Итог |
305.2645 |
Источник: составлено автором.
Фракционирование сульфатом аммония позволило получить низкомолекулярные пептиды (при 80 %-ном насыщении) с выходом 5,7 %, аналогично результатам, описанным в [14]. Гель-фильтрация на сефадексе G-25 обеспечила эффективное удаление солей и концентрацию целевых фракций.
ИК-спектроскопия подтвердила наличие функциональных групп, характерных для пептидов, включая алифатические и ароматические аминокислоты. Различия в спектрах указывают на влияние условий экстракции на состав фракций. По данным электрофореза в 10 %-ном полиакриламидном геле, молекулярная масса полипептидов составляет 8–40 кДа, что подтверждает их биологическую активность [15].
Аминокислотный анализ выявил высокое содержание глицина, аргинина и гистидина, обладающих потенциальной антиоксидантной активностью. Отсутствие триптофана и глутамина, вероятно, связано с условиями кислотного гидролиза.
Таким образом, разработанная комплексная методика очистки позволила получить пептидные фракции с перспективными свойствами для применения в биотехнологии, фармацевтике и пищевой промышленности.
Заключение
В результате проведенного исследования разработана и апробирована эффективная методика выделения и очистки низкомолекулярных полипептидов из сухих дрожжей S288C. Оптимизация условий экстракции обеспечила максимальное извлечение белков, а многоступенчатая схема очистки с использованием аммонийного сульфата, гель-фильтрации и лиофильной сушки – получение целевой фракции (5,7 %) с молекулярной массой 8–40 кДа.
ИК-спектроскопия и электрофорез подтвердили наличие функциональных групп, характерных для биологически активных молекул. Установленный аминокислотный профиль с преобладанием аргинина, глицина и глутаминовой кислоты указывает на потенциальную биологическую активность полипептидов. Полученные данные могут быть использованы при разработке функциональных биопрепаратов для биотехнологии и фармакологии.
Конфликт интересов
Благодарности
Финансирование
Библиографическая ссылка
Набиева Ф.С. ВЫДЕЛЕНИЕ, ОЧИСТКА И ХАРАКТЕРИСТИКА БИОЛОГИЧЕСКИ АКТИВНОГО ПОЛИПЕПТИДА ИЗ СУХИХ ДРОЖЖЕЙ SACCHAROMYCES CEREVISIAE S288C // Научное обозрение. Биологические науки. 2025. № 3. С. 83-89;URL: https://science-biology.ru/ru/article/view?id=1423 (дата обращения: 28.01.2026).
DOI: https://doi.org/10.17513/srbs.1423


 science-review.ru
science-review.ru