Введение
В последнее время возрастает интерес к исследованию стресса и его воздействия на организм животных и человека. Стресс является важным фактором, способствующим развитию заболеваний ЖКТ. В условиях стресса происходит нейрогуморальная дисрегуляция, которая нарушает моторику кишечника, вызывая его спазмы и патологическое растяжение [1, c. 104–112; 2, c. 286–291]. Так, например, в регионах с холодным климатом одним из ключевых стрессовых факторов является холод. Под его воздействием у самок крыс наблюдаются морфофункциональные изменения, включая увеличение числа тромбоцитов и лейкоцитов в крови, а также изменения в тканях тимуса и селезенки. Эксперимент вызвал физиологическое напряжение у животных, при котором холодовой стресс вызывал разные иммунные и морфофункциональные изменения в ободочной кишке самцов и самок. Это указывает на половые различия в реакции организма и подчеркивает значимость холодового стресса как фактора, влияющего на иммунную систему и ткани [3, с. 50–64]. Стресс активирует нервную систему и способствует высвобождению нейроэндокринных гормонов, что может нарушать защитные механизмы организма, включая баланс нормальной микрофлоры (Lactobacillus, Bifidobacterium). M.T. Bailey сообщает, что стресс оказывает значительное влияние на кишечную микрофлору животных, особенно тех, кто испытал стресс во время беременности, или у пожилых особей. Особое внимание уделяется транслокации микрофлоры, что указывает на воздействие стресса на иммунные процессы. В заключение автор выдвигает гипотезу, что изменения в микрофлоре могут способствовать повышению уровня воспалительных маркеров в организме, подчеркивая важность дальнейшего изучения этого взаимодействия для лучшего понимания заболеваний [4, c. 255–276]. Вместе с тем В. Аскарьянц и соавт. провели исследование ферментативной активности тонкой кишки у крыс в условиях стресса с применением феназепама – препарата из группы бензодиазепинов. Было установлено, что у крыс из агрессивных групп наблюдаются значительные изменения в функциональной активности тонкой кишки по сравнению с другими группами. Результаты исследования показали, что ферментативная активность у потомства зависит от поведенческих особенностей родителей и возраста животных. Применение феназепама оказало более выраженное корректирующее воздействие на агрессивных взрослых крыс, в то время как у молодых животных эффект был минимальным, особенно в возрасте 21 дня. Эти данные подчеркивают необходимость учета поведенческих и возрастных факторов при оценке фармакологических воздействий на функциональное состояние органов животных [5, c. 109–112].
Цель исследования – изучение воздействия различных стрессовых факторов на ферментативную активность тонкой кишки у морских свинок в экспериментальных условиях.
Материалы и методы исследования
Опыты проводились на 20 беспородных самцах морских свинок массой 300–350 г. Их содержание и проведение всех манипуляций осуществлялись в соответствии с общепринятыми нормами обращения с лабораторными животными, установленными Директивой 2010/63/EU Европейского парламента и Совета Европейского союза от 22 сентября 2010 г. по защите животных, используемых в научных и иных целях Животных разделили на три группы:
1) группа 1 (7 животных) – контрольная (здоровые животные);
2) группа 2 (7 животных) – животные, подвергшиеся химическому стрессу;
3) группа 3 (6 животных) – животные, подвергшиеся иммобилизационному стрессу.
В группе 2 химический стресс у животных вызывался интрагастральным введением 0,5 %-ного раствора уксусной кислоты (2 мл ежедневно в течение недели). В группе 3 стресс проводился путем иммобилизации морских свинок на специальной доске, где их конечности фиксировались в растянутом положении в течение 3 ч ежедневно на протяжении 14 дней. После декапитации животных извлекали тонкий кишечник, отделяли его от тканей и промывали 5 мл раствора Рингера.
Для оценки ферментативной активности использовали метод глюкозооксидазы A. Dahlqvist, который позволяет определить количество глюкозы, образующейся при гидролизе дисахаридов (мальтозы, сахарозы, лактозы) [6, c. 169–172]. Для исследования готовили 2 % растворы этих дисахаридов в физиологическом растворе. В пробирки с 0,5 мл субстрата добавляли 0,5 мл кишечного гомогената и инкубировали смеси в водяной бане при 38 °C в течение 30 мин. После инкубации из пробирок отбирали пробы, к которым добавляли реагент, и измеряли активность ферментов по интенсивности окрашивания, вызванной образованием глюкозы.
Специфическая активность α-амилазы и интегральная активность ферментов определялись в условных единицах, а активность кишечных карбогидраз выражалась в мкмоль/мин, образующемся при гидролизе дисахаридов, на 1 г белка или на общий белок органа. Различия показателей считались статистически значимыми при уровне значимости p < 0,05.
Методы гистологического исследования тканей ПЖ и ТК
Для микроскопического исследования кусочки подвздошной части ТК длиной 10 см фиксировали в 10 % растворе формалина на 72 ч, затем промывали в проточной воде, пропускали через спиртовые растворы градиентно повышающейся концентрации для обезвоживания ткани и обезвоженный высушенный кишечник заливали парафином. Из парафиновых блоков готовили срезы толщиной 5–8 мкм, окрашивая последние гематоксилин-эозином. Срезы изучали с помощью светового микроскопа Leica Microsystems GmbH (Германия), с компьютерной приставкой. Со срезов получали фотографии, увеличенные в 400 раз. Также уровень статистической достоверности значений между экспериментальными результатами и контрольной группой рассчитывали на основании t-критерия Стьюдента. Различия считали статистически достоверными при Р < 0,05.
Таблица 1
Масса тела, поджелудочной железы и тонкой кишки у морских свинок при воздействии стрессоров (M±m, n = 10)
|
Масса |
Контроль |
Химический стресс |
Иммобилизационный стресс |
||
|
M±m |
M±m |
Δ к контролю |
M±m |
Δ к контролю |
|
|
Тела (г) % к контролю |
202,1±10,9 100 |
179,6±8,3*** 88,3 % |
-21,7 |
184,6±18,5* 91,3 % |
-17,5 |
|
Тонкого кишечника (г) % к контролю |
10,4±1,5 100 |
8,81±0,62** 84,7 % |
-1,59 |
9,24±0,4* 88,8 % |
-1,16 |
|
Поджелудочной железы (мг) % к контролю |
486,1±5,04 100 |
479,0±6,8* 98,5 % |
-7,1 |
380,3±4,4** 78,2 % |
-105,8 |
Примечание: * – P < 0,05, ** – Р < 0,01, *** – Р < 0,001, по отношению к контролю.
Составлена авторами на основе полученных данных в ходе исследования
Результаты исследования и их обсуждение
Как видно из табл. 1, воздействие химического и иммобилизационного стресса оказывает влияние на морфометрические показатели животных.
Интрагастральное введение уксусной кислоты приводило к снижению массы тела морских свинок на 11,1 % по сравнению с контролем, тогда как под влиянием иммобилизационного стресса по сравнению со здоровыми животными уменьшение массы тела составило 8,7 %.
Масса ТК также уменьшилась в условиях химического стресса на 15,3 %, а при иммобилизационном стрессе – на 11,1 % по сравнению с контрольными группами морских свинок.
Масса ПЖ у морских свинок, подвергавшихся химическому стрессу, снизилась на 1,5 % относительно здоровых животных, тогда как у животных после воздействия иммобилизационного стресса уменьшение массы ПЖ по сравнению с контролем составило 21,8 %. Таким образом, масса тела, ПЖ и ТК у морских свинок независимо от вида стрессового воздействия, химического или физического, уменьшается. Эти изменения свидетельствуют о негативном влиянии стрессовых факторов не только на массу тела и органов пищеварения, но и на метоболизм в целом [Кучкарова Л.С., Ганижонов П.Х., Хомидчонова Ш.Х.].
Было выявлено, что специфическая активность энтеральной мальтазы при химическом стрессе, вызванном интрагастральным введением СН3СООН, увеличивалась на 309,5 % по сравнению с контрольными величинами, достигая 32,3±0,6 мкмоль/мин/г ткани в экспериментальной группе. Подобным образом, при иммобилизационном стрессе уровень специфической активности фермента увеличивался на 173,6 % по сравнению с нестрессированными животными, достигая 22,4±5,13 мкмоль/мин/г у животных, обработанных СН3СООН (табл. 2).
Такая же картина наблюдалась и в изменении интегральной активности мальтазы у стрессированных животных. При интрагастральном введении 0,5 % СН3СООН морским свинкам она увеличивалась на 221,4 % (P < 0,001), а при иммобилизационном стрессе уровень активности фермента возрастал на 130,8 % (P < 0,001) по сравнению с животными контрольной группы.
Видно, что возрастание специфической активности энтеральной мальтазы у морских свинок было на 11,1 мкмоль/мин/г (P < 0,05) больше при воздействии СН3СООН по сравнению с иммобилизационным влиянием. Увеличение интегральной активности фермента при химическом стрессе у животных по сравнению с воздействием физического стресса было выше на 7,1 мкмоль/мин/г ткани. Следовательно, и в этом химическое воздействие на активность мальтазы ТК было выше физического.
Заметные изменения после влияния двух видов хронического стресса на морских свинок были отмечены и в активности кишечной сахаразы (табл. 2).
При химическом стрессе, то есть интрагастральном введении 0,5 % раствора СН3СООН морским свинкам, уровень специфической активности энтеральной сахаразы увеличивался на 196,9 %, достигая 7,3±1,86 мкмоль/мин/г, тогда как в контроле этот показатель составлял 2,12±0,43 мкмоль/мин/г. После иммобилизационного стресса животных наблюдалось также увеличение специфической активности фермента на 130,1 % (5,59±0,63 мкмоль/мин/масса органа в контроле против 2,1±0,15 мкммоль/мин/масса органа) по сравнению с контрольной группой).
Таблица 2
Изменение активности энтеральных мальтазы и сахаразы при воздействие стрессовых факторов
|
В % по отношению к контролю |
Контроль |
Химический стресс |
Иммобилизационный стресс |
||
|
M±m |
M±m |
Δ |
M±m |
Δ |
|
|
Мальтаза, % |
8,17±4,18 100 % |
32,3±0,6 *** 309,5 % |
24,1 |
22,4±0,6 *** 173,6 % |
14,2 |
|
Сахараза, % |
2,12±0,43 100 % |
7,3±1,86 ** 196,9 % |
5,18 |
5,59±1,79 ** 130,1 % |
2,47 |
Специфическая (А) и интегральная (Б) активность мальтазы у морских свинок при воздействии стрессоров (M±m, n = 10).
Примечание: *** – P < 0,001, по отношению к контрольной группе; К – контроль, ХС – химический стресс, ИС – иммобилизационный стресс. Составлена авторами на основе полученных данных в ходе исследования
Как и ожидалось, интегральная активность мембраносвязанной сахаразы ТК после воздействия химического и физического стрессоров на животных резко увеличивалась – на 243,5 и 163,4 % соответственно.
Следует отметить, что специфическая активность сахаразы после интрагастрального введения 0,5 % СН3СООН морским свинкам была выше на 1,71 мкмоль/мин/г ткани по сравнению с активностью фермента после иммобилизационного стресса. Интегральная активность фермента при химическом стрессе превышала показатели интегральной активности сахаразы после физического стресса на 14,5 мкмоль/мин/г ткани (табл. 1) [Кучкарова Л.С., Ганижонов П.Х., Хомидчонова Ш.Х.]. Химический стресс является разновидностью стрессового воздействия, возникающего под влиянием экзо- или эндогенных химических факторов – токсинов, лекарственных средств, загрязняющих веществ окружающей среды, продуктов метаболизма и других соединений, способных нарушать клеточный и системный гомеостаз. В отличие от физического и эмоционального стресса, химический стресс непосредственно воздействует на ткани, клетки, клеточные структуры, а также на биохимические процессы, вызывая каскад клеточных, тканевых и системных изменений. Воздействие химических стрессоров приводит к развитию нарушений гомеостаза на различных уровнях организации живой системы – от клеточного до системного [7, c. 731–745]. Второй вид стресса, который был применен в данных наблюдениях, это иммобилизационный стресс – форма физического стресса, возникающая у человека и животных в ответ на вынужденное обездвиживание или ограничение подвижности, который широко используется в экспериментальной физиологии и биомедицине как модель общего стресса для изучения нейроэндокринных, метаболических и морфофункциональных реакций организма [8, c. 23; 9, c. 421–427].
Из полученных результатов можно сделать вывод, что стрессовые факторы, независимо от их природы, нарушают гомеостаз ферментов, участвующих в начальных и заключительных стадиях обмена углеводов. Это проявляется в повышении специфической и интегральной активности ферментов, участвующих в углеводном пищеварении в тканях поджелудочной железы и тонкой кишки.
Гистоструктура поперечного среза тонкой кишки
Как видно из рисунка, при обзорной микроскопии поперечного среза стенки ТК морских свинок контрольной группы четко дифференцировались слизистая, подслизистая, мышечная и серозная оболочки. В слизистой оболочке кишечные ворсинки имеют удлиненную пальцевидную форму и покрыты однослойным призматическим эпителием. Границы клеток эпителиального пласта достаточно отчетливо выражены, особенно преимущественно в апикальных отделах ворсинок.
Отсутствие признаков воспаления и деструкции свидетельствует о нормальном морфофункциональном состоянии кишечной стенки.
При микроскопическом исследовании поперечного среза ТК морских свинок, подвергшихся химическому стрессу, оказалось, что ворсинки расположены менее плотно и беспорядочно. Это проявлялось в укорочении и неоднородности ворсинок слизистой и слущивании эпителия в отдельных участках. В подслизистом слое отмечается отечность, расширение капилляров и скопление клеток воспаления [Кучкарова Л.С., Ганижонов П.Х., Хомидчонова Ш.Х.].
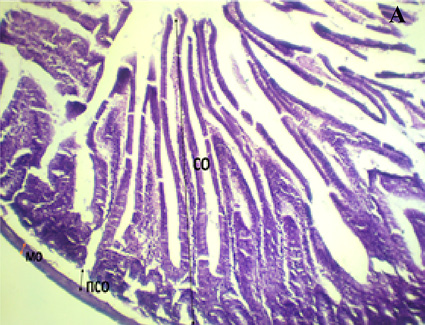
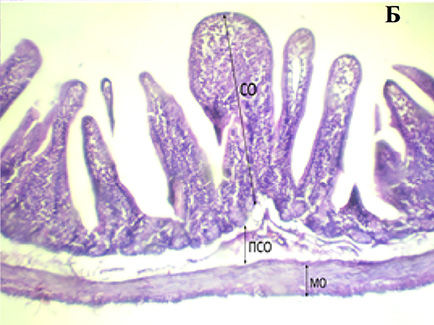
Поперечный срез стенки ТК у интактных (А), химически спрессованных (Б) животных: СО – слизистая оболочка, ПСО – подслизистая оболочка, МО – мышечная оболочка. Окраска гематоксилин-эозином. Leica Microsystems GmbH (Германия) x 100 Примечание: составлен авторами по результатам исследования
Таблица 3
Гистоморфология крипто-ворсиночной оси морских свинок, подвергшихся химическому стрессу с последующей коррекцией куркумином (M±m; n = 10)
|
Показатель |
Контроль |
Химический стресс |
Стресс + куркумин |
||
|
M±m |
M±m |
Δ |
M±m |
Δ |
|
|
Высота ворсинок (Мкм), % |
463,4 ± 21,6 100,0 |
437,0 ± 20,2* 94,3 % |
-26,4 |
446,8± 20* 96,4 % |
-16,6 |
|
Глубина крипт (мкм), % |
195,3 ± 17,1 100,0 |
212,1 ± 18* 108,6 % |
16,3 |
215,0± 13,8* 1,1 % |
19,7 |
|
Воспалительные клетки (шт/0,01 мм²), % |
14,0± 2,5 100,0 |
24,7 ± 8* 176,4 % |
10,7 |
21,3± 2,1* 152,1 % |
7,3 |
Примечание: * – P < 0,05. Составлена авторами на основе полученных данных в ходе исследования.
Как показали гистологические исследования при воспалении повреждаются ацинусы и дуктулоциты поджелудочной железы, которые и являются одной из причин нарушения оттока панкреатического сока и гиперферментации, в том числе и гиперамилаземии ткани органа [10, c. 499–512; 11, c. 17–60]. О нарушении секреции панкреатического сока в полость тонкой кишки свидетельствует и возрастание активности липазы, которая является специфичным маркером панкреатита [12].
Гистоморфология крипто-ворсиночной оси
Морфометрический анализ крипто-ворсиночной оси ТК показал, что химический стресс вызывает выраженные изменения в ее структуре
Как видно из табл. 3, химический стресс вызвал снижение высоты ворсинок ТК на 5,6 %, углубление крипт на 8,6 %, а также возрастание числа воспалительных клеток на 76,4 %. Введение куркумина заметно способствовало восстановлению морфометрических параметров структурной единицы слизистой оболочки ТК, хотя полного «оздоровления» в системе после введения препарата в течение двух недель еще не наступало.
Результаты показывают, что функциональные сдвиги в гидролитической способности ПЖ и ТК ассоциируют с серьезными гистоморфологическими изменениями органов пищеварения у стрессированных морских свинок [13, c. 102–111; 14, c. 839–846; 15, c. 652–666].
Заключение
Таким образом, стрессоры оказывают различное воздействие на организм, включая изменения на клеточном и молекулярном уровнях через нервные и гуморальные механизмы. В ходе исследования было установлено, что при воздействии стрессовых факторов наблюдается повышение активности дисахаридаз, причем более выраженное увеличение активности было зафиксировано при химическом стрессе. Патоморфологические изменения также подтвердили эти данные, демонстрируя изменения в структуре и функции тонкой кишки. Особую роль в этих процессах играет гипоталамо-гипофизарно-надпочечниковая ось, которая регулирует гормональные изменения в ответ на стресс. Тонкая кишка, как важный орган пищеварения, является чувствительной мишенью для гормональных изменений, вызванных стрессом. В данной работе анализируются воздействия химического и иммобилизационного стресса на состояние тонкой кишки и выявляются изменения в ее функциональной активности и морфологии. Следовательно, наши исследования впервые показали роль стресса в начальной и заключительной стадии гидролиза углеводов. Хронический умеренный стресс вызывает адаптогенные перестройки в переваривающей способности поджелудочной железы и тонкой кишки, направленные на сохранение энергетического баланса.
Библиографическая ссылка
Кучкарова Л.С., Ганижонов П.Х., Хомидчонова Ш.Х. ИЗУЧЕНИЕ АКТИВНОСТИ ДИСАХАРИДАЗ МАЛЬТАЗЫ И САХАРАЗЫ ПОД ВОЗДЕЙСТВИЕМ СТРЕССОВЫХ ФАКТОРОВ У МОРСКИХ СВИНОК В ЭКСПЕРИМЕНТАЛЬНЫХ УСЛОВИЯХ // Научное обозрение. Биологические науки. 2026. № 1. С. 29-34;URL: https://science-biology.ru/ru/article/view?id=1448 (дата обращения: 10.02.2026).


 science-review.ru
science-review.ru