Введение
Механическим свойствам биологических тканей органов человека и животных посвящено весьма большое количество публикаций [1-3], а интерес исследователей к ним не ослабевает и в последние годы (рис. 1). Триггером в этом процессе послужила актуальность применения сегодня замещающих материалов с заданными свойствами в пластической хирургии и трансплантологии. Для успешных вмешательств знание физических, и прежде всего механических, параметров тканей материалов-заменителей, как и природных тканей, крайне необходимо. Полые вены – два магистральных сосуда, по которым возвращается венозная кровь из тела в сердце. В настоящее время в связи с распространенностью болезней крупных вен организма человека особую важность приобретают вопросы протезирования этого отдела сосудистого русла.
Оптимальными материалами для протезов признаны аутотрансплантаты, а среди синтетических – пористый политетрафторэтилен [5]. Также доказала высокую эффективность эндоваскулярная реконструкция нижней полой вены саморасширяющимися нитиноловыми стентами [6].
Однако деформационные свойства собственно тканей полой вены изучены недостаточно.
Рис. 1. Число публикаций, посвященных полым венам, в мировой медицинской литературе по годам [4]
В качестве примера можно привести одну из немногочисленных публикаций [7], в которой, используя наноиндентирование, пространственно картировали микромеханические свойства срезов аорты и полой вены хорька с толщиной стенки 5 мкм и связали эти механические свойства с гистологическим распределением эластичных волокон. Модуль упругости аорты прогрессивно снижался от 35 МПа в адвентициальном (самом внешнем) слое до 8 МПа в интимальном (самом внутреннем) слое. Напротив, полая вена была относительно жесткой, с модулем упругости >30 МПа как в богатой внеклеточным матриксом адвентициальной, так и в интимальной областях сосуда. Однако центральный высококлеточный медиальный слой полой вены имел модуль упругости ~20 МПа. В областях ткани, богатых внеклеточным матриксом, модуль упругости, определенный с помощью наноиндентирования, обратно коррелировал с плотностью эластичных волокон. Таким образом, авторы выявили возможность пространственно разрешать различия в микромеханических свойствах крупных артерий и вен, связанные с микроструктурой тканей, однако не указали диапазон деформаций, в котором производили измерения, что весьма важно. Автор статьи [8] W. Li инфузионным методом установил, что модуль Юнга полой вены варьируется в зависимости от давления от 22 до 84 кПа и имеет тенденцию к росту с увеличением трансмурального давления. Тем не менее детально пассивные упругие и гиперупругие свойства полых вен не изучались, а данные зачастую противоречили друг другу. Это связано прежде всего с тем, что упругие свойства мягких биологических тканей являются дифференциальными (инкрементальными, т.е. возрастающими с деформацией) и гиперупругими (как известно, гиперупругие материалы способны испытывать гигантские деформации, а потом возвращаться к исходному состоянию или близкому к нему) и не могут быть выражены всего лишь одним значением E = Δσ/Δε. И даже двух значений E1 и E2 в билинейной модели с двумя модулями упругости недостаточно.
Актуальность исследований определена необходимостью знаний данных параметров при разработке замещающих материалов для протезов в сосудистой хирургии.
Цель исследования – на основании результатов известных механических испытаний изучить деформационные свойства стенки полой вены человека.
Материалы и методы исследования
Расчеты производили в программном пакете Mathcad 15.0. Использовали данные, полученные при одноосных механических испытаниях полой вены на аутопсийном материале, представленные в работе [9, с. 261-301]. Применяли функции «подгонки» linfit и genfit, а также функционал corr. Анализировались наиболее часто встречающиеся в мировой литературе гиперупругие модели: неогуковская, Муни-Ривлина [10], Огдена, Йео, полиномиальная [11] и Веронда-Вестманн [12].
Результаты исследования и их обсуждение
Гиперупругие модели. Результаты вычислений сведены в таблицы 1 и 2, а зависимости «напряжение – деформация» отображены на рисунке 2.
Отметим, что на графике при малых деформациях можно видеть участок механической неустойчивости материала в модели Муни-Ривлина (начальный упругий модуль EMR <0).
Таблица 1
Параметры гиперупругих моделей полой вены
|
Гиперупругая модель (постоянные) |
μ, кПа |
α |
C10, C1, кПа |
C01, C2, кПа |
C20, C3, кПа |
C02, кПа |
C11, кПа |
|
Неогуковская (μ) |
18.691 |
– |
– |
– |
– |
– |
– |
|
Муни-Ривлина 2-параметрическая (C10, C01) |
– |
– |
233.899 |
-262.08 |
– |
– |
– |
|
Огдена 1-го порядка (μ, α) |
27.659 |
0.065 |
– |
– |
– |
– |
– |
|
Йео 3-го порядка (C1, C2, C3) |
– |
– |
6.571 |
-69.422 |
530.332 |
– |
– |
|
Полиномиальная 2-го порядка (C10, C01, C20, C02, C11) |
– |
– |
-624.25 |
639.764 |
2.70·104 |
3.88·104 |
-6.4·104 |
|
Веронда-Вестманн (C1, C2, C3) |
– |
– |
0.084 |
17.439 |
0.929 |
– |
– |
Таблица 2
Статистические показатели гиперупругих моделей полой вены
|
Гиперупругие модели |
Стандартное отклонение SD, кПа |
Макс. абсолютная ошибка Δ, кПа |
Приведенная погрешность δmax, % |
Коэффициент корреляции R |
|
Неогуковская |
9.176 |
10.63 |
24.647 |
0.824 |
|
Муни-Ривлина 2-параметрическая |
4.431 |
5.666 |
13.137 |
0.949 |
|
Огдена |
0.645 |
1.139 |
2.641 |
0.9992 |
|
Йео |
0.811 |
1.073 |
2.488 |
0.998 |
|
Полиномиальная |
0.259 |
0.354 |
0.821 |
0.9998 |
|
Веронда-Вестманн |
0.197 |
0.414 |
0.96 |
0.9999 |
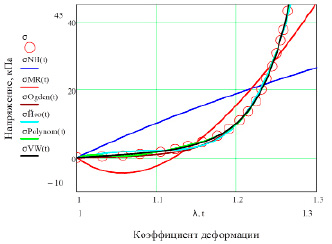
Рис. 2. Вид гиперупругих модельных функций полой вены: в неогуковской (NH), Муни-Ривлина (MR), Огдена (Ogden), Йео (Yeoh), полиномиальной (Polynom), Веронда-Вестманн (VW) моделях и экспериментальные данные (σ)
Линейная, билинейная и экспоненциальная деформационные модели.
Представляет также интерес исследование деформационных свойств полой вены в рамках деформационных линейной, билинейной и экспоненциальной моделей (табл. 3 и 4). Данные модели описывали функциями вида:
σ = E·ε – линейная зависимость; σ = E1·ε + E2·(ε – εкр)·θ(ε – εкр) – билинейная зависимость; σ = a·[exp(b·ε) – 1] – экспоненциальная зависимость. E – модуль Юнга в линейной модели; E1 = Eмин, E2 = Eмакс – минимальный и максимальный модули Юнга в билинейной модели, θ – ступенчатая функция Хэвисайда, равная нулю для значений аргумента, меньших нуля, и единице – для значений, больших нуля; εкр = 0.22 – деформация, соответствующая в билинейной модели точке, sbilin1 = sbilin2 (рис. 3), и при которой эластиновый механизм деформации мягких тканей сменяется на коллагеновый; параметры a и b отвечают наиболее точной экспоненциальной аппроксимации.
Таблица 3
Параметры линейной, билинейной и экспоненциальной моделей полой вены
|
Свойства |
Деформационные |
||||||
|
Модель |
Линейная |
Билинейная |
Экспоненциальная |
||||
|
Параметры |
E, кПа |
E1, кПа |
E2, кПа |
εкр |
a, кПа |
b |
Eср*, кПа |
|
94.47 |
2.64 |
944.72 |
0.22 |
0.118 |
22.351 |
160.29 |
|
*среднее значение Eср рассчитывали по формуле 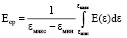 .
.
Таблица 4
Статистические показатели линейной, билинейной и экспоненциальной моделей полой вены
|
Гиперупругие модели |
Стандартное отклонение SD, кПа |
Макс. абсолютная ошибка Δ, кПа |
Приведенная погрешность δmax, % |
Коэффициент корреляции R |
|
Линейная |
7.572 |
10.131 |
23.49 |
0.8561 |
|
Билинейная |
8.644 |
13.017 |
30.18 |
0.8561 |
|
Экспоненциальная |
0.565 |
0.811 |
1.88 |
0.9995 |
В таблице 4 обращает на себя внимание тот факт, что параметры «подгонки» SD, Δ и δmax линейной функции отличаются в лучшую сторону по сравнению с аналогичными у 2-модульной билинейной модели (с минимальным и максимальным упругим модулем). Коэффициенты корреляции R обеих моделей при этом одинаковы. Очевидно, использовать в билинейной модели наименьший и наибольший значения модулей не является лучшей идеей.
Из таблицы 4 также следует, что статистические показатели экспоненциальной модели (SD = 0.565, Δ = 0.811, δmax = 1.881 %, R = 0.9995) не хуже 3 из 6 рассмотренных гиперупругих моделей (табл. 2), что делает ее предпочтительнее данных моделей при аппроксимации деформационных свойств полой вены.
Таким образом, из таблицы 3 следует, что упругие модули полой вены равны: в линейной модели 94.47 кПа, в билинейной 2.64 кПа (минимальный) и 944.72 кПа (максимальный). Средний модуль Юнга в экспоненциальной аппроксимации – 160.29 кПа. То есть максимальный модуль Юнга полой вены больше минимального в 356 (!) раз и является в итоге выраженным дифференциальным (инкрементальным). При этом упругий модуль линейной модели и средний модуль экспоненциальной модели значительно ближе по величине к минимальному значению, чем к максимальной величине (рис. 4). Очевидно, это связано с тем, что «разгон» дифференциального упругого модуля происходит медленно и большая его часть соответствует диапазону малых деформаций (≈ 0-0.15).
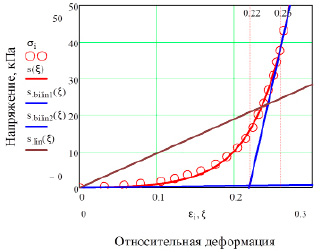
Рис. 3. Деформационные свойства полой вены: σi – опытные точки [9], s(ξ) – экспоненциальная модель, sbilin1(ξ) и sbilin2(ξ) – билинейная модель, slin(ξ) – линейная модель
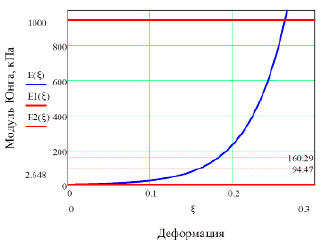
Рис. 4. Упругие модули полой вены: минимальный E1 = 2.64 кПа, максимальный E2 = 944.72 кПа, модуль Юнга линейной модели E = 94.47 кПа (пунктир), среднее значение экспоненциальной модели Eср = 160.29 кПа (пунктир) и дифференциальный E(ξ)
Выводы
1. Рассчитаны параметры гиперупругих моделей полой вены человека и определены их статистические показатели как коэффициентов «подгонки» аппроксимирующих функций под имеющиеся экспериментальные данные.
2. Для описания механического поведения полой вены лучше всего подходит гиперупругая модель Веронда-Вестманн
(SD = 0.197, Δ = 0.026,
δmax = 0.96%, R = 0.9999),
менее всего – простейшая 1-параметрическая неогуковская модель
(SD = 9.176, δ = 0.156,
δmax = 24.647%, R = 0.824).
3. Двухпараметрическая модель Муни-Ривлина закономерно не проявила хороших показателей и также не рекомендована для описания деформационных кривых полой вены. Кроме того, на начальном участке деформирования она характеризуется механической неустойчивостью, что не соответствует экспериментальным наблюдениям.
4. Установлены параметры линейной, билинейной и экспоненциальной деформационных моделей полой вены, а также их статистические показатели. Модуль Юнга полой вены является инкрементальным и в линейной модели равен 94.47 кПа, в билинейной – 2.64 кПа (минимальный) и 944.72 кПа (максимальный). Средний модуль Юнга в экспоненциальном приближении – 160.29 кПа.
5. Результаты моделирования могут быть полезны при расчетах в биоинженерии и медицине при подборе замещающих материалов для реконструктивных операций на крупных сосудах в сердечно-сосудистой хирургии и разработке конструкций из этих материалов.


 science-review.ru
science-review.ru