Введение
В аутоиммунной природе сахарного диабета 1-го типа (СД1) цитокины играют важную роль в поддержании иммунных реакций, дисбаланс которых могут вызывать нарушения β-клеток островков Лангерганса. Известно, что провоспалительные цитокины участвуют в процессах восстановления, активации и пролиферации β-клеток, поддерживают жизнеспособность клеток поджелудочной железы. Фактор некроза опухоли TNFα (tumor necrosis factor) участвует в воспалительных реакциях на системном и локальном уровнях, играет ключевую роль в патогенезе системных заболеваний [1].
Кроме того, TNFα при нормальных количествах поддерживает такие гомеостатические функции клеток, как клеточная пролиферация и апоптоз, запускает липидные медиаторы эпителия сосудов, тем самым вызывает инфильтрацию иммунных клеток с помощью адгезии лейкоцитов. Повышение уровня в плазме TNFα, опосредуя клетками иммунной системы, играет фундаментальную роль в разрушении клеток поджелудочной железы, что может являться фактором риска в патогенезе сахарного диабета, нарушения липидного обмена, что может быть причиной ожирения и возникновения воспалительных процессов.
Актуально исследование связи полиморфизма генов, аллелей и генотипов SNV, которые могут влиять на их функциональное состояние, влияющие на экспрессию белковых молекул при различных патологических состояниях. Исследования полиморфизма генов сахарного диабета 1 и 2 типа показывают предрасположенность в генотипе статистических данных, исследования полиморфизмов TNFα2308 AA и TNFα2308 A у египетских пациентов выявили взаимосвязи с СД1. Также изучены полиморфизмы -308 G/A TNFα в иранских и саудовских популяциях [2, 3].
Проведенные исследования показывают высокий уровень циркулирующего TNFα –в три-четыре раза выше у пациентов с сахарным диабетом 1-го типа, также в прогрессировании диабетической нефропатии имел место полиморфизм аллель C TNFα – 10 31 T/C. У больных диабетической стопой с генотипом СС по сравнению с больными с генотипом ТТ выявлено повышение уровня TNFα в сыворотке крови [4].
Изучение молекулярно-генетических особенностей функциональной области последовательностей промотора гена TNF-a G-308A в иорданской популяции показало влияние функциональной области на уровень сахара в крови у больных с сахарным диабетом 2-го типа. У лиц с генотипом -308GG с высоким уровнем TNFα, больных сахарным диабетом 2-го типа, выявлены изменение концентрации сахара в крови и резистентность к инсулину [5].
Целью настоящего исследования является изучение взаимосвязи полиморфизма гена TNF-A -308G/A с активностью цитокина TNFα у больных СД 1-го типа, проживающих в Самаркандской области.
Материалы и методы исследования
Настоящее исследование основывается на результатах наблюдения за пациентами с сахарным диабетом 1-го типа, проведенного в отделении диагностики Самаркандского областного центра эндокринологии. Контроль и непосредственную консультативную, научную и методическую помощь оказывал заведующий отделением А.Э. Кадыров.
В исследование были включены пациенты, подписавшие добровольное информированное согласие на участие в соответствии с Хельсинкской декларацией. Были включены 64 пациента с сахарным диабетом 1-го типа, из них 41 женщина – 70 % и 23 мужчины – 30 %. В группу исследования были включены пациенты, зарегистрированные в эндокринологическом центре, в возрасте от 7 до 40 лет. Контрольную группу составили 198 относительно здоровых лиц, не имеющих в анамнезе СД 1-го типа.
Выделение ДНК
Для выделения ДНК был использован метод лизиса клеток крови путем двойного центрифугирования объема цельной крови в буфере RCLB (Redcellslysisbuffer – эритроцитарный лизирующий буфер) при скорости 1500 об/мин.
Проведение метода полиморфизма длины рестрикционных фрагментов – ПДРФ
Для амплификации полиморфного участка гена TNF-A -308G/A исследованной популяции использовали метод полимеразной цепной реакции с аллельспецифичными праймерами TNF-A-308G/A:
forward 5’-GACAAGCCTGTAGCCCATGT-3’,
reverse 5’- GGAGGTTGACCTTGGTCTGG -3’.
Концентрацию цитокина определяли методом иммуноферментного анализа (ИФА) с использованием коммерческих наборов ЗАО «Вектор Бест» в диапазоне концентраций для TNF-α пг/мл.
Полученные данные обрабатывали с помощью программного пакета GraphPadPrism 10, включая использование встроенных функций статистической обработки.
Результаты исследования и их обсуждение
Ген TNFα кодирует многофункциональный белок, который принимает участие в провоспалительных процессах. В основном секретируется макрофагами, функционирует через рецепторы TNFRSF1A/TNFR1 и TNFRSF1B/TNFBR. TNFα участвует в процессах регуляции, пролиферации и дифференцировки клеток, апоптоза, в патологиях, связанных с аутоиммунными заболеваниями. Широко изучены несколько вариантов гена, в том числе TNFА: -238G/A -308G/A, которые способствуют повышению или снижению продукции цитокина.
Исследования полиморфизма аллелей и генотипов маркеров гена TNFα -308G/A в группе больных СД 1-го типа по сравнению с контрольной группой показали высокие показатели частоты аллеля А в группе больных с СД 1-го типа по сравнению с группой контроля (табл. 1).
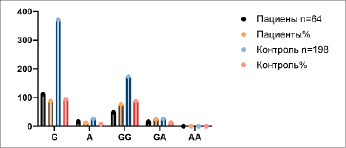
Рис. 1. Сравнительная характеристика частот аллелей и генотипов гена TNF-A -308G/A у больных с СД 1-го типа
Таблица 1
Взаимосвязь аллелей и генотипов гена TNF-A -308G/A у больных с СД 1-го типа
|
Генотип |
χ2 |
RR (95 % CI) |
|
G |
p = 0,0321 |
0,53 (0,25–0,95) |
|
A |
p = 0,0242 |
2,05 (1,54–3,89) |
|
GG |
p = 0,0211 |
0,45 (0,28–0,92) |
|
GA |
p = 0,0212 |
2,21 (1,86–4,45) |
Примечание: χ2– показатель достоверности по Пирсону; RR – относительный риск.
Исследования показателя аллеля G свидетельствуют о низких показателях по сравнению с контрольной группой (рис. 1).
При изучении особенностей распределения генотипа GG выявлена достоверная разница в исследованной группе с СД 1-го типа по сравнению с контролем (табл. 1, рис. 1). Анализ гетерозиготного генотипа GA также свидетельствует о различиях между исследованной группой с СД 1-го типа по сравнению с контрольной группой (рис. 1), различий при анализе гомозиготного генотипа АА не было выявлено.
Таким образом, анализ распределения аллелей и частот распределения гена – 308(G/A) TNF у лиц с СД 1-го типа, проживающих в Самаркандской области, свидетельствует о значительном вкладе в предрасположенность к заболеванию, является существенным фактором прогноза у больных с СД 1-го типа, узбекской популяции, проживающих в г. Самарканде.
При сравнении анализа генотипов полиморфизма TNFα -308G/A с различными возрастными группами пациентов с СД1 (табл. 2) у больных с СД 1-го типа, имеющих генотип GG, статистические значимые разницы имели лица старше 10 лет (p ≤ 0,0001). У лиц с генотипом GG 7–10 и ≥ 15 лет в возрастных подгруппах статистически значимых различий не выявлено. Также среди лиц с генотипом GA подростки старше 10 лет имели статистически значимую разницу (p ≤ 0,0001) по сравнению с другими возрастными подгруппами.
Таблица 2
TNFα -308G/A генотипы у детей возрастных групп
|
Генотипы |
Частоты (%) |
RR (95 % CI) |
P-value* |
|
GG |
|||
|
7–10 лет |
6/48 (12,5 %) |
0,81 (0,21–2,54) |
0,91 |
|
10–15 лет |
8/48 (16,6 %) |
||
|
≥ 10 лет |
4/48 (8,33 %) |
0,22 (0,19–0,28) |
≤ 0,0001 |
|
≥ 15 лет |
28/48 (58,33 %) |
||
|
GA |
|||
|
7–10 лет |
3/16 (18,75 %) |
0,81 (0,38–1,74) |
0,81 |
|
10–15 лет |
4/16 (25 %) |
||
|
≥ 10 лет |
2/16 (12,5 %) |
0,24 (0,15–0,38) |
≤ 0,0001 |
|
≥ 15 лет |
9/16 (56,25 %) |
Для изучения особенностей развития СД 1-го типа были исследованы показатели TNF-α у лиц СД 1-го типа. Проведенные исследования свидетельствуют о высоком уровне (TNF-α) у лиц с СД 1-го типа по сравнению с контрольной группой (p < 0,05) (рис. 2).
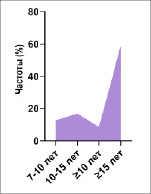
Рис. 2. Уровень провоспалительных цитокинов TNFα при СД 1-го типа
У больных с СД 1-го типа концентрация TNF-α в периферической крови составила 56,7±4,8 пг/мл, в контрольной группе – 16,3±1,76 пг/мл.
TNFα участвует в системном воспалении, уровни TNFα в плазме связаны с различными факторами риска диабета [6]. Он играет фундаментальную роль в разрушении бета-клеток, опосредованном иммунными клетками, потому достоверно (р < 0,05) высокое содержание его у больных с СД 1-го типа (56,7±4,8 пг/мл) говорит о преобладании в патогенезе СД 1-го типа иммуноопосредованного деструктивного процесса в бета-клетках [7, 8].
Была проведена сравнительная характеристика уровня показателей активности цитокинов TNFα у пациентов с СД 1-го типа, проживающих в Самаркандской области, с генотипами GG, GA гена TNFα -308G/A в общей популяции. Данные представлены в табл. 3. Отмечается, что уровень показателей активности цитокинов TNFα у пациентов с СД 1-го типа Самаркандской области в зависимости от полиморфизма TNFα -308G/A, с генотипом GG и GA наблюдается увеличение количества TNFα пг/мл (55,3±5,6, 58,1±4,4, 16,3±1,76, р ≤ 0,001) высокие концентрации которых обнаружены у лиц с генотипом GA. Таким образом, гетерозиготный генотип GA вносит значительный вклад в развитие аутоиммунного сахарного диабета 1-го типа.
По представленным в табл. 3 и на рис. 3 данным, лица общей популяции с СД 1-го типа гена TNFα -308G/A с генотипами GG n = 27 имели высокие концентрации TNFα пг/мл по сравнению с контрольной группой.
Анализ половых различий уровня цитокинов TNFα в зависимости от генотипов TNFα -308G/A у женщин представлен в табл. 3 и на рис. 3, где отмечается, что у женщин с генотипами гена TNFα -308G/A GG и GA наблюдалось увеличение количества цитокинов (55,1±5,6, 57,1±4,4, 16,3±1,76, р ≤ 0,001) по сравнению с контрольной группой.
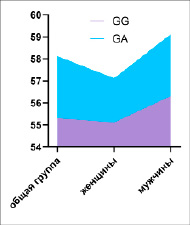
Рис. 3. Уровень TNFα в зависимости от половых различий
Анализ содержания цитокинов TNFα у мужчин с СД 1-го типа Самаркандской области полиморфизма гена TNFα -308G/A у лиц мужского пола (табл. 3) показал, что у лиц с генотипами GG и GA полиморфизма гена TNFα -308G/A отмечаются высокие показатели TNFα по сравнению с контролем (56,3±5,6, 59,1±4,4, 16,3±1,76, р ≤ 0,001).
Исследования факторов начала заболевания в зависимости от генотипа GG, GA гена TNFα -308G/A показывают возраст начало заболевания от 7 лет, но существенно число заболевших СД1 типа увеличивается в популяции от 10 лет. Также анализ половых различий встречаемости заболевания СД 1-го типа показал, что в популяции обследованных СД 1-го типа зарегистрировано начало болезни у лиц женского пола, то есть у девочек 7 лет.
Таблица 3
Уровень показателей активности цитокинов TNFα у женщин и мужчин СД 1-го типа Самаркандской области
|
Генотип |
TNFα пг/мл общая группа n = 64 |
TNFα пг/мл Женщины n = 41 |
TNFα пг/мл Мужчины n = 23 |
Контроль n = 198 |
|
GG |
55,3±5,6*** n = 48 |
55,1±5,6*** n = 23 |
56,3±5,6*** n = 11 |
16,3±1,76 |
|
GA |
58,1±4,4*** n = 16 |
57,1±4,4*** n = 14 |
59,1±4,4*** n = 10 |
16,3±1,76 |
Примечание. Достоверность разницы между исследованной группой и контролем (р ≤ 0,001).
Заключение
Анализ показателей взаимосвязи между изученными цитокинами показал увеличение концентрации цитокина при СД 1-го типа. Лица с генотипами GG, GA имели высокие концентрации TNFα, гетерозиготный генотип GA независимо от половых различий имели высокие концентрации данного цитокина. Данная ситуация свидетельствует об изменении концентрации в зависимости от замены аллеля А. Полная замена на гомозиготный АА генотип может свидетельствовать о развитии прогрессирующего аутоиммунного СД 1-го типа. Таким образом, ген TNFα -308G/A с показателями цитокина TNFα свидетельствует о вовлеченности иммунных реакций в патогенез СД 1-го типа. Лица женского пола имеют высокие риски развития аутоиммунного СД 1-го типа.
Библиографическая ссылка
Райимова Ф.С., Душанова Г.А., Кан С.В. ВЗАИМОСВЯЗЬ ПОЛИМОРФИЗМА ГЕНА TNF-A G-308A С АКТИВНОСТЬЮ ЦИТОКИНА TNFΑ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 1-ГО ТИПА, ПРОЖИВАЮЩИХ В САМАРКАНДСКОЙ ОБЛАСТИ // Научное обозрение. Биологические науки. 2024. № 3. С. 80-84;URL: https://science-biology.ru/ru/article/view?id=1378 (дата обращения: 10.02.2026).
DOI: https://doi.org/10.17513/srbs.1378


 science-review.ru
science-review.ru